PDMS微孔阵列细胞培养实验平台的初步构建与评测
何懿 栾杰
PDMS微孔阵列细胞培养实验平台的初步构建与评测
何懿 栾杰
目的 应用聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)为微孔支架材料制备微阵列细胞培养试验平台,对大鼠脂肪干细胞(ADSCs)在不同孔径微阵列中的贴附能力进行研究。方法 采用PDMS为微孔支架材料,制备20 μm、40 μm、60 μm和80 μm不同孔径微阵列,将大鼠ADSC单细胞接种其上,分别对各组中细胞的贴附能力及形态进行观察及检测。结果 硅晶圆模板经酸性双氧水清洗倒模后形成的PDMS微阵列支架基本符合设计要求;ADSCs直接种植在未经预处理的支架上时,细胞贴附能力明显下降;而经10%胎牛血清(FBS)培养基完全浸泡预处理后,细胞在PDMS表面的贴附及存活能力提高;体外培养120 h时,不同孔径的微孔内细胞生长总数具有显著性差异。结论 在PDMS材料上可以制作适合于大鼠ADSCs生长的不同直径的微孔阵列。
微孔阵列 微尺度技术 聚二甲基硅氧烷
组织工程技术发展迅速,但是目前还存在着许多需要解决的问题,如细胞纯化、种子细胞体外培养后生物学性状改变、天然或人工支架材料三维结构难以精细控制以及支架内种子细胞生物学特性检测手段不力等问题,这些问题限制了组织工程研究的进一步发展及临床应用的推广。
微尺度技术(Microscale technologies)为解决上述问题提供了新的思路。该技术是在1 μm~1 mm尺度范围内进行工程设计、制备和分析的新技术[1]。利用微尺度技术加工的微孔阵列(Micro-well arrays)可以在不同材料(玻璃、硅、PDMS、PLGA等)表面生成大量(每平方厘米内有数百至数千个)微孔,微孔的形态、排列及密度可根据实验内容而异。将微孔阵列应用于组织工程及细胞生物学研究,将具有前所未有的潜力,是解决诸多难题的潜在的有力工具[2]。更为重要的是,微孔阵列不仅能满足高通量检验的需求,尤其适用于数量少、来源宝贵的干细胞研究[3]。
本实验利用微阵列技术,采用聚二甲基硅氧烷(Polydimethyl-siloxane,PDMS)为微孔支架材料,对大鼠脂肪干细胞(ADSCs)在不同孔径微阵列中的贴附能力进行研究,以期验证微孔阵列这一新兴实验平台在干细胞研究中的可行性,同时初步明确细胞在微孔阵列三维培养平台上的细胞生物学特点,为干细胞组织工程的深入研究打下基础。
1 实验材料及方法
1.1 实验设备及材料
光刻机:德国Karl Suss公司MA6/BA6型,波长为紫外光(i线)356 nm;台阶仪:KLA-Tencor P-6;电感应耦合等离子体(Inductively Coupled Plasma,ICP);刻蚀机:Alcatel 601E-D 型;刻蚀气体:C4F8和SF6。 聚二甲基硅氧烷(Polydimethylsiloxane,PDMS):Sylgard 184 Silicon Elastomer Kit(Dow Corning,USA)。
1.2 光刻掩膜加工及光刻流程
1.2.1 掩膜设计及加工
依照图1样式设计硅晶圆加工前的掩膜。所设计图形每片面积1 cm2,内有约6 800~6 900个微孔。
采用步进机(Stepper)刻画,激光束直接在涂有铬层的5''玻璃板上刻画,边缘起点5 mm。用步进机重复将掩膜原版(Reticle mask)比例缩小到master mask上,应用到实际曝光中的为工作掩膜(Working mask),工作掩膜由master mask复制而来。
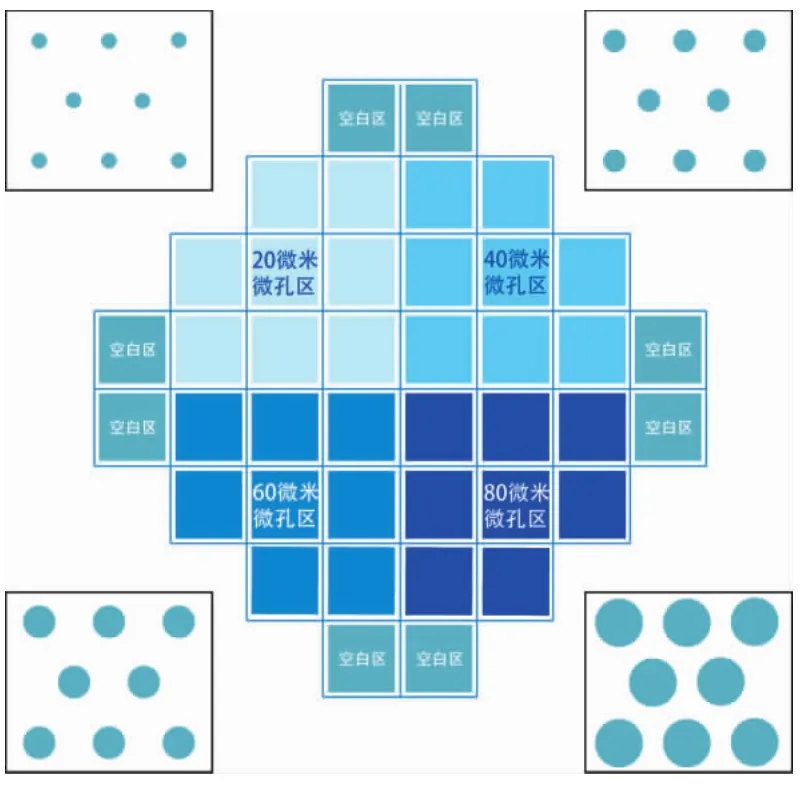
图1 微孔阵列光刻掩膜设计Fig.1 The photolithography mask design of microwell arrays
1.2.2 光刻流程
硅晶圆表面经清洁、干燥后,均匀涂布光刻胶并加热使其部分蒸发。上光刻机后将掩膜板和图形在涂布光刻胶的硅晶圆上精准对焦后曝光。利用有机溶剂去除非聚合光刻胶,加热,继续蒸发溶剂。经检查表面对准良好、无明确缺陷后,将晶圆顶层没有光刻胶保护的开放部位刻蚀去除,刻蚀深度控制在20~30 μm范围。随后溶解光刻胶,检查晶圆表面结构规整程度及是否存在加工缺陷。清洗,烘干,装盒备用(图2)。
1.3 PDMS模板的生成与加工
1.3.1 硅晶圆的清洗
采用双氧水体系清洗,除去原子、离子等不可见污染。将经过光刻、带有阵列结构的硅晶圆完全浸没于成分比为 H2SO4(98%)∶H2O2(10%)=5∶1(或 4∶1)的酸性液中清洗,将硅晶圆表面的有机物分解去除。随后,用超纯水冲洗后,再用成分比为 H2O∶H2O2∶NH4OH为 5∶2∶1(或 5∶1∶1,或 7∶2∶1)的碱性清洗液清洗,使金属离子形成可溶性络合物而溶于水。然后,使用成分比为 H2O∶H2O2∶HCL=7∶2∶1(或 5∶2∶1)的酸性清洗液,使金属微粒生成溶于水的络合离子,从而达到清洗目的。
1.3.2 硅晶圆表面处理
在浇注PDMS前用氟硅烷试剂对模板表面熏蒸120 min,也可将经过超声清洗后的硅晶圆浸泡于含有5%油污洗涤剂的去离子水溶液中,使微孔板表面黏附上一层稀薄的洗涤剂成分薄膜。随后图形面向上放置于烘箱内80℃烘干,经PDMS浇筑后,发现可以有效减少脱模张力,保护硅晶圆表面结构。
1.3.3 PDMS微孔板的形成
本实验选用硅橡胶预聚物Sylgard 184 Silicon Elastomer Kit(Dow Corning,USA),由液体 A、B 两组分组成,可按10∶1重量比混合为中等黏度的混合液,具体实验流程如下:①取弹性模板材料PDMS前驱物A组分(基本组分)10 g至玻璃培养皿内。②按质量比10∶1加入B组分(固化剂)1 g充分混合均匀,放入真空干燥罐中负压抽吸30 min,去除因搅拌产生的气泡。③将混合好的PDMS混合液倾倒于硅晶圆表面,水平放置于真空条件下保持负压抽吸1 h,去除残留的气泡。随后水平置入鼓风干燥箱80℃烘烤2 h,固化后剥离得到表面复制精细图形的弹性模板。④将图形转移后的PDMS板用手术刀沿微孔区域间的分割线切割,将切割好的微孔板图形面朝下置于盛有95%乙醇的大烧杯中,后置于水平摇床上以100 r/min的速度晃动清洗,之后用去离子水将残留的乙醇冲洗干净,将微孔板表面朝下水平浸入盛有去离子水的超声清洗仪液面下,超声清洗8 min,共3次;然后,依据微孔不同孔径分装于玻璃培养皿内。⑤消毒采用乙醇浸泡法或高温高压消毒法。
如采用乙醇浸泡法,可直接将清洗好的微孔板依照实验设计分装于塑料培养皿内,使75%乙醇完全浸泡微孔板,根据挥发量每24 h补充一次乙醇。实验前24 h停止添加乙醇,打开培养皿,置于通风橱或生物安全柜中,紫外光照射,待其自然挥发干燥后封口备用。
如采用高温高压消毒法,可将切割为1 cm2的小块分装于不同玻璃培养皿内。将分装好的PDMS微孔板进行高温高压消毒。消毒后再于生物安全柜中将微孔板分装于灭菌塑料培养皿内,待其干燥后封口备用。
1.3.4 PDMS微孔板扫描电镜计量
倒模后形成的PDMS微孔板经喷金后行扫描电镜观察,分别测量 20 μm、40 μm、60 μm 和 80 μm孔的直径,以20 μm口径微孔板为例,误差率小于5%(图3),满足实验设计需要。

图3 20 μm微孔精度测量(扫描电镜,1 000×)Fig.3 The measurement of 20 μm pore precision(SEM,1 000×)
1.4 实验分组
经预实验发现,对于大鼠ADSCs而言,20 μm孔径过小,细胞很难进入,故将其翻转180°,取其背面平坦表面为空白对照。
经预实验筛选,接种细胞浓度在5×105cells/L时,可使一个细胞占据单个微孔的比例最高。
1.4.1 分组一
为检验PDMS的生物安全性,设计将纯平面空白板共20块浸泡于含10%FBS的DMEM培养基中,根据浸泡时间设计A、B、C、D、E和F共6组,每组 4板,分别为未浸泡组及浸泡 24 h、48 h、72 h、96 h和120 h组。
1.4.2 分组二
将消毒的PDMS微孔板在生物安全柜内分装于培养皿内,每一皿中分别包含空白板、40 μm、60 μm和80 μm各1片,共6皿。分装后将微孔板浸泡于含10%FBS的DMEM培养基中72 h(图4)。

图4 4种PDMS微孔板用含10%FBS的DMEM浸泡Fig.4 Four kinds of PDMS micro-well plates immersed in 10%FBS DMEM medium
1.5 大鼠ADSCs的分离与培养
于无菌条件下切取400 g左右成年雄性SD大鼠腹股沟区脂肪垫,用组织剪剪碎后放入0.12%Ⅰ型胶原酶溶液中,于37℃下水平摇床(120 r/min)震荡1 h,然后加入等量的10%胎牛血清、1%青链霉素及DMEM培养基以中和胶原酶。消化后的细胞悬液离心后重悬至上述培养基中,并经100 μm细胞筛过滤,过滤后的细胞悬液接种在100 mm2培养皿中,24~48 h后换液,待细胞进入对数生长期,胰酶消化后与不含抗生素的10%FBS培养基混匀接种于六孔板中待转染。取一部分原代培养的细胞接种于六孔板中,用于成骨及成脂诱导鉴定。
1.5.1 ADSCs的成脂诱导及成脂分化鉴定
ADSCs经胰酶消化后以1×105个/孔的密度接种到六孔板中,细胞贴壁后换用成脂诱导培养基(1 μM dexamethasone,0.5 mM IBMX,200 μM indomethacin,10 μM Insulin)隔日换液至诱导后 10 d。
细胞爬片以含钙福尔马林固定15 min,水洗后60%异丙醇孵育2 min,油红O染色30 min,70%乙醇分色1~2 min,镜下控制染色时间。
1.5.2 ADSCs的成骨诱导及成骨分化鉴定
ADSCs经胰酶消化后以1×105个/孔的密度接种到六孔板中,细胞贴壁后换用骨诱导培养基(50 μM ascorbate-2-phosphate,10 mM β-磷酸甘油及 0.01 μM 1,25-dihydroxyvitamin)。另一组细胞换用正常培养基作为对照,成骨诱导持续4周。
1.5.2.1 茜素红染色
细胞爬片以95%乙醇固定10 min,水洗后放入0.1%茜素红染料中37℃孵育30 min。
1.5.2.2 碱性磷酸酶染色
细胞爬片以柠檬酸丙酮缓冲液固定30 sec,并使用 Naphthol/Fast blue染料 (Sigma-Aldrich Kit 85L2-1KT,USA)染色 30 min,苏木素复染 3 min。
1.5.2.3 骨钙素免疫组化染色
细胞爬片10 mM(pH 6.0)柠檬酸钠缓冲液中热修复20 min,5 μg/mL羊抗鼠骨钙素一抗和Avidin-HRP Kit(Santa Cruz Biotechnology,Santa Cruz,CA)按试剂盒说明进行染色。
1.6 大鼠ADSCs的种植
1.6.1 分组一
在24块空白板表面种植5×105cells/L浓度的大鼠ADSCs,滴悬液100 μL,以略少于微孔板数量的密度进行种植。在高倍镜(40×)下对50个独立视野进行拍照,计量种植后 4 h、24 h、48 h、72 h、96 h和120 h等不同时间点板载细胞数,取所得细胞数量平均值绘图。戊二醛固定,扫描电镜观察。
1.6.2 分组二
4种不同微孔板表面种植大鼠ADSCs,以浓度5×105cells/L的滴悬液100 μL种植于微孔板表面,并以相同浓度细胞悬液400 μL在普通培养皿内种植。 于种植后 1 d、2 d、3 d、4 d、5 d、6 d 和 7 d 在高倍镜下对50个独立视野拍照,计量普通培养皿表面、空白组表面和不同孔径微孔内细胞数量变化,取细胞数量平均值绘图。戊二醛固定,扫描电镜观察。
2 结果
2.1 大鼠ADSCs培养
细胞于诱导开始后即停止分裂增殖,由长梭形变成不规则的圆形,体积增大,大小不一。最早于诱导后4 d即可在细胞内看到小脂滴,脂滴逐渐增多,有的融合形成较大的脂滴。诱导14 d时细胞分化达到高峰,经油红O染色证实为脂滴(图5)。
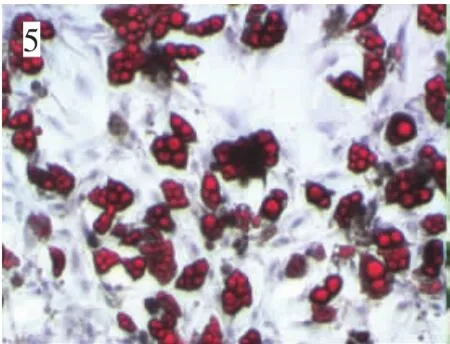
图5 大鼠ADSCs成脂诱导10 d(油红O染色,光镜,40×)Fig.5 Rat ADSCs adipogenic for 10 days(Oil red O staining,40×)
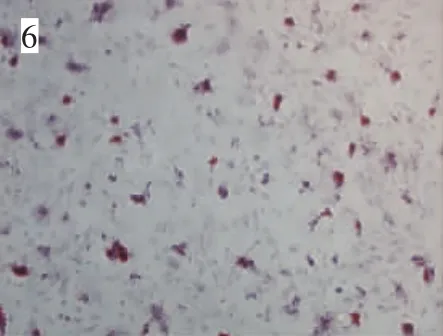
图6 大鼠ADSCs成骨诱导4周(茜素红染色,光镜,40×)Fig.6 Rat ADSCs osteogenic for 4 weeks(Alizarin red staining,40×)
体外传2代后,换骨诱导培养基培养,细胞由长梭型成纤维细胞样逐渐变为圆形及多角形,细胞间相互聚集成结节状,诱导4周后有大团骨结节形成。骨结节的结构在茜素红染色中显示较强的红色(图6);碱性磷酸酶染色显示,经诱导的ADSCs尤其是骨结节形成区域附近,有明显的碱性磷酸酶活性升高表现(图7)。骨钙素免疫组织化学染色显示,经诱导的ADSCs呈阳性表现,尤以细胞核和骨结节区域更明显(图8)。未诱导组均未发现上述阳性结果。
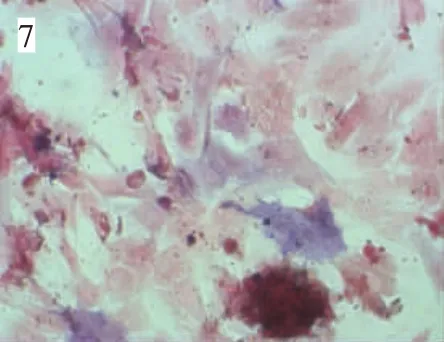
图7 大鼠ADSCs成骨诱导4周(碱性磷酸酶染色,光镜,200×)Fig.7 Rat ADSCs osteogenic for 4 weeks(Alkaline phosphatase staining,200×)

图8 大鼠ADSCs成骨诱导4周(骨钙素免疫组化染色,光镜,40×)Fig.8 Rat ADSCs osteogenic for 4 weeks(Immunohistochemical staining of osteocalcin,40×)
本研究利用原代细胞培养技术从大鼠脂肪组织中分离出ADSCs进行体外培养,可以进行成脂、成骨分化,具有多向分化潜能。经初步鉴定,证实其为ADSCs。
2.2 实验一部分
未经培养液预处理的PDMS空白板,种植细胞后细胞存活天数明显少于正常培养皿内的细胞。PDMS空白板浸泡于含10%FBS的DMEM培养基内的时间越长,细胞存活数量越多(图9)。细胞于浸泡达72 h的空白板表面稳定生长,数量增殖不明显。同时,继续延长浸泡时间对于细胞数量的增加并无明显作用(图10)。
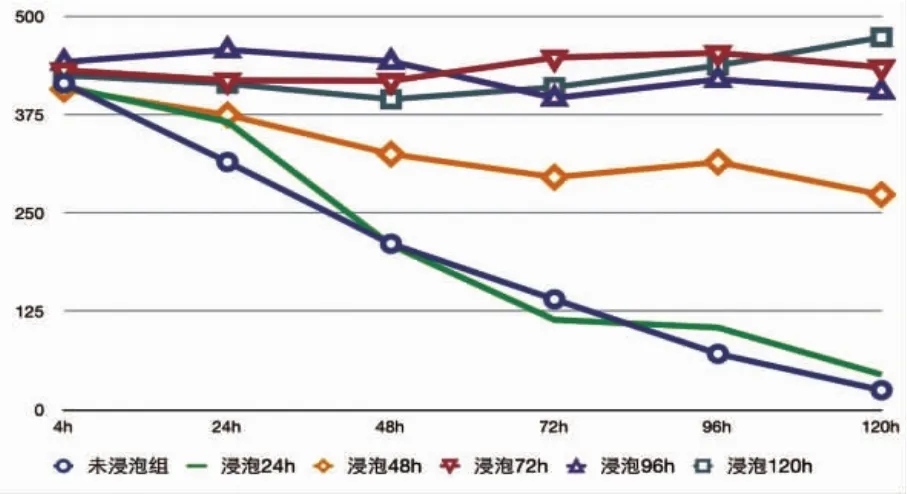
图9 含10%FBS的DMEM培养基浸泡时间不同对PDMS板载细胞数量的影响Fig.9 The cell numbers of PDMS plates that immersed in DMEM medium containing 10%FBS for different times

图10 含10%FBS的DMEM培养基浸泡72 h不同平面细胞存活数量的比较Fig.10 The cell numbers of different kinds of PDMS plates immersed in DMEM medium containing 10%FBS for 72 h
扫描电镜观察,对照组细胞体积差异较大,形态不均一。细胞呈梭形、多角形爬附于PDMS表面。随着培养时间的延长,邻近细胞间接触增多,可见细胞间的交叉、堆叠(图11)。
2.3 实验二部分
根据细胞数量绘制生长曲线,普通培养皿培养的细胞可见平台期、对数生长期,细胞增殖曲线呈“S”型。
PDMS空白组并未出现普通培养皿的增殖曲线,且其数量随时间延长而少量增加。细胞形态改变同实验一。
不同微孔板间,仅40 μm孔径组细胞数量较其他各组有所增加。同60 μm组和80 μm组相比,40 μm组细胞增殖更明显(P<0.05)。因受微孔空间限制,细胞不会铺满生长区域,ADSCs在具有微孔结构的PDMS板上会依据微孔形态、大小贴附后生长,并在微孔内伸出伪足状结构(图12),细胞所能延展的大小完全受微孔尺寸限制。

图11 大鼠ADSCs在PDMS表面培养72 h(扫描电镜,1 000×)Fig.11 ADSCs cultured on PDMS surface for 72 h(SEM,1 000×)

图12 大鼠ADSCs在PDMS表面培养96 h(扫描电镜,1 000×)Fig.12 ADSCs cultured on PDMS surface for 96 h(SEM,1 000×)
3 讨论
3.1 微孔阵列技术
3.1.1 微孔阵列技术应用于组织工程领域的必要性三维空间物理因素对细胞生长、发育存在影响已经越来越被学者所认同。传统组织工程技术通常先在平面培养皿内培养扩增种子细胞,再将细胞接种于支架植入实验动物体内以观察支架细胞复合体的治疗效果。这种方法存在很多无法克服的缺点:①经分离培养后的细胞,仍不能做到完全的纯化,接种于支架内的细胞常常是混杂的多种细胞,某些独立细胞系的真实状态被这种混杂状态所掩盖;②种子细胞在体外普通平面培养过程中其生长环境较体内发生了巨大改变,其相应的生物学性状也极有可能发生了改变,对于其接种并植入体内后的生物学行为造成的影响无法估量;③现有的支架材料,无论是天然的还是人工的,其内部空间结构大多复杂、不规整,其立体三维结构很难严格控制,对种子细胞的生物学行为也存在无法预测的影响;④细胞接种支架后,其生物学行为大部分只能应用组织切片方法才能观察。而组织切片过程可能造成支架、细胞结构破坏或移位,无法实现100%的真实还原。以上缺点导致实验者无法确定是什么样的细胞生长于什么样的空间环境中,而细胞的生长状态如何也不得而知,使得组织工程的研究应用缺乏严谨、科学的细胞学基础。
微尺度技术是在1 μm~1 mm尺度范围内进行工程设计、制备和分析的新技术。利用微尺度技术加工的微孔阵列可以在不同材料(玻璃、硅、PDMS、PLGA等)表面生成大量(每平方厘米内有数百至数千个)微孔。将微孔阵列应用于组织工程及细胞生物学研究领域,是解决这一领域诸多难题的潜在有力工具[2],随着软印模技术和光刻技术的不断发展,使得微孔阵列也越来越多地应用于生物医学的研究中。
本实验中,为保证单位面积(1 cm2)内微孔数量恒定,将各孔的水平排列设计为斜60°,将此阵列各微孔中心点间距固定为120 μm,即各孔间排列为正三角形(图13),孔间距在各方向上保持基本相等。

图13 不同孔径PDMS微孔透光性观察(光镜,100×)Fig.13 The translucent observation of different size of PDMS micro-well plates(optical microscopy,100×)
3.2 PDMS生物安全性
PDMS是一种透明(透光率可达100%,图11)、安全无毒、生物相容性好的弹性材料,广泛应用于绝缘、润滑、防水、防震和防油尘领域,可直接应用于组织工程支架的构建[3]。PDMS具有生理惰性、良好的化学稳定性、电绝缘性,其耐热性、耐寒性好,黏度随温度变化小。其表面张力小,并具有很高的抗剪切能力,可在-50~200℃下长期使用。以PDMS为材质的微孔阵列具备良好的物理化学属性[3]。
3.3 硅晶圆清洗及预处理
3.3.1 硅晶圆清洗
采用双氧水体系清洗效果好,环境污染小,可将硅晶圆表面的有机物、金属离子、微粒彻底清除。图14为未经清洗倒模的PDMS板(A)和经过清洗后倒模的PDMS板(B),若不清洗会造成倒模生成的PDMS表面残留过多的杂质微粒,影响实验结果。

图14 硅模板清洗前后倒模生成PDMS微孔板对比(光镜,40×)Fig.14 The comparison of PDMS micro-well plates generated from silicon master before(A)and after(B)cleaning (optical microscopy,40×)
3.3.2 硅晶圆表面预处理
在预实验中,我们发现表面脱模不良可以导致PDMS板撕裂、硅模板微柱断裂,尤其是PDMS用量较大、微孔板较厚、固化剂添加比例偏多时更为严重(图15),硅晶圆表面的微柱结构可因脱模时的成角剪切力而断裂。故此,添加脱模剂或进行表面硅烷化处理对于保护硅模板和新形成的PDMS微孔板同样重要。

图15 微孔结构破坏Fig.15 The destruction of microporous structure
我们将经过超声清洗后的硅晶圆浸泡于含有5%油污洗涤剂的去离子水溶液中,使微孔板表面黏附上一层稀薄的洗涤剂成分薄膜。随后图形面向上放置于烘箱内80℃烘干,经PDMS浇筑后发现此法也可有效减少脱模张力,保护硅晶圆表面结构。
3.4 PDMS加工、清洗及预处理
3.4.1 PDMS微孔板加工注意事项
本实验选用的硅橡胶预聚物Sylgard 184 Silicon Elastomer Kit(Dow Corning,USA),由液体 A、B组分组成的套件产品,包括基本组分与固化剂。无论厚薄,混合液将固化成为具有韧性的透明弹性体。此产品为A、B剂混合硅胶,按10∶1重量比混合为中等粘度的稠度混合液。
Sylgard 184的固化反应起始于混合过程的开始,其适用期随温度增高而缩短(适用期的定义为基本组分与固化剂混合后,黏度增至原来的两倍所需的时间)。起初的固化现象是黏度逐步增加,接着开始出现凝胶,然后转变为弹性固体。温度会对固化时间产生明显影响(材料用量大者需要适当延长固化时间),室温下固化时间大于48 h,100℃约需35 min,125℃约需20 min,150℃约需10 min。
使用此材料时(未固化)前,不可接触到胺类(如环氧树脂),硫化物(如PU)及不饱和碳氢塑料(如PVC),否则会抑制此材料的固化反应,造成永久黏连、不固化。在预实验阶段,配制PDMS混合液时曾使用PVC塑料棒搅拌,导致室温下固化48 h不能完全固化,即使经过100℃加热固化仍存在拉丝、黏连等不凝固现象。这种不完全固化不仅会造成脱模困难,更为严重的是,可能在硅晶圆模板表面残留不凝固PDMS成分,最终影响重复倒模的精确度。
3.4.2 PDMS板的清洗及再利用
光刻形成的硅晶圆模板表面经过清洗后,浇筑脱气泡的PDMS,经热固化后剥离可生成符合设计要求的微孔板,可以直接用于细胞培养(图12)。利用这种方法加工所得的微孔阵列,精度高、表面质量好,制作效率高,原材料的利用率接近100%[4]。
硅晶圆经过清洗,表面杂质、微粒已大大减少,但为保证实验精确、安全,推荐于实验分皿前用乙醇容积震荡、超声波等清洗方法彻底去除表面杂质。
使用过的PDMS板,也可使用胰酶将表面残留细胞、碎片清除,然后经上述方法清洗、消毒后,微孔板还可以重复使用。
3.4.3 PDMS表面预处理
根据Charnley等[3]的研究报告,PDMS疏水性强,且对培养介质内的蛋白成分(如生长因子)有较强的吸附作用,会影响正常细胞的生长繁殖。故在随后的实验设计中改进支架处理工艺,将支架浸泡于培养液内一段时间,可明显提高细胞在PDMS表面的存活时间。但是,对于爬附能力低或未贴壁的细胞,则有可能从PDMS表面脱落。此外,在培养过程中的搬运、晃动、换液冲刷等也可导致未贴附紧密的细胞从PDMS表面脱落。
有学者利用氧等离子处理PDMS和玻璃表面,再经培养液浸泡过夜后其表面亲水性在培养液浸泡前后存在明显差异,经培养液浸泡的两种材料表面亲水性都大大增加,蛋白质的吸附为增加表面亲水性的原因[5]。有一点需要特别指出,细胞在微孔阵列中的生长远远不同于常规培养,主要原因是微孔结构提供了与常规培养不同的生长微环境[6]。细胞增殖到平台期时并没有铺满生长区域,我们估计原因是随着细胞数目增多,微孔内培养溶液体积相对变小,使得营养供应不充分;并且较多的细胞代谢产物累积在周围,形成了一个不利于细胞生长的微环境,导致细胞生长停滞。
3.5 PDMS表面及微孔内细胞生物学表现
PDMS材料会吸附蛋白质,若不进行表面处理则无法直接用作细胞培养。经过含血清培养基浸泡处理后的PDMS表面具备基本的细胞黏附、生长条件,基本满足细胞培养的需要,可以作为细胞学研究的实验平台。PDMS表面细胞增殖数量低于普通培养皿表面,应该同PDMS的蛋白吸附作用有关。
细胞在微孔阵列中的生长远远不同于常规培养,主要原因是微孔结构提供了与常规培养不同的生长微环境[7],微孔的立面结构给细胞提供了很好的空间依附,在这样的空间结构帮助下,细胞有两个面与材料表面接触,能够更稳定地在PDMS表面生长。
掉落于微孔内的细胞并未出现大量增殖,可能与微孔结构围成的小环境有关。细胞贴附于PDMS表面后,必须保证自身在PDMS材料上的良好贴附才能有所生长。若微孔结构过大(60 μm、80 μm),就接近平面培养,虽可以与邻近微孔立面接触,但仍需要伸展到较大面积方可完成稳定爬附。小一些的微孔结构(40 μm),对于细胞而言,并不需要延展就可与多个立面接触,故此爬附面积小,也就形成了填满微孔的现象。因此我们认为,当微孔直径与参与实验的细胞大小相适宜时,细胞的生长比较稳定。
微孔内的细胞较普通平面培养的细胞增殖减少。我们认为这种空间结构对细胞增殖、生长存在抑制作用。这种抑制应属于一种比较“温柔”的抑制,更接近于细胞在体内准备阶段的生活状态。过度生长旺盛的细胞并不能代表这种细胞的真实生理状态。故此,40 μm孔径的微孔内细胞生长能够实现稳中有升,应该与其内部容积接近大鼠脂肪干细胞的平均体积有关。
4 结论
利用微加工技术可以在PDMS材料上制备适合于大鼠ADSCs生长的不同直径的微孔结构。微孔阵列实验平台可以根据实验设计的不同进行精细调整,更精确地研究具体的科学问题。本实验中硅晶圆模板经酸性双氧水清洗、倒模后形成的PDMS微阵列,表面结构精细,基本符合设计要求。
细胞直接种植在未经预处理的支架上时细胞贴附能力明显下降,而经10%FBS培养基完全浸泡预处理后,细胞在PDMS表面的贴附及存活能力提高。
体外培养120 h时,其他条件保持恒定,不同孔径(40 μm、60 μm、80 μm)的微孔内细胞生长总数具有显著性差异,40μm微孔较60μm和80μm微孔更适宜细胞生长,证明不同孔径微孔对大鼠ADSCs生长存在影响。
光刻和软印模技术的广泛应用、不断成熟,使得微孔阵列技术成为组织工程学的有力工具。但利用微孔阵列平台进行细胞生物学实验,仍须注意生物材料的选择及表面处理方法等对细胞活性的影响。因此,在实验中必须仔细研究材料对细胞活动的影响,才能根据不同的实验方法选择适宜平台制作的材料和操作方法,从而得到可靠的实验结果。
[1]Andersson H,van den Berg A.Microfabrication and microfluidics for tissue engineering:state of the art and future opportunities[J].Lab Chip,2004,4(2):98-103.
[2]Whitesides GM,Ostuni E,Takayama S,et al.Soft lithography in biology and biochemistry[J].Annu Rev Biomed Eng,2001,3:335-373.
[3]Charnley M,Textor M,Khademhosseini A,et al.Integration column:microwell arrays for mammalian cell culture[J].Integr Biol,2009,1(11-12):625-634.
[4]沙菁契,侯丽雅,章维一,等.基于微立体光刻技术的组织支架的制备[J].华中科技大学学报(自然科学版),2007,35(z1):61-63.
[5]王亮,陈红,宋巍,等.有机硅弹性体表面生物相容性的研究进展[J].高分子通报,2007,10:21-25.
[6]邵建波,吴蕾,赵辉,等.不同材质微芯片内细胞生长状态分析[J].生物物理学报,2008,24(4):268-271.
[7]Walker GM,Zeringue HC,Beebe DJ.Microenvironment design considerations for cellular scale studies[J].Lab Chip,2004,4(2):91-97.
The Initial Construction and Evaluation of PDMS Porous Array Platform for Cell Culture Experiments
HE Yi,LUAN Jie.Department of Plastic and Reconstructive Surgery of the Breast,Plastic Surgery Hospital of CAMS,Beijing 100144,China.
LUAN Jie(E-mail:doctorluan@hotmail.com).
ObjectiveTo establish a cell culture platform by using PDMS (Polydimethylsiloxane,PDMS)as porous scaffold materials and to test the attachment rate of rat adipose-derived stem cells(ADSCs)on different aperture microarray.MethodsThe micro-well arrays plates were designed by using PDMS (Polydimethylsiloxane,PDMS) porous scaffold materials at 20 μm,40 μm,60 μm and 80 μm pore sizes respectively.The single rat ADSC was inoculated on it.The morphology was observed and the attachment rate of cells were detached in each group.ResultsThe reverse mould pretreated PDMS microarray stent meets the requirements of the experiment after acid hydrogen peroxide washing;The cell attachment rate decreased significantly when the cells were planted directly on the stent without pretreatment while the cell attachment and survival rate increased significantly when the cells were planted on the stent pretreated by 10%FBS(Fetal bovine serum);There are significant differences of the total cell number between the different porous aperture at 120 h in vitro.ConclusionVarious diameter micro-well arrays could be produced on the surface of PDMS to facilitate the growth of rat ADSCs.
Micro-well arrays;Micro-scale technology;Polydimethylsiloxane
Q813.1+1
A
1673-0364(2011)03-0121-08
10.3969/j.issn.1673-0364.2011.03.001
100144 北京市 中国医学科学院整形外科医院乳房整形与再造中心。
栾杰(E-mail:doctorluan@hotmail.com)。
2011年5月8日;
2011年6月12日)
