邻苯三酚红-铜(Ⅱ)分光光度法测定牛奶中的蛋白质
马占玲,顾佳丽,曾凌
(渤海大学化学化工与食品安全学院,辽宁锦州,121013)
目前有不少测定蛋白质的方法,如凯氏定氮法、分光度法[1-6]、荧光法[7]和新发展起来的共振瑞利光散射分析法[8-9]等。分光光度法因其简便、快速、经济和准确等特点而得到广泛应用。其中应用最多的是考马斯亮蓝法。染料结合法也是一种简便而常用的方法,目前文献报道的染料有:曙红[10]、茜素红、四溴萤光黄二钠盐、钙黄绿素[11]、偶氮胂(Ⅲ)-镧(Ⅲ)[12]等。但这些方法均存在受杂质干扰严重,操作复杂,不稳定等缺点。本文研究了一种新的测定牛奶中蛋白质的光度分析法——邻苯三酚红-铜络合物法,采用该方法测定牛奶中的蛋白质含量,获得较理想的分析结果。
1 材料与方法
1.1 试剂
牛血清白蛋白(BSA),上海丽珠东风生物技术有限公司;邻苯三酚红、CuSO4(均为分析纯)。
1.2 仪器
756紫外-可见分光光度计,上海光谱仪器有限公司。
1.3 实验方法
在中性条件下,邻苯三酚红与铜络合生成紫色络合物,加入BSA或牛奶后颜色变深。分别测定增色前后吸光度值,然后求出吸光度差值ΔA。因为ΔA与蛋白质的浓度成正比,进而求出样品中蛋白质的含量。
2 结果与分析
2.1 最大吸收波长的确定
牛血清白蛋白标准溶液在最佳条件下使邻苯三酚红铜的络合体系增色,用去离子水做参比,对增色体系进行波长扫描,确定最大吸收波长,结果见图1。
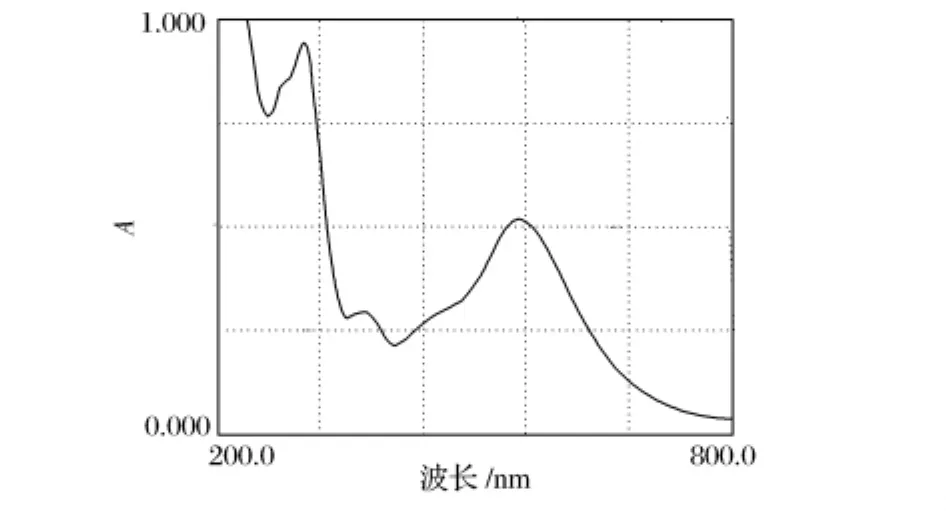
图1 最大吸收波长扫描图
从图1看出,吸收曲线呈不规则抛物线形,在200~800 nm有2个吸收峰。本实验选择第2个吸收峰所对应的波长517 nm为测量波长。
2.2 最佳实验条件的确定
2.2.1 邻苯三酚红最佳用量的确定
在固定其他显色条件不变的前提下,只改变邻苯三酚红溶液的体积V邻,测其吸光度。同时测定未加牛血清白蛋白工作液体系的吸光度,计算两溶液的吸光度之差ΔA,结果见图2。
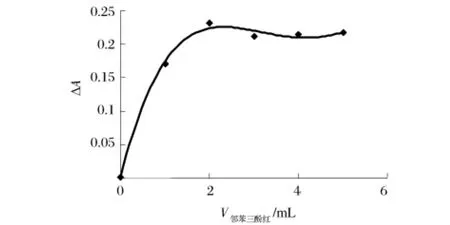
图2 邻苯三酚红用量对吸光度差值的影响
从图2看出,邻苯三酚红的体积在0~2.00 mL,ΔA随邻苯三酚红用量的增加而增大,邻苯三酚红溶液的体积在2.00 mL后吸度差值变化不大,因此选择2.00 mL为邻苯三酚红溶液的最佳用量。
2.2.2 CuSO4溶液的用量
按实验步骤操作,只改变CuSO4溶液的用量,考察它对吸光度之差ΔA的影响。在0.00~0.80 mL,ΔA随CuSO4溶液体积的增加逐渐增大,在0.80 mL时达到最大值。当体积大于0.80 mL后,吸光度差值逐渐减小。因此选择0.80 mL为CuSO4的最佳用量。即邻苯三酚红与Cu2+的最佳摩尔比是5∶2。
2.2.3 加热温度的确定
取2个50 mL容量瓶,加入14.00 mL邻苯三酚红-Cu2+混合溶液,一只容量瓶中加入5.00 mL牛血清白蛋白工作液,另一只容量瓶不加。在不同温度下放置10 min,然后在517 nm处测量其吸光度之差ΔA。试验发现,ΔA在10~30℃变化较小,30℃以后逐渐减小,因此选择20℃为测量温度。
2.2.4 反应时间的确定
按实验操作步骤,显色体系在室温下静置不同时间后立刻用紫外可见分光光度计在517 nm处测量其吸光度之差ΔA,考察时间对吸光度差值的影响,结果见图3。

图3 反应时间对△A的影响
由图3可见,反应在5~50 min,ΔA随时间的延长而变化不大,可见反应体系比较稳定。综合考虑,选择反应时间为10 min。
2.3.5 工作曲线的绘制
取6个 10 mL比色管,分别加入 0.00、0.20、0.40、0.60、0.80、1.00 mL 牛血清白蛋白标准工作液和2.80 mL邻苯三酚红与CuSO4的混合溶液;在最佳实验条件下进行显色,测量。以牛血清白蛋白的浓度为横坐标,ΔA为纵坐标,绘制工作曲线。得到工作曲线方程为 ΔA=0.01c-0.025 5,相关系数为0.990 3。
2.3.6 样品测定
采用本方法对市售牛奶进行测量,同时采用国标法——乙酰丙酮,甲醛法进行对比试验,结果见表1。
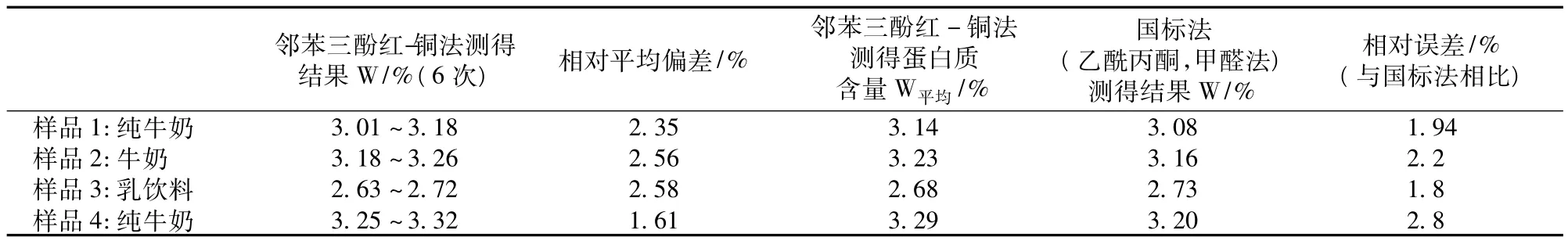
表1 样品测定结果
由表1可见,采用邻苯三酚红-铜(Ⅱ)法测定牛奶中蛋白质的含量与国标法相比,误差在1.8% ~2.8%,准确度较高,而且精密度较好,相对平均偏差在1.61%~2.58%。
2.3.7 回收率的测定
4个加标回收实验测得结果见表2。回收率在93.1% ~108.5%,在光度允许误差范围之内。

表2 回收率的测定
3 结论
采用中性邻苯三酚红-铜(Ⅱ)络合体系测定牛奶中蛋白质含量,方法准确度较高,精密度也较好,而且显色体系比较稳定。采用该方法测定多种牛奶样品中的蛋白质含量,与国标法比较,结果令人满意。
[1] 胡庆红,刘绍璞,罗红群.偶氮羧Ⅰ分光光度法测定蛋白质[J].分析科学学报,2002,18(2):115-119.
[2] 胡庆红,刘绍璞,范莉.蛋白质对铬蓝SE的褪色反应及其分析应用[J].分析化学,2002,30(1):42-45.
[3] 胡秋娈.分光光度法研究血清蛋白质与钍试剂I的作用[J].分析试验室,2000,19(1):48-50.
[4] 曹秋娥,李祖碧,王加林,等.偶氮胭脂红B与血清蛋白质相互作用的光度法研究及其分析应用[J].分析化学,2002(2):222-226.
[5] 迟燕华,庄 稼,李克安,等.茜素红S与人血清白蛋白相互作用的分光光度研究[J].分析测试学报,1999,18(1):9-12.
[6] 迟燕华,李 娜,庄 稼,等.以锌试剂显色法测定蛋白质的研究[J].高等学校化学学报,1998,19(6):879-881.
[7] 王全林,刘志洪,原 弘,等.胶束增敏催化荧光法测定血红蛋白[J].分析化学,2001,29(4):421-424.
[8] 范莉,刘绍璞,龙秀芬,等.某些变色酸双偶氮染料-蛋白质体系的共振光散射光谱及其分析应用[J].分析化学,2002,30(1):81-85.
[9] 冯宁川,龚国权.钍试剂Ⅱ与蛋白质作用的共振光散射特征及微量蛋白质的光散射测定[J].分析试验室,2002,21(1):58 -60.
[10] 宋功武,方光荣,李瑛等.曙红Y与牛血清蛋白作用的荧光光谱[J].分析化学,2000,28(5):659-660.
[11] 屈凌波,李建军,黄保军,石杰.钙黄绿素分光光度法测定人血清白蛋白[J],分析试验室,2007,26(9):92-94.
[12] 詹国庆,兰秋月.偶氮胂(Ⅲ)-镧(Ⅲ)褪色光度法测定蛋白质[J].分析试验室,2006,25(5):91-93.

