SN38对Fas介导凋亡效应的影响
曹妍,王欢,童晓鹏,单风平,梅原久範,吕昌龙*
(1.中国医科大学基础医学院免疫学教研室,辽宁沈阳110001;2.西藏民族学院免疫学教研室,陕西咸阳712000;3.金沢医科大学血液免疫内科,日本金沢920-0293)
细胞凋亡是在多种基因调控下的一个严密完整的、主动的、有序的死亡过程。Fas(CD95/APO-1)是TNF受体超家族成员,通过与Fas配体(FasL)或者抗Fas抗体(CH11)结合,诱导Fas分子聚集形成三聚体,通过其胞浆内的死亡结构域(death domain,DD)与Fas相关的死亡结构蛋白(Fas-associated death domain protein,FADD)结合,形成死亡受体诱导的信号复合体(DISC),DISC可以活化caspase分子介导细胞凋亡[1]。伊立替康(Irinotecan),也称为CPT-11,通过抑制拓扑异构酶Ⅰ(topoisomeraseⅠ,TopoⅠ)选择性杀伤S期细胞。SN38(10-hydroxy-7-ethyl-camptothe-cin)是CPT-11的活性代谢产物,其作用强度至少是CPT-11的1 000倍,并且具有广泛的抗肿瘤谱[2-3]。脂筏是细胞膜上富含胆固醇和鞘磷脂的微结构域(microdomain)。鞘磷脂(sphingomyelin,SM)是脂筏的重要组成成分。最近的一些研究表明,Fas介导的凋亡过程中,Fas可易位和聚集于脂筏所在区域[4],脂筏通过促进DISC的形成进而活化caspase依赖的细胞死亡途径。因此为深入探讨SN38与Fas介导凋亡的相互关系,本实验通过单独应用SN38或SN38联合CH11(Fas抗体)作用于脂筏阴性和脂筏阳性的T细胞淋巴瘤细胞株WR/Fas-SM(-)细胞和WR/Fas-SMS1细胞,观察SN38能否促进Fas介导的凋亡以及对2种细胞的效应差异,并进一步探讨脂筏在该过程中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞WR/Fas-SMS1细胞和WR/Fas-SM(-)细胞[5]由日本金沢医科大学血液免疫内科提供。
1.1.2 主要试剂二甲基亚砜(DMSO,SIGMAALDRICH);0.4%台盼蓝(Gibco);碘化丙啶(PI,Invitrogen);多聚甲醛;皂甙;琼脂糖(TAKARA);RPMI-1640培养液500 mL(Gibco,Invitrogen);CH11(Medical&Biological Laboratories,Japan);Genelute Mammalian Genomic DNA Miniprep Kit(Sigma);SN38(Yakult pharmaceutical,Japan)。
1.1.3 主要仪器流式细胞仪,FACSCalibur,美国BD公司;CO2细胞孵育箱,WJ-3,日本Harasawa;倒置显微镜,日本Olympus。
1.2 方法
1.2.1 细胞培养WR/Fas-SM(-)细胞和WR/Fas-SMS1细胞常规复苏后,培养于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的1640培养液中,于5%CO2,37℃培养箱内常规传代培养。
1.2.2 细胞处理常规收集并且计数细胞,调整细胞浓度为5×105/mL,接种24孔板,每孔1 mL。CO2细胞孵育箱中培养2 h后,分别加入不同浓度SN38和/或CH11刺激,混匀细胞后,放入CO2细胞孵育箱中继续培养。
1.2.3 形态学观察刺激细胞12 h后,于倒置显微镜下观察,并于放大400倍时拍照记录。
1.2.4 FACS检测细胞凋亡分别收集24孔板中处理后的WR/Fas-SM(-)细胞和WR/Fas-SMS1细胞于1.5 mL微量离心管中,1 200 r/min离心3 min,弃上清,每管加0.5%PFS(0.5%多聚甲醛,0.5%皂甙)100 μL,再加入150 μg/mL RNase A 50 μL。室温放置30 min后,每管加入1 mL PBS,混匀后,1 200 r/min离心3 min,弃上清,每管留50 μL液体,再加入200 μg/mL PI 5 μL,混匀后避光放置15 min。再于每管加入500 μL PBS,待流式细胞仪检测。
1.2.5 DNA ladder检测按照Sigma Genelute Mammalian Genomic DNA Miniprep Kit说明书操作。经1.5%琼脂糖凝胶电泳观察结果。
1.2.6 统计学分析应用SPSS11.5统计学分析软件,用t检验进行显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 SN38对WR/Fas-SM(-)和WR/Fas-SMS1凋亡的影响
WR/Fas-SM(-)和WR/Fas-SMS1经过不同浓度SN38刺激12 h后,与对照组相比不同浓度SN38均诱导了2种细胞的凋亡现象发生,但在各浓度组,2种细胞之间的凋亡率并无显著性差异,见图1。
2.2 CH11对WR/Fas-SM(-)和WR/Fas-SMS1凋亡的影响
WR/Fas-SM(-)和WR/Fas-SMS1经过不同浓度CH11刺激3 h后,50 ng/mL CH11可诱导WR/Fas-SM(-)细胞有意义的凋亡现象,但凋亡率较低;而在25 ng/mL和50 ng/mL 2个浓度组均诱导了WR/Fas-SMS1细胞有统计学意义的凋亡现象,并且在2个浓度组,2细胞之间的凋亡率存在显著性差异,见图2。
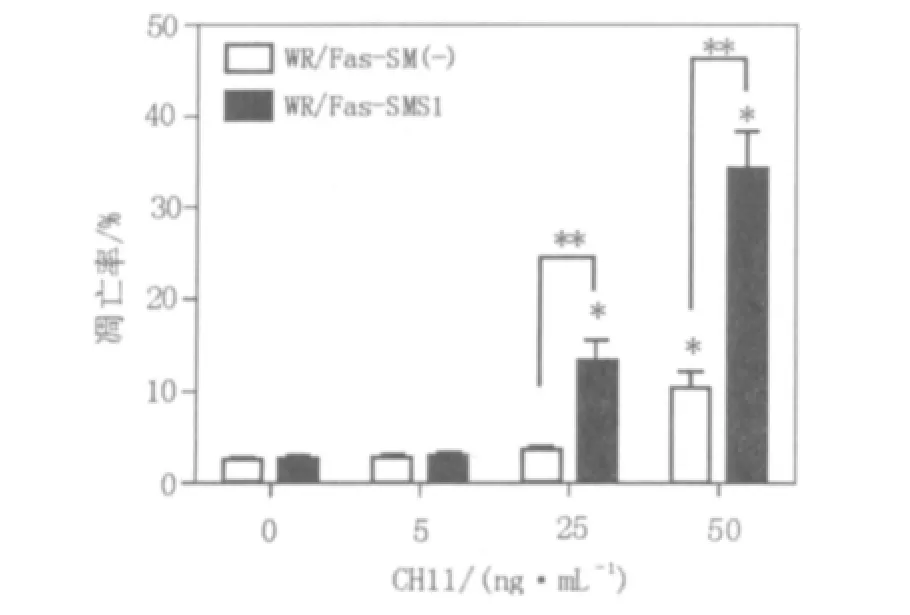
图2 CH11作用WR/Fas-SM(-)和WR/Fas-SMS1后凋亡率的比较Fig.2 Comparision of apoptosis between WR/Fas-SM(-)and WR/Fas-SMS1 cultured with CH11
2.3 SN38和CH11共同作用对WR/Fas-SM(-)和WR/Fas-SMS1凋亡的影响
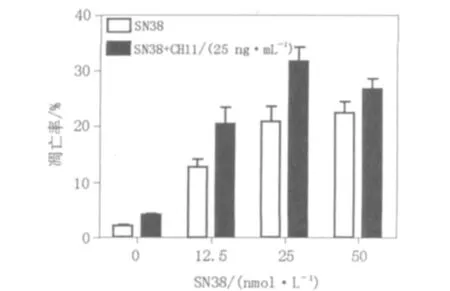
图3 SN38单独及与CH11联合应用对WR/Fas-SM(-)细胞凋亡率的影响比较Fig.3 Comparision of apoptosis of WR/FAS-SM(-)cultured with CH11 and/or SN38
SN38和CH11联合应用与SN38单独应用各浓度组相比,WR/Fas-SM(-)细胞凋亡率未见显著性差异(见图3);但对WR/Fas-SMS1细胞,在SN38 50 nmol/L浓度组出现凋亡率的差异(见图4),并且在该浓度组,2种细胞之间的凋亡率出现了显著性差异(见图5)。
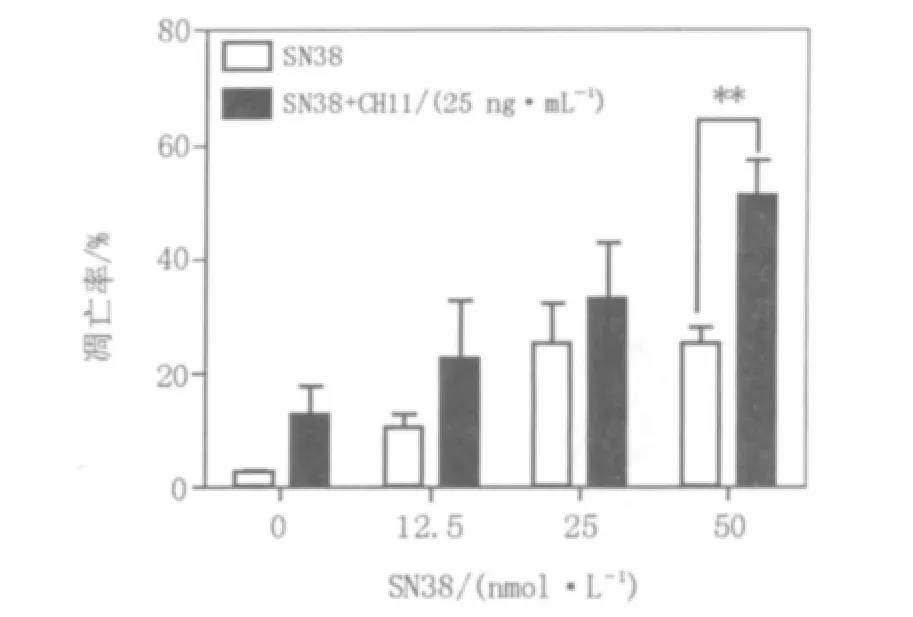
图4 SN38单独及与CH11联合应用对WR/Fas-SMS1细胞凋亡率的影响比较Fig.4 Comparision of apoptosis of WR/Fas-SMS1 cultured with CH11 and/or SN38
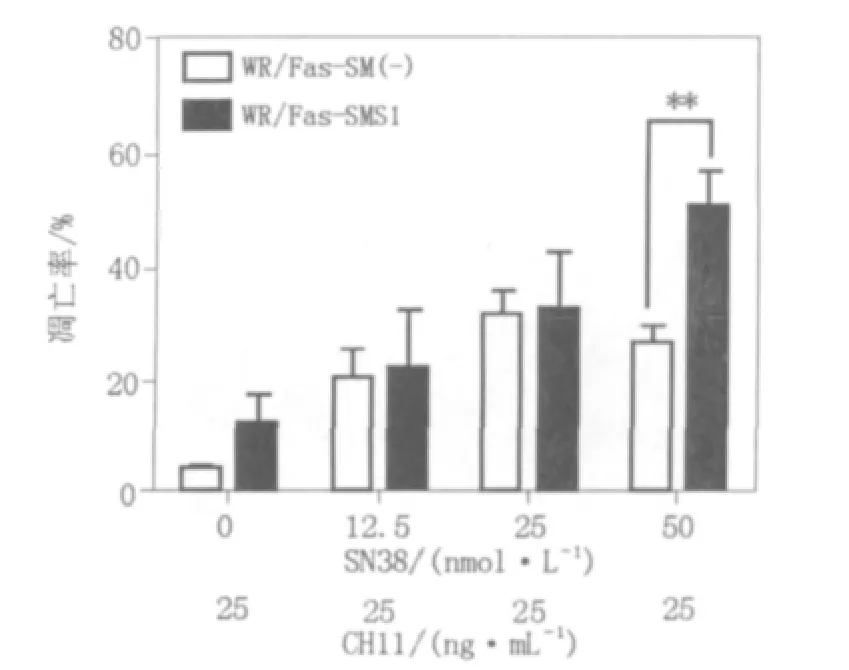
图5 SN38和CH11共同作用对WR/Fas-SM(-)和WR/Fas-SMS1凋亡率的影响比较Fig.5 Comparision of apoptosis between WR/Fas-SM(-)and WR/Fas-SMS1 cultured with CH11 and SN38
2.4 SN38和CH11共同作用后WR/Fas-SM(-)和WR/Fas-SMS1的形态学改变
WR/Fas-SM(-)和WR/Fas-SMS1经过SN38和CH11刺激12 h后均出现比较明显的凋亡现象,并且WR/Fas-SMS1细胞的凋亡细胞数量明显多于WR/Fas-SM(-)细胞,见图6(图中箭头所指为凋亡细胞)。
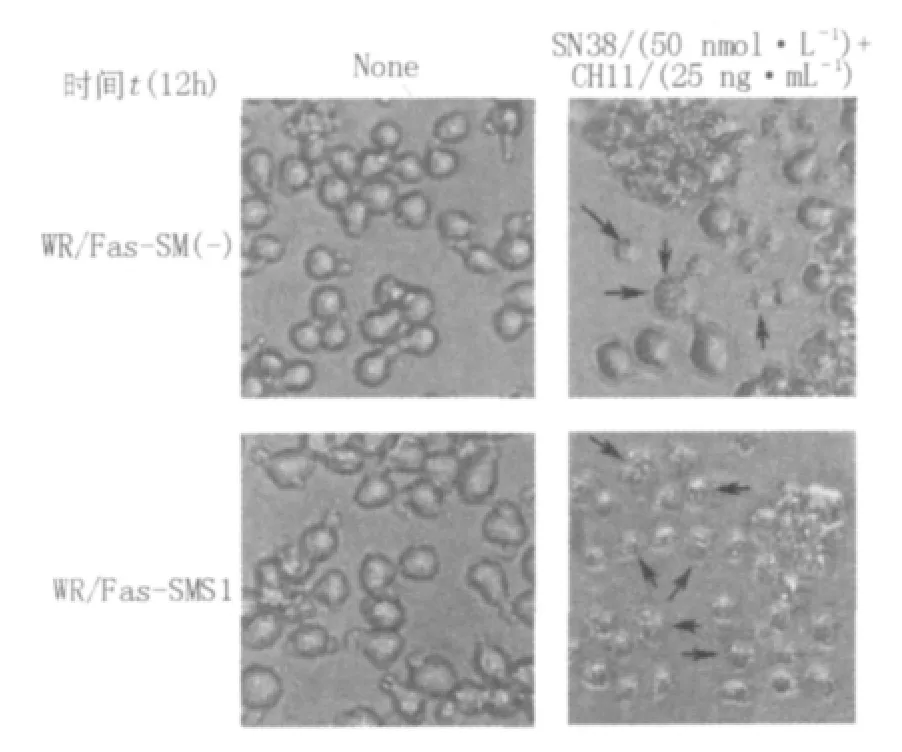
图6 SN38和CH11共同作用对WR/Fas-SM(-)和WR/Fas-SMS1的形态学改变(400×)Fig.6 Morphological changes of WR/Fas-SM(-)and WR/Fas-SMS1 after SN38 and CH11 stimulation(400×)
2.5 SN38和CH11共同作用对WR/Fas-SM(-)和WR/Fas-SMS1 DNA降解的影响
WR/Fas-SM(-)和WR/Fas-SMS1经过SN38和CH11刺激12 h后,DNA提取结果经1.5%琼脂糖凝胶电泳的结果表明2种细胞都出现了DNA的断裂片段呈梯状(DNA ladder)排列,并且WR/Fas-SMS1细胞DNA的断裂程度明显强于WR/Fas-SM(-)细胞,见图7。
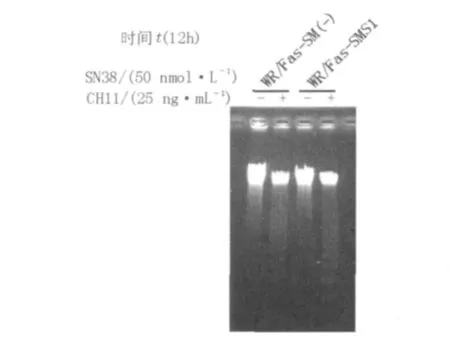
图7 SN38和CH11共同作用对WR/Fas-SM(-)和WR/Fas-SMS1 DNA降解的影响Fig.7 Degradation of chromosomal DNA in WR/Fas-SM(-)and WR/Fas-SMS1 after SN38 and CH11 stimulation
3 讨论
本实验结果显示,联合应用SN38和CH11与单独应用SN38或CH11相比,能够诱导WR/Fas-SMS1细胞更强的凋亡。该结果表明化疗药SN38与CH11联合使用在诱导细胞凋亡作用中具有叠加效应。
脂筏是细胞膜上富含胆固醇和鞘磷脂的微结构域,参与细胞膜的转运、信号传导过程[6]。信号分子(如受体)将在脂筏中与它们的配体相遇,启动信号传递途径[7-8]。目前已经发现,脂筏参与了免疫突触的形成[9],巨噬细胞的内吞作用[10],老年痴呆病中淀粉样蛋白的产生[11]等一系列生理和病理过程。鞘磷脂是脂筏的重要组成成分。目前,人们已经成功克隆了2种编码SMS的基因,分别为SMS1和SMS2。本实验中所应用的WR/Fas-SM(-)和WR/Fas-SMS1细胞分别是SMS1缺陷和表达的2株细胞,进而形成了细胞膜脂筏阴性和阳性的2种细胞。最近的一些实验表明,脂筏参与了Fas介导的凋亡过程,尤其是在多发性骨髓瘤[12]和淋巴瘤[13]的发病过程中。
单独应用不同浓度SN38作用于WR/Fas-SM(-)细胞和WR/Fas-SMS1细胞后,各浓度组的凋亡率在2种细胞间均未见显著性差异,且在50 nmol/L浓度的SN38刺激时,相比25 nmol/L浓度并不能诱导出更高的凋亡率;而在SN38与25 ng/mL的CH11共同作用于2种细胞后,观察到在SN38为50 nmol/L时明显诱导了WR/Fas-SMS1细胞更高的凋亡率,而对WR/Fas-SM(-)细胞相同的处理后,并没有该现象的发生。随后的形态学观察和DNA Ladder的实验结果也更加证实了这个结论。由于WR/Fas-SMS1细胞含有人为转入的SMS1基因,因此该细胞膜表面表达SM,而对于WR/Fas-SM(-)细胞,由于SM缺陷,导致细胞膜脂筏功能的缺陷或低下。又由于脂筏参与Fas介导凋亡过程,即参与了Fas与配体结合后,信号向内部的传递[14],甚至有些实验表明,在细胞膜存在脂筏的情况下,Fas可以在没有Fas配体与其结合的情况下介导细胞凋亡[15]。基于以上结果,可推测脂筏在SN38和CH11共同作用后,2种细胞凋亡率的显著差异中起到了决定性的作用。
综上,SN38和CH11的共同应用能促进WR/Fas-SMS1细胞的凋亡,显示了SN38和CH11在诱导凋亡方面的协同作用。同时,SN38和CH11的共同应用对WR/Fas-SM(-)细胞凋亡的促进不明显,推测脂筏在SN38促进WR/Fas-SMS1细胞Fas介导凋亡作用中起到一定作用。
[1] Siegel R M,Frederiksen J K,Zacharias D A,et al.Fas preassociation required for apoptosis signaling and dominant inhibition by pathogenic mutations[J].Science,2000,288(5475):2354-2357.
[2] Rothenberg M L.Irinotecan(CPT-11):recent developments and future directions--colorectal cancer and beyond[J].Oncologist,2001,6(1):66-80.
[3] Lansiaux A,Bras-Goncalves R A,Rosty C,et al.Topoisomerase I-DNA covalent complexes in human colorectal cancer xenografts with different p53 and microsatellite instability status:relation with their sensitivity to CTP-11[J].Anticancer Res,2001,21(1A):471-476.
[4] Miyaji M,Jin Z X,Yamaoka S,et al.Role of membrane sphingomyelin and ceramide in platform formation for Fas-mediated apoptosis[J].J Exp Med,2005,202(2):249-259.
[5] Yamaoka S,Miyaji M,Kitano T,et al.Expression cloning of a human cDNA restoring sphingomyelin synthesis and cell growth in sphingomyelin synthase-defective lymphoid cells[J].J Biol Chem,2004,279(18):18688-18693.
[6] Allen J A,Halverson-Tamboli R A and Rasenick M M.Lipid raft microdomains and neurotransmitter signalling[J].Nat Rev Neurosci,2007,8(2):128-140.
[7] Simons K,Vaz W L.Model systems,lipid rafts,and cell membranes[J].Annu Rev Biophys Biomol Struct,2004,33:269-295.
[8] Yoon I S,Chen E,Busse T,et al.Low-density lipoprotein receptor-related protein promotes amyloid precursor protein trafficking to lipid rafts in the endocytic pathway[J].FASEB J,2007,21(11):2742-2752.
[9] Jin Z X,Huang C R,Dong L,et al.Impaired TCR signaling through dysfunction of lipid rafts in sphingomyelin synthase 1(SMS1)-knockdown T cells[J].Int Immunol,2008,20(11):1427-1437.
[10] Auriac A,Willemetz A and Canonne-Hergaux F.Lipid raft-dependent endocytosis:a new route for hepcidin-mediated regulation of ferroportin in macrophages[J].Haematologica,2010,95(8):1269-1277.
[11] Vetrivel K S,Thinakaran G.Membrane rafts in Alzheimer's disease beta-amyloid production[J].Biochim Biophys Acta,2010,1801(8):860-867.
[12] Mollinedo F,de la Iglesia-Vicente J,Gajate C,et al.Lipid raft-targeted therapy in multiple myeloma[J].Oncogene,2010,29(26):3748-3757.
[13] van Blitterswijk W J,Klarenbeek J B,van der Luit A H,et al.Fas/CD95 down-regulation in lymphoma cells through acquired alkyllysophospholipid resistance:partialroleofassociated sphingomyelin deficiency[J].Biochem J,2010,425(1):225-234.
[14] Hueber A O,Bernard A M,Herincs Z,et al.An essential role for membrane rafts in the initiation of Fas/CD95-triggered cell death in mouse thymocytes[J].EMBO Rep,2002,3(2):190-196.
[15] Mollinedo F,Gajate C.Fas/CD95 death receptor and lipid rafts:new targets for apoptosis-directed cancer therapy[J].Drug Resist Updat,2006,9(1~2):51-73.

