酵母发酵过程中海藻糖的定性与定量测定
安 宁, 葛向阳, 张伟国
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
酵母发酵过程中海藻糖的定性与定量测定
安 宁, 葛向阳, 张伟国*
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
应用纸层析对酵母提取液中海藻糖进行了定性分析,并应用蒽酮硫酸比色-DNS比色法对酵母提取液中海藻糖进行了定量测定,确定了海藻糖定性定量的条件。研究结果经与 HPLC分析结果验证,表明该法对测定海藻糖含量具有较高的准确度和精密度,而且该法操作简单,易于掌握,比较适合在海藻糖产生菌筛选中应用。
海藻糖;DNS比色;蒽酮硫酸比色;纸层析;HPLC
海藻糖(Trehalose)是由两个葡萄糖分子通过半缩醛羟基结合而成的非还原性双糖[1],广泛存在于细菌、藻类、酵母、低等植物、昆虫和其他无脊椎动物中,尤其在霉菌、蘑菇等真菌中含量高达干重的20%[2]。海藻糖的性质非常稳定,具有耐干燥、耐冷冻、保湿、低热值[3]等不同于其它碳水化合物的独特的生物学性质,使得海藻糖在食品、医药工业、化妆品和农业等领域[4]有着广阔的应用前景。
但是,由于海藻糖是一种非还原性二糖,在分子结构上与蔗糖比较接近,一般采用 HPLC对其进行精确定量分析。但是,使用 HPLC分析,不但操作成本高,而且样品制备比较繁琐,不适用于海藻糖生产菌的筛选。作者将采用纸层析法应用于海藻糖生产菌的筛选工作中,经过 HPLC分析验证,该法不但操作简单,而且重现性和准确性都达到了较为理想的水平。
1 材料与方法
1.1 材料与仪器
1.1.1 供试菌株 酿酒酵母(Saccharom yces cere-visiae)3株,江南大学生物工程学院代谢调控与代谢工程研究室保藏菌种。
1.1.2 培养基 种子培养基(组分 g/L):葡萄糖10,酵母膏 5,蛋白胨 10,KH2PO43;发酵培养基(组分 g/L):葡萄糖 30,玉米浆 11,酵母膏 1,KH2PO40.9,NaH2PO41.5,M gSO4·7H2O 0.15。培养基调p H 5.0~5.5。种子培养基在0.07 M Pa下灭菌15 m in,发酵培养基在0.1 M Pa下灭菌20 min。
1.1.3 主要仪器与设备 721分光光度计,上海第三分析仪器厂产品;立式圆形压力蒸汽灭菌器,上海医用核子仪器有限公司产品;往复式摇床,无锡查桥轻机厂产品;超净工作台,苏净集团安泰公司产品;PHS-3C型精密p H计,上海雷磁仪器厂产品;电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品。电热恒温水浴锅,上海医疗器械五厂产品;Agilent1100,美国安捷伦公司产品。
1.2 实验方法
1.2.1 酵母提取液的制备 将培养离心后的适量酵母泥置于烧杯中均匀铺成薄层,放入90℃烘箱中处理60 min。然后以固液质量体积比1 g∶10 mL加预冷的去离子水,摇匀后42℃水浴20 min,取出后6 000 r/min离心10 min即得酵母海藻糖提取液[5]。
1.2.2 DNS测还原糖[6]
1)称取酒石钾钠182.0 g,溶于500 mL蒸馏水中,加热(不超过50℃),于热溶液中依次加入3,5-二硝基水杨酸6.3 g,NaOH 21.0 g,苯酚5.0 g,无水亚硫酸钠5.0 g,搅拌至溶解完全,冷却后用蒸馏水定容至1 000 mL,贮存于棕色瓶中,室温保存。
2)1 mg/m L葡萄糖标准液:准确称取105℃烘至恒重的葡萄糖1 g,加少量水溶解后再加8 m L浓盐酸,以蒸馏水定容至1 000 m L。
3)标准曲线的制作:以标准葡萄糖溶液为基准液,取数支试管进行2~10倍系列稀释。分别去稀释液0.5 mL,加入DNS试剂0.5 mL,混合均与后沸水浴5 min,取出立即冷却并加入8 mL蒸馏水,于540 nm处测定各管吸光值。以A540nm对葡萄糖质量浓度绘制标准曲线,结果见图1。
4)还原糖的测定:将酵母提取液直接以DNS法测定光密度值,根据葡萄糖标准曲线,计算出还原糖的量[7]。
1.2.3 蒽酮-硫酸法测总糖[8]
1)蒽酮-硫酸溶液的配制:称取蒽酮0.2 g,加浓硫酸100 mL,混匀即可(现配现用)。
2)标准葡萄糖溶液的配制:精密称取干燥至恒重的无水葡萄糖配制成浓度为1.00 mg/m L的溶液 ,备用。
3)标准曲线的制备:以上述标准液为基准配制0,0.01,0.02,0.03,0.04,0.05,0.06 mg/mL的葡萄糖溶液各2.00 m L,摇匀,各管分别加质量分数0.2%的蒽酮-硫酸试剂8 m L与沸水浴中加热10 min(从水浴重新沸腾算起),取出,用自来水冷却,在630 nm处以首管作空白,测定吸光度。以A630nm对葡萄糖质量浓度绘制标准曲线,结果见图2。
4)总糖的测定:将酵母提取液稀释100倍,按上述操作测A630nm,根据标准曲线,计算出酵母提取液中总糖的含量。
1.2.4 蒽酮-硫酸法测海藻糖标准曲线
1)标准海藻糖溶液的配制:精密称取干燥至恒重的无水海藻糖配制成浓度为1.00 mg/mL的溶液 ,备用。
2)标准曲线的制备:具体同上述操作。以A630nm对海藻糖质量浓度绘制标准曲线,结果见图3。
1.2.5 纸层析法[9]
1)试剂配制
展开剂:V(正丁醇)∶V(丙酮)∶V(水) ∶V(醋酸)=10∶6∶6∶2。
显色剂:A液:AgNO3的水-丙酮饱和溶液,V(水)∶V(丙酮)=1∶200
B液:将1 g NaOH晶体溶于100 g乙醇水溶液中 ,m(乙醇)∶m(水)=1∶1。
2)层析操作:取长33 cm,宽15 cm的层析滤纸条上,于起始线(起始线距滤纸末端5 cm)上分别用海藻糖标准品和提取液相距1 cm点样,斑点直径不得超过5 mm,越小越好。点样量为葡萄糖2μg、蔗糖10μg、海藻糖4μg、提取液40μL。吹干后,至于展开剂饱和的层析缸中,上行展开层析数小时,待展开剂距起始线32 cm的前沿线上时,取出。自然风干,先在滤纸条上均匀喷上A液,50℃烘干,再均与喷上B液,再烘干,数分钟后,棕黄色的滤纸上便显出样品的斑点。
1.2.6 HPLC色谱分析条件 色谱柱:NH2键合相柱,5 m L,250 mm×4.6 mm;流动相:V(乙腈)∶V(水)=70 ∶30;流量:1 m L/min;柱温:25 ℃;检测器:视差折光检测器[9]。
2 结果与讨论
2.1 DNS测得还原糖的标准曲线
DNS测得还原糖的标准曲线见图1。
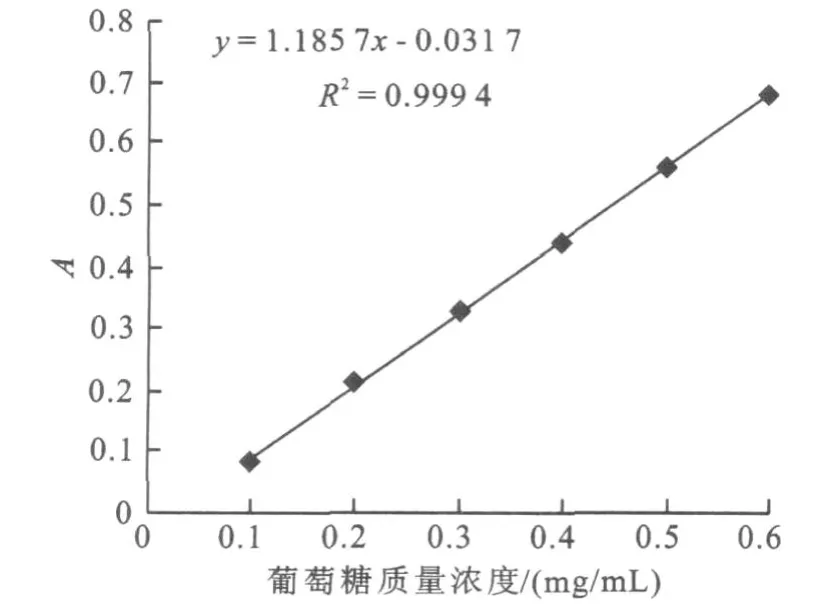
图1 DNS测定葡萄糖质量浓度标准曲线Fig.1 The standard curve of glucose measurement by DNS
2.2 蒽酮测得葡萄糖标准曲线
蒽酮测得葡萄糖标准曲线见图2。

图2 蒽酮测定葡萄糖质量浓度标准曲线Fig.2 The standard curve of glucose measurement by anthrone-sulfuric method
2.3 蒽酮硫酸法测得海藻糖标准曲线
蒽酮硫酸法测得海藻糖标准曲线见图3。

图3 蒽酮测定海藻糖质量浓度标准曲线Fig.3 The standard curve of trehalose measurement by anthrone-sulfuric method
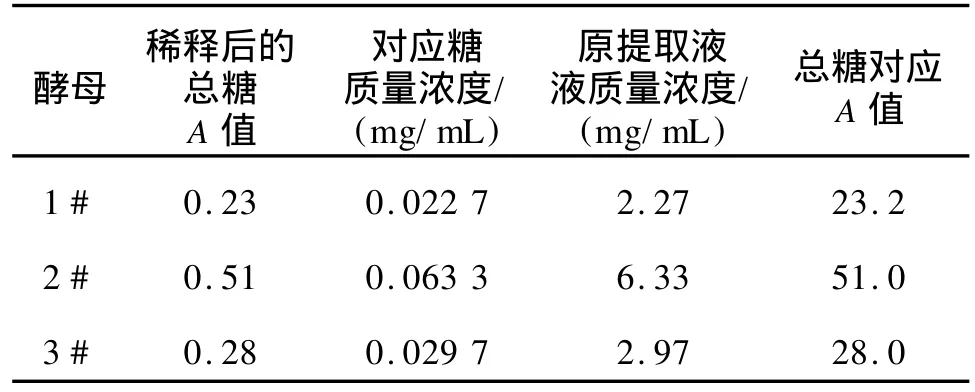
表1 蒽酮硫酸法测得酵母提取液中总糖的质量浓度及对应的吸光值Tab.1 Total carbohydrates content and relevant OD level by anthrone-sulfuric method
表2显示2#酵母提取液非还原糖含量最高,3#酵母提取液含量其次,1#最低。
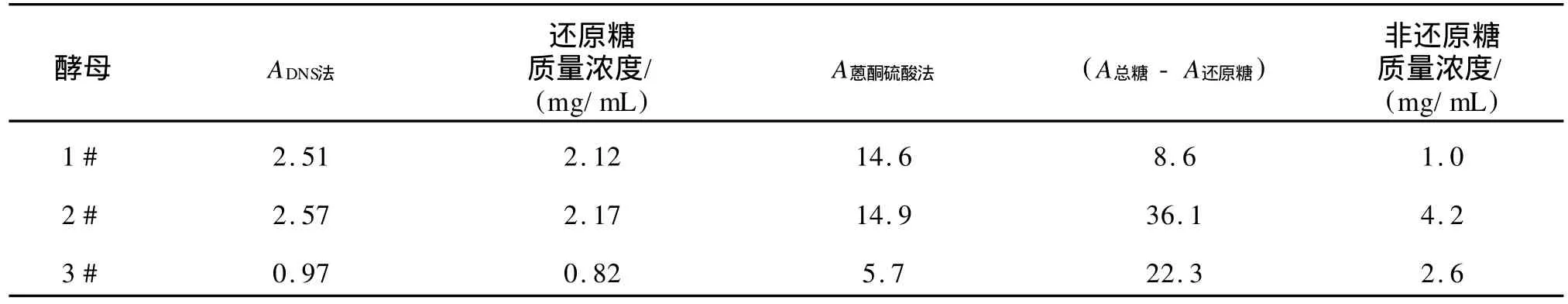
表2 DNS法测得还原糖的质量浓度及A值差值对应非还原糖的质量浓度Tab.2 Reducing sugar level and nonreducing sugar level by DNS
2.4 纸层析图
实验结果显示,酵母提取液中都有与海藻糖标准品值相同的斑点,这表明酵母提取液中有海藻糖成分。斑点的大小与所点样品的量有关,通过纸层析观察3株酵母海藻糖合成能力的大小。图4结果显示:2#酵母的斑点最大,3#酵母的斑点其次,1#酵母的斑点最小,对应外加30μg的海藻糖标准液层析得到的图谱2#最大,3#次之,1#最小,所得结果与用吸光度计算得的结果完全一致。
2.5 HPLC视差折光检测器检测法分离测定海藻糖、葡萄糖、蔗糖的色谱结果
为了准确测定细胞内海藻糖的含量,作者采用HPLC对其进行了定量分析比对上述测量结果。
3株酵母中2#酵母产海藻糖能力最强,3#酵母其次,1#酵母最弱。由图5~图9的HPLC图和表3可看出,1#酵母提取液中葡萄糖的含量最高,海藻糖含量相对低,由此可知,1#酵母海藻糖的转化能力也较弱。3#酵母提取液中虽然海藻糖占总糖的比率较高,但是蔗糖等杂峰较多,相比而言2#酵母最为理想,杂峰少,海藻糖产量高,转化率也较高。
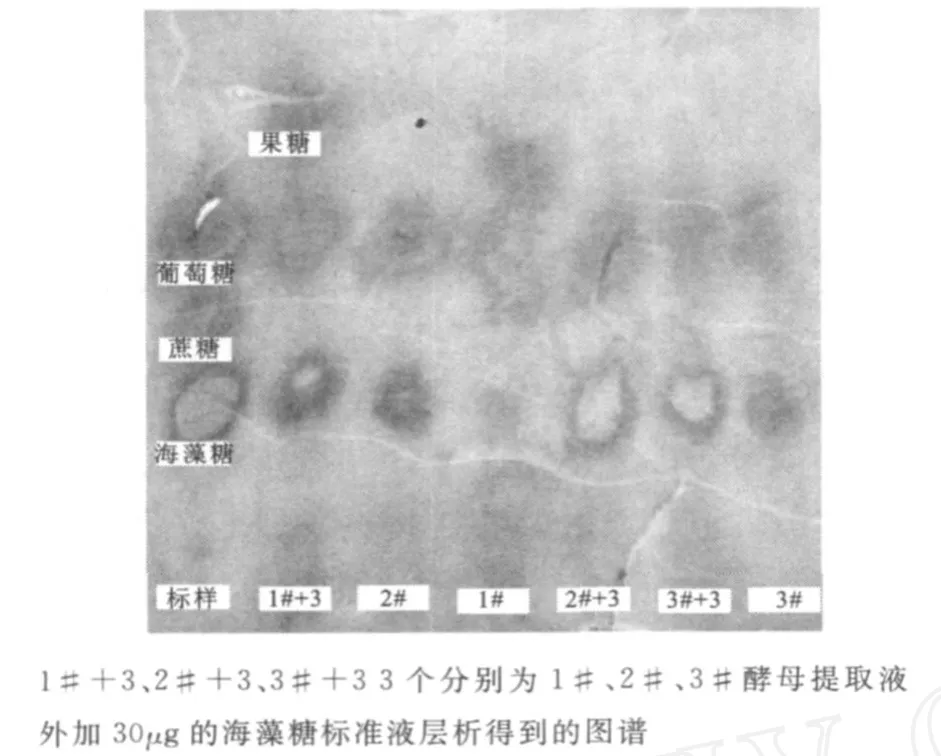
图4 标准样品与酵母提取物的纸层析对照图谱Fig.4 Comparison of paper chromatography between standard sample and yeast extract
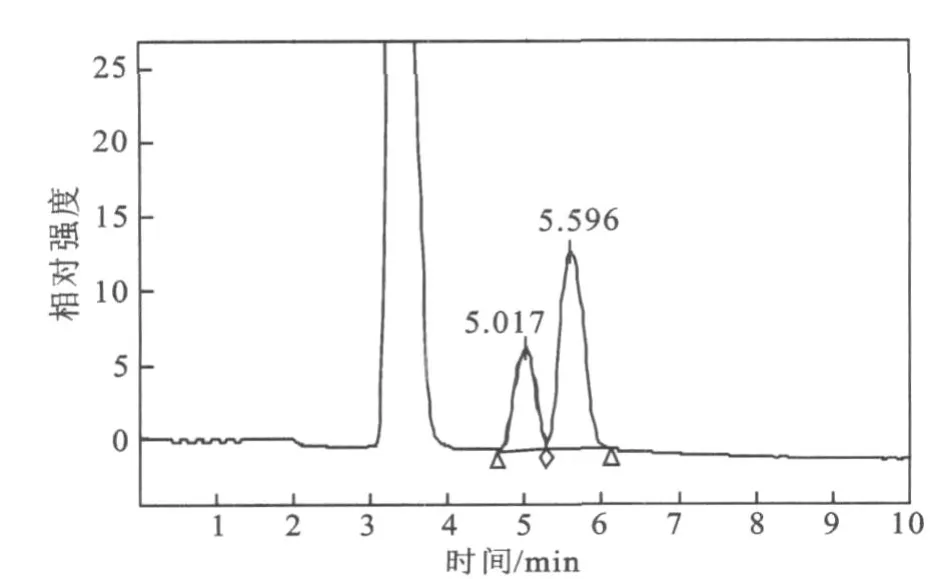
图5 葡萄糖和蔗糖标准品 HPLC图Fig.5 Chromatogram of standard sample of glucose and sucrose
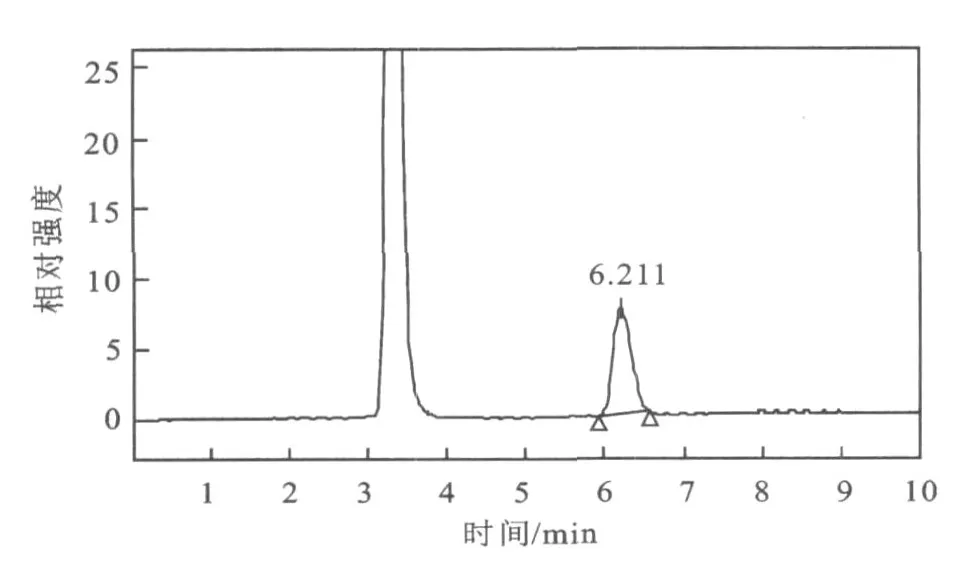
图6 海藻糖标准品 HPLC图Fig.6 Chromatogram of standard sample of trehalose
此外,就葡萄糖、蔗糖和海藻糖3种糖而言,2#和1#酵母中总糖含量较高,约为7.3 m g/m L和7.2 mg/mL,而3#酵母提取液中总糖为4.2 mg/m L,可以粗略地说明1#和2#酵母的耐糖能力较强。

图7 1#酵母提取液液 HPLC图Fig.7 Chromatogram of sample prepared by the first yeast
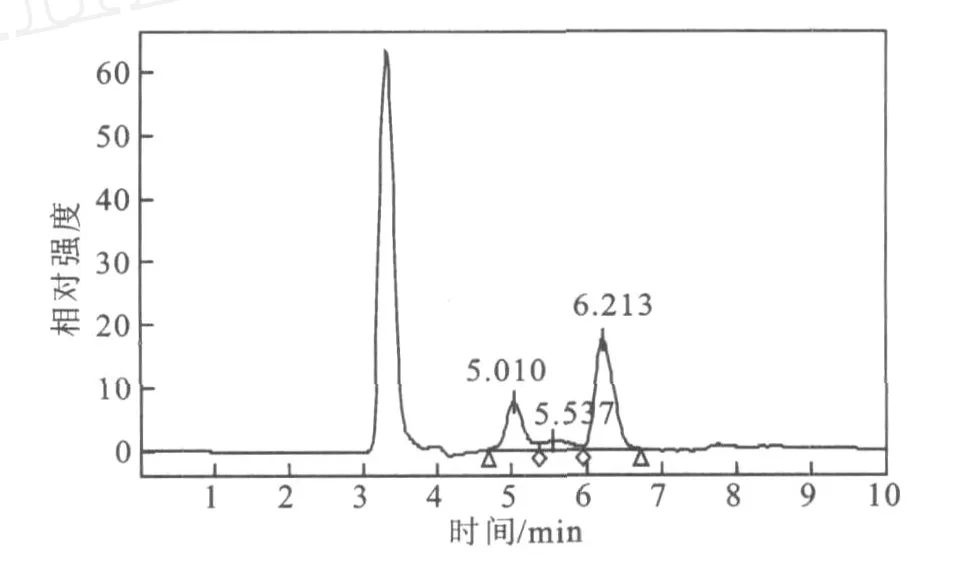
图8 2#酵母提取液 HPLC图Fig.8 Chromatogram of sample prepared by the second yeast
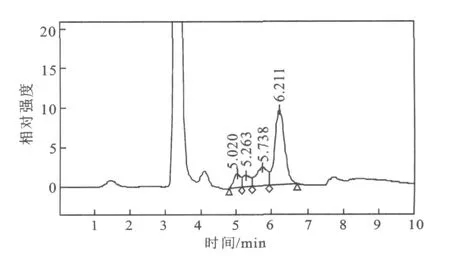
图9 3#酵母提取液 HPLC图Fig.9 Chromatogram of sample prepared by the third yeast
对比表2和表3发现,用DNS和蒽酮硫酸法测得的非还原糖的含量和 HPLC中海藻糖的含量相差不大,由 HPLC结果知3株酵母的酵母提取液中蔗糖与海藻糖的比为55.2%,13.5%,31.5%,其中2#酵母蔗糖含量最小,而海藻糖产量最高,因此,可选2#酵母进行下一步研究以提高产量。由图中各标准曲线得知,各波长处的吸光度与糖含量的正相关线性程度很高;糖成分清晰的2#酵母提取液用两种方法测得的含量分别为4.2 mg/m L和4.8 mg/m L,排除来自两种测量方法中由处理方法不同而带来的误差。所以,相对于 HPLC方法,该法对初步测量酵母海藻糖的含量有较高的准确度和精密度。由于海藻糖是应激性糖在非还原糖中的含量是主要的,所以在酵母培养条件优化等胁迫因素的刺激下含量会更高,蔗糖与海藻糖的含量比值减小,那么DNS和蒽酮硫酸法测得的数值则更趋近于HPLC所测得的数值。

表3 3株酵母提取液中主要糖类的质量浓度Tab.3 Concentration of the main carbohydrates in yeast extract
3 结 语
海藻糖作为一种应激代谢物,在营养缺乏,环境胁迫,生长受限的情况下才大量积累,其干重甚至占酵母干重的16%[10]。采用DNS和蒽酮硫酸法测得非还原糖的含量与 HPLC结果相似,可以简便的测量海藻糖粗含量。另外通过观察海藻糖纸层析图中斑点的大小与亮度也可以粗略的判断海藻糖的含量大小,这样就大大降低了海藻糖生产菌初筛中的工作量和研究成本,该法比较适宜于大量潜力菌的筛选工作中。
(References):
[1]胥传来,姚惠源.海藻糖对脂质膜保护作用的荧光分析[J].食品与生物技术学报,2005,24(4):22-25.
XU Chuan-lai,YAO Hui-yuan.Fluorescence analysis of the liposomes membrane under the protection of trehalose[J].Journal of Food Science and Biotechnology,2005,24(4):22-25.(in Chinese)
[2]胡玥.海藻糖的特性及其应用研究进展[J].齐鲁药事,2009(28):350-352.
HU Yue.Characteristics of trehalose and its progress in research and application[J].Qilu Pharmaceutical Affairs,2009(28):350-352.(in Chinese)
[3]罗明典.微生物生产海藻糖及其应用前景[J].微生物学通报,1996,23(4):252-254.
LUO min-dian.The production of trehalose by microorganism and its prospect in application[J].Microbiology,1996,23(4):252-254.(in Chinese)
[4]尚宏丽,陈红漫.一株产海藻糖合成酶嗜中温芽孢杆菌的鉴定及其酶学性质[J].食品与生物技术学报,2006,25(6):34-41.
SHANG Hong-li,CHEN Hong-man.Studies on screening of trehalose synthase-producing strain and its enzymology properties[J].Journal of Food Science and Biotechnology,2006,25(6):34-41.(in Chinese)
[5]郑辉杰,张洪起,刘伟,等.从啤酒废酵母中提取海藻糖的工艺研究[J].酿酒科技,2008(5):101-104.
ZHEN Hui-ji,ZHANG Hong-qi,LIU Wei.Extration of trehalose from waste beer yeast[J].Liquor-Making Science﹠Technology,2008,(5):101-104.(in Chinese)
[6]关凤梅.生物化学实验[M].济南:山东轻工业学院,2003.
[7]马少敏.酶法生产海藻糖的定量分析方法[J].大众科技,2008,10:111-112.
MA Shao-min.Methods of trehalose quantity determination by enzymes[J].Da Zhong Ke Ji,2008,10:111-112.(in Chinese)
[8]谭海刚.蒽酮-硫酸法测定酵母中海藻糖的含量[J].现代食品科技,2006(22):125-128.
TAN Hai-gang.Determination of trehalose content by anthrone-sulphuric acid[J].Modern Food Science and Technology,2006(22):125-128.(in Chinese)
[9]刘传斌,云战友.海藻糖的分析方法[J].食品与发酵工业,1998,24(5):40-42.
L IU Chuan-bin,YUN Zhan-you.Methods of trehalose determination[J].Food and Fermentation Industries,1998,24(5):40-42.(in Chinese)
[10]刘传斌,云战友.海藻糖在生物制品活性保护中的应用前景[J].中国医药工业杂志,1998,29(7):327-331.
LIU Chuan-bin,YUN Zhan-you.Prospects of application of trehalose in bioproducts preservation[J].Chinese Journal of Pharmaceuticals,1998,29(7):327-331.(in Chinese)
Qualitative and Quantitative Determination of Trehalose in Yeast Extract
AN Ning, GE Xiang-yang, ZHANG Wei-guo*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
A method to determine trehalose in yeast extract using paper chromatography was investigated in this manuscript.Meanwhile,a process to determine the concentration of trehalose by Anthrone-sulphuric acid colorimetric method was developed.Compared to the results from HPLC,the paper chromatography method was identified as highly accurate and precise in the determination of trehalose.Therefore,the paper chromatography methods was proven to be easy operate and suitable for the screening of strains producing trehalose.
trehalose,DNS,anthrone-sulfuric method,paper chromatography,HPLC
TQ 92
A
1673-1689(2011)04-0636-05
2010-11-02
*
张伟国(1963-),男,江苏张家港人,工学博士,教授,博士研究生导师,主要从事氨基酸生产菌种选育及发酵工艺研究。Email:zhangw g@126.com

