高压氧对正常及SIRS大鼠脾T淋巴细胞的影响
王佐周,赵宝宝,王钢*
(1.中国医科大学基础医学院病理教研室,辽宁沈阳110001;2.中国医科大学附属第一医院急诊科,辽宁沈阳110001)
高压氧作为一种治疗手段,广泛应用于临床。研究显示高压氧促进伤口部位的纤维母细胞、上皮细胞和血管的增生,促进伤口愈合,增强细胞的杀菌能力,对特殊厌氧菌具有致命的杀伤力[1]。另外,高压氧还表现出广泛的细胞分子学反应,包括细胞内信号转导和基因功能调节,高压氧的生化作用包括调节粘附分子,抗氧化酶,生长因子和细胞因子的表达,调节一氧化氮的释放,微循环的灌注和细胞能量的干预等[2]。然而,高压氧在免疫调节和抗炎作用方面的研究以及在全身炎症反应综合征中的应用尚不多见。高压氧暴露之后机体抗氧化能力增强,这种抗氧化反应强度同氧化应激程度相关。在全身炎症反应综合征(Systemic inflammatory response syndrome,SIRS)状态下,高压氧的免疫调节作用,包括对T细胞的影响以及抗炎作用的研究尚不多见。SIRS从一个新的角度阐明多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的重要病理生理及发生发展过程。经过10余年的大量实验研究和临床资料揭示,创伤、感染、休克发展到MODS存在着一条共同通路,即SIRS[3]。本实验以SIRS为基础,以免疫功能和炎症反应中具有代表性的脾T淋巴细胞为研究对象,研究高压氧对正常机体以及SIRS时细胞免疫功能的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组健康雄性SD大鼠50只,购自中国医科大学实验动物中心,体重约140~180 g,随机分为5组,每组10只。A组:腹腔注射等量生理盐水;B组:腹腔注射等量生理盐水,做3次高压氧;C组:腹腔注射酵母多糖-石蜡悬液(500 mg/kg);D组:腹腔注射酵母多糖-石蜡悬液(500 mg/kg),做1次高压氧;E组:腹腔注射酵母多糖-石蜡悬液(500 mg/kg),做3次高压氧。
1.1.2 主要试剂和仪器酵母多糖-A(Sigma公司);抗大鼠FITC-CD3,PE-CD4,PE-CD8(biolegend公司);流式细胞仪;动物高压氧舱(DWC400A/0.2-1,华信,潍坊)。
1.2 方法
1.2.1 大鼠SIRS模型建立将酵母多糖粉剂和无菌液体石蜡混合,高频振荡15 min,100℃水浴80 min灭菌,制成浓度为100 mg/mL的酵母多糖A-石蜡混悬液,存放于4℃备用,临用前40℃水浴复温,高频振荡15 min后注药。大鼠实验前18 h开始禁食,不禁水。C、D、E组以500 mg/kg体重给大鼠腹腔注射酵母多糖-石蜡悬液,A、B组注射等量生理盐水。
1.2.2 高压氧治疗方案做1次高压氧的时间为腹腔注射后4 h,做3次高压氧的时间分别为腹腔注射后4、10、18 h。每次高压氧都遵循以下方案:100%纯氧洗舱5 min,以清除舱内原有空气。匀速加压至2ATA(约10~15 min),用已校对的测氧仪测舱内氧浓度达95%以上,期间以4 L/min的速度持续通O2避免CO2蓄积,并将压力维持在2ATA。1 h后以同样速度匀速减至常压,出舱。
1.2.3 标本采集及检测腹腔注射24 h后,每只鼠按实验设定顺序取脾,标号,脾脏剪至糊状,100目筛滤过(加PBS),离心1 000 r/min 10 min,弃上清,低渗休克法溶解红细胞,RPMI 1640调整细胞浓度1×106/mL。取上述液体0.1 mL,4℃离心10 min,弃上清,加入冷PBS 1 mL,轻轻震荡,1 000 r/min 4℃离心10 min,弃上清,重复2次。加200 μL Buffer,加10 μL AnnexinV-FITC,加PI 10 μL,25℃,15 min。加300 μL Buffer 30 min内上流式细胞仪测量。
1.2.4 统计学方法用SPSS 13.0软件分析数据。各组数值用均数±标准差表示,用F检验做方差齐性检验,当方差齐性相等时,2组间采用两独立样本t检验,方差齐性不等时采用近似t检验即t'检验。设P<0.05为有显著性差异。
2 结果
2.1 大鼠SIRS模型建立效果
一般情况:腹腔注射酵母多糖-石蜡溶液组大鼠呼吸急促,伴有明显喘鸣,皮肤黏膜发绀、出汗、毛色灰暗,部分大鼠有鼻出血、腹胀、腹泻。大鼠进食明显减少,活动差,对外界刺激无反抗。大体改变:杀鼠后,见SIRS组大鼠腹腔渗出增多,肠管扩张,程度不一;肝脏呈暗红色或暗紫色;肺脏可见不同程度肿胀,部分可见充血出血点;心脏、肾脏、脾脏、胰腺无明显大体改变。
2.2 酵母多糖对脾T细胞的影响
注射酵母多糖的大鼠CD4+和CD8+T细胞均较对照组明显减少(P<0.01),减少程度基本平行,所以CD3+CD4+/CD3+CD8+无变化(表1、图1)。
2.3 高压氧对正常大鼠脾T细胞的影响
B组CD4+T细胞比例同对照组(A组)相比明显减少(P<0.01),CD8+T细胞基本无变化,CD3+CD4+/CD3+CD8+比值明显下降(P<0.05)(表1、图1)。
2.4 高压氧对SIRS大鼠脾T细胞的影响
高压氧使酵母多糖导致的CD4+T细胞减少明显恢复(P<0.05)。同高压氧对正常大鼠T细胞的影响一样,高压氧几乎不影响CD8+T细胞,故CD3+CD4+/CD3+CD8+比值升高(P<0.05)(表1、图1)。
2.51 次高压氧和3次高压氧对脾T细胞的不同影响
表1 各组CD4+、CD8+T细胞比例以及二者比值(%±s,n=10)Table 1 The percentage of CD4+、CD8+T lymphocytes and the ratio of CD4+/CD8+(%,¯χ±s,n=10)
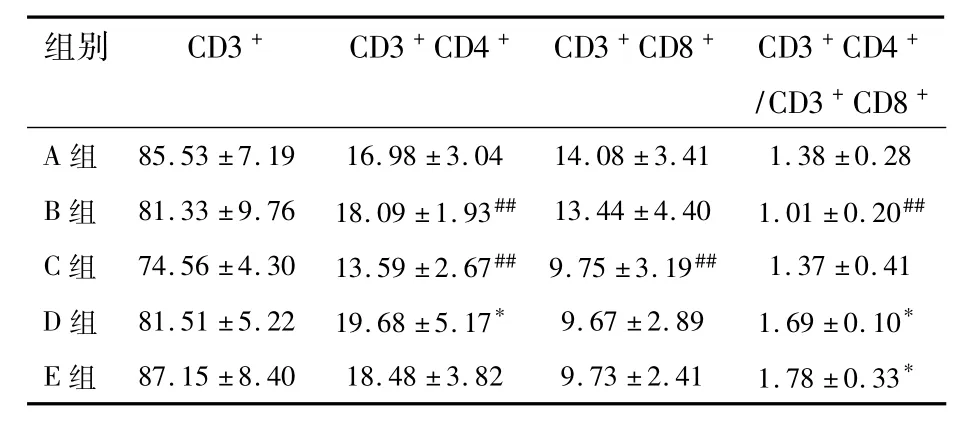
表1 各组CD4+、CD8+T细胞比例以及二者比值(%±s,n=10)Table 1 The percentage of CD4+、CD8+T lymphocytes and the ratio of CD4+/CD8+(%,¯χ±s,n=10)
注:#同A组比较P<0.05,##同A组比较P<0.01,*同C组比较P<0.05
组别CD3+CD3+CD4+CD3+CD8+CD3+CD4+/CD3+CD8+A组85.53±7.1916.98±3.0414.08±3.411.38±0.28 B组81.33±9.7618.09±1.93##13.44±4.401.01±0.20##C组74.56±4.3013.59±2.67##9.75±3.19##1.37±0.41 D组81.51±5.2219.68±5.17*9.67±2.891.69±0.10*E组87.15±8.4018.48±3.829.73±2.411.78±0.33*
D组和E组的CD4+和CD8+T细胞比例无统计学差异(表1、图1)。也就是说,3次高压氧治疗对于CD4+T细胞的恢复并不比1次高压氧治疗具有更好的效果。

图1 各组CD3+CD4+、CD3+CD8+比例以及CD3+CD4+/CD3+CD8+比值的变化Fig.1 The percentage of CD3+CD4+、CD3+CD8+T lymphocytes and the ratio of CD3+CD4+/CD3+CD8+
3 讨论
现有研究表明酵母多糖致大鼠SIRS严重程度具有剂量依赖性[4],本实验依据参考文献[5]选取500 mg/kg体重进行酵母多糖腹腔注射,所有大鼠均出现CD4+、CD8+T细胞的减少。Bone将典型的SIRS分成5个时期:第1期为局部炎症反应期;第2期为全身炎症反应始动期;第3期为全身炎症反应期,机体出现失去控制的、自我持续放大和自我破坏的炎症;第4期为CARS期(代偿性抗炎反应综合征,compensatory anti-inflammatory response syndrome),抗炎反应过度,导致免疫功能抑制及对感染的控制和抵抗能力下降;第5期为免疫不协调期,表现为多脏器功能失调,临床死亡率高[6]。实验结果所示CD4+、CD8+T细胞明显减少,提示机体此时已经处于免疫功能低下状态,这种免疫细胞的受累是否是促进SIRS向多脏器功能衰竭进展的原因之一,恢复免疫细胞数量和功能是否可以避免SIRS的进一步发生发展有待进一步实验证实。
本实验中,高压氧对正常大鼠和SIRS大鼠表现出的截然不同的作用。已有研究表明高压氧具有类似“双刃剑”的作用,一方面,在机体处于高炎症状态时,高压氧可以减少炎症介质的合成和释放,从而减轻机体的炎症反应。另一方面,高压氧对内源性免疫和适应性免疫产生广泛抑制。包括减少抗原合成,抑制B细胞的产生抗体;损伤Th1型细胞介导的促炎型免疫反应;高压氧可以非特异性刺激T细胞产生大量IL-10,以产生强大的免疫抑制作用[7-8]。造成高压氧这种“双刃剑”做用的原因可能包括:a)压力。2.5ATA时脓毒症大鼠病死率降低,3ATA时病死率明显增高,说明压力同免疫功能改变之间可能存在剂量-依赖关系,但这种剂量依赖关系只跟氧分压有关,而不仅仅是单纯的气压程度[9];b)暴露时间。可以假设机体在3次暴露于高压氧后呈现免疫抑制状态之前,经历了免疫功能由促进到抑制的过程,起先抗氧化反应增强以对抗氧化应激反应,但随着氧化应激程度加重和时间延长,抗氧化系统进一步亢进使机体呈现免疫抑制状态。所以即使常规治疗剂量的高压氧对正常的免疫细胞也可能是过量的。虽然压力和暴露时间可能参与了高压氧的这种“双刃剑”作用,但并不是这种复杂调节作用的唯一决定因素,本实验中,高压氧对正常大鼠及SIRS大鼠CD4+T细胞产生完全相反的调节作用,说明高压氧这种双向调节作用可以不依赖压力和暴露时间。
高压氧可通过诱导细胞凋亡抑制细胞介导的免疫反应,并且凋亡随暴露次数增多而增多[8,10]。本实验中,高压氧使正常大鼠CD4+T细胞明显减少,CD8+T细胞数则没有变化。可能高压氧只特异性影响CD4T细胞,通过诱导凋亡的方式减少CD4+T细胞数量从而减弱其辅助功能,导致免疫功能下降;或者高压氧对CD4+T细胞以减少其数量为主,对CD8T细胞则通过降低其细胞膜的流动性直接损伤其靶细胞杀伤能力[11]。
本实验通过对大鼠脾T淋巴细胞的研究,证实高压氧对于免疫功能具有双向调节作用,在正常机体可引起免疫功能抑制,而在SIRS状态下,可以促进机体受损的免疫功能恢复,并且这种作用可以不依赖压力和暴露时间。
[1] Noori A,Glenn B,Richard P,Zev C and Bill H.Hyperbaric oxygen and lymphoid system function:A review supporting possible intervention in tissue transplantation[J].Technol Health Care,2006,14(6):489-498.
[2] Oter S,Radermacher P,Matejovic M.Can(hyperbaric)oxygen turn off the motor of multiorgan dysfunction[J].Intensive Care Med,2006,32(11):1694-1696.
[3] 邱春兰.全身炎症反应综合征发病机制研究进展[J].西部医学,2009,21(4):662-666.
[4] 孙琦,汤仁仙,范兴丽,等.葛根素对炎症反应综合征大鼠的治疗作用[J].中华急诊医学杂志,2008,17(2):158-161.
[5] Imperatore F,Cuzzocrea S,Luongo C,et al.Hyperbaric oxygen therapy prevents vascular derangement during zymosan-induced multiple-organ-failure syndrome[J].Intensive Care Med,2004,30(6):1175-1181.
[6] 黄志英.感染性休克研究进展[J].中国卫生检验杂志,2009,19(3):709-711.
[7] Kudchodkar B,Jones H,Simecka J,et al.Hyperbaric oxygen treatment attenuates the pro-inflammatory and immune responses in apolipoprotein E knockout mice[J].Clin Immunol,2008,128(3):435-441.
[8] Ackland GL,Gutierrez Del Arroyo A,Yao ST,et al.Low-molecular-weight polyethylene glycol improves survival in experimental sepsis[J].Crit Care Med.2010,38(2):629-636.
[9] Jon A.Buras,Douglas Holt,Daniel Orlow,et al.Hyperbaric oxygen protects from sepsis mortality via an interleukin-10-dependent mechanism[J].Crit Care Med,2006,34(10):2624-2629.
[10] Fildissis G,Venetsanou K,Myrianthefs P,et al.Whole blood proinflammatory cytokines and adhesion molecules post-lipopolysaccharides exposure in hyperbaric conditions[J].Eur Cytokine Netw,2004,15(3):217-121.
[11] Weber SU,Koch A,Kankeleit J,et al.Hyperbaric oxygen induces apoptosis via a mitochondrial mechanism[J].Apoptosis,2009,14(1):97-107.

