生物肽-蛋氨酸脑啡肽增强树突状细胞抗肿瘤活性研究
孙静,李伟伟,华慧,孟一鸣,李璇,单风平
(中国医科大学免疫学教研室,辽宁沈阳110001)
DC(dendritic cell)细胞为体内最强的抗原提呈细胞(APC),DC在T细胞免疫应答中发挥重要作用[1]。DC体外培养获得成功,使其成为免疫学和肿瘤生物治疗的研究热点。本实验采用全细胞性肿瘤抗原体外致敏DC,与蛋氨酸脑啡呔共同作用于小鼠Rac-1淋巴瘤细胞,通过对其杀伤活性的观察,研究蛋氨酸脑啡呔在DC瘤苗抗肿瘤免疫治疗中的价值,为临床抗肿瘤的生物学治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物4~6周龄C57/BL-6小鼠,购置于北京华阜康生物科技有限公司。
1.1.2 实验细胞DC细胞为C57/BL-6小鼠髓系DC2.4细胞株,Rac-1淋巴瘤细胞株亦为C57/BL-6小鼠来源,二者均保存于中国医科大学免疫教研室。
1.1.3 主要材料MENK本课题组保存;流式抗体CD86、MHC-Ⅱ购自美国BD公司;辣根酶标记抗体IgG购自中山金桥,为美国原装进口冻干粉末;ELISA试剂盒购自美国eBioscience公司;酸性磷酸酶试剂盒购自南京建成科技有限公司;DAB显色试剂盒购自武汉博士德生物工程有限公司;RPMI1640培养基和胎牛血清(FCS)均购自Sigma公司。
1.2 方法
1.2.1 DC2.4的复苏与培养复苏冻存的DC 2.4,10%胎牛血清的RPMI完全培养基复苏培养,细胞状态良好时扩大再培养。
1.2.2 Rac-1淋巴瘤细胞冻融抗原的制备常规培养Rac-1淋巴瘤细胞,收集并调整浓度为1×107个/mL,于-80℃深度冰箱冷冻4 h,再常温解冻。反复4次,5 000 r/min离心20 min后取上清,即为Rac-1肿瘤抗原,4℃保存备用。
1.2.3 MENK及Rac-1肿瘤抗原负载DC2.4
收集生长状态良好的DC2.4,分为4组,分别命名为D、R、M、RM:D组DC2.4RPMI完全培养基继续培养;R组DC2.4负载Rac-1肿瘤抗原;M组DC2.4加入10~13 ng/mL的MENK继续培养;RM组DC2.4负载Rac-1肿瘤抗原2 h后加入10~13 ng/mL的MENK继续培养。未成熟DC2.4命名为Id。
1.2.4 DC成熟指标的检测收集生长状态良好的DC2.4,调整细胞浓度至5×104个/mL,按上述各分组处理方法,分别予以分组处理后,行下列指标的检测:①流式细胞检测技术检测CD86,MHC-Ⅱ;②扫描电镜观察DC表面突起形态;③酸性磷酸酶检测试剂盒检测ACP含量;④ELISA试剂盒检测细胞因子IL-12含量;⑤体外刺激淋巴细胞增殖实验:将树突状细胞与小鼠脾脏细胞分别按1∶5、1∶10、1∶20、1∶40、1∶80及1∶160的比例混合后MTS法计算刺激指数(SI)。
1.2.5 肿瘤细胞杀伤功能的检测收集上述各组所诱导培养的淋巴细胞作为效应细胞,接种于96孔板,4 h后加入生长状态良好的Rac-1淋巴瘤细胞作为靶细胞,按1∶100比例混合培养24 h。MTS法于570 nm处测各孔OD值,计算杀伤率。
杀伤率(%)=单独靶细胞对照组A-(实验孔A-单独效应细胞A)/单独靶细胞对照组A
1.2.6 统计学分析采用SPSS16.0软件包统计软件对数据进行处理,数据以均数±标准差表示;组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 DC2.4培养,光镜下观察细胞形态
DC2.4培养,光镜下细胞形态见图1、图2。
图1 未成熟的树突状细胞(200×)Fig.1 Impubic dendritic cell(200×)

图2 趋向成熟的树突状细胞(200×)Fig.2 Mature prone dendritic cell(200×)
2.2 DC2.4成熟指标的检测
2.2.1 DC2.4表面分子CD86,MHC-Ⅱ的检测与Id组相比较,R、M、RM组DC2.4表面分子CD86,MHC-Ⅱ均有明显增加,且各组间比较有统计学差异(表1、图3、图4)。即Rac-1肿瘤抗原、MENK及二者联合应用负载DC2.4均可促进其成熟。
表1 各组细胞表面分子CD86,MHC-Ⅱ表达量百分比(%)(±s,n=3)Table 1 The percentage of CD86 and MHC-Ⅱquantity among every group(%)(±s,n=3)
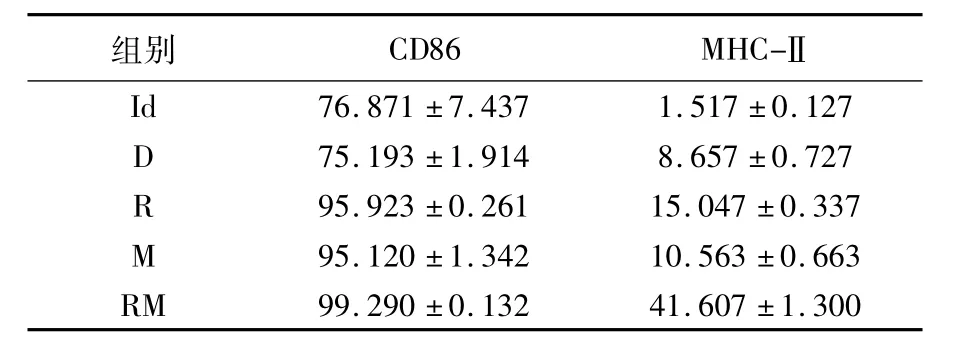
表1 各组细胞表面分子CD86,MHC-Ⅱ表达量百分比(%)(±s,n=3)Table 1 The percentage of CD86 and MHC-Ⅱquantity among every group(%)(±s,n=3)
组别CD86MHC-ⅡId76.871±7.4371.517±0.127 D 75.193±1.9148.657±0.727 R 95.923±0.26115.047±0.337 M 95.120±1.34210.563±0.663 RM99.290±0.13241.607±1.300
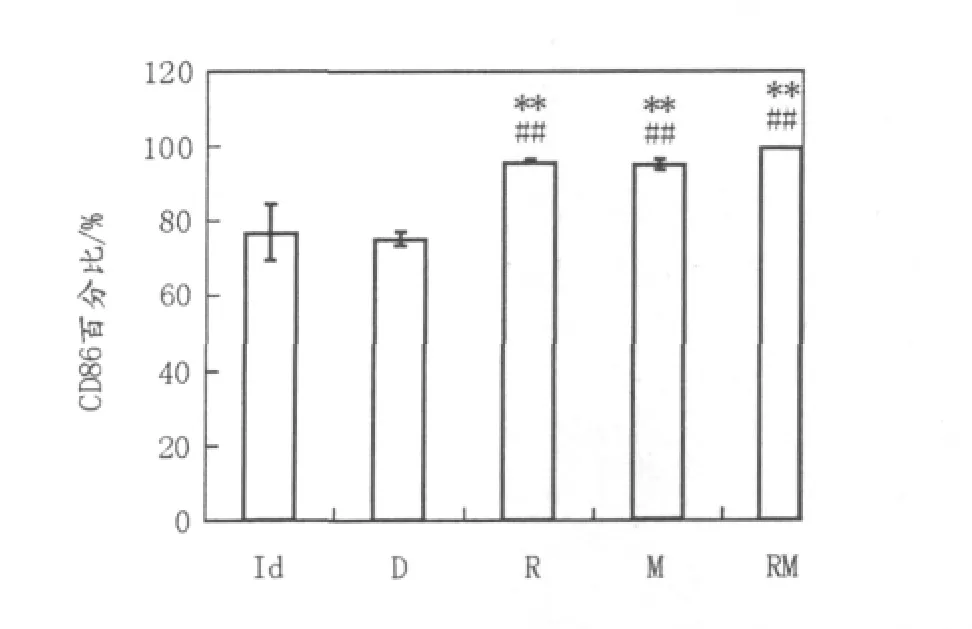
图3 各组DC2.4表面分子CD86表达情况Fig.3 The expression of CD86 among every group DC2.4

图4 各组DC2.4表面分子MHC-Ⅱ表达情况Fig.4 The expression of MHC-Ⅱamong every group DC2.4
2.2.2 扫描电镜观察DC形态经各处理因素作用后,各处理组DC2.4细胞较Id组相比较,细胞表面突起较正常组明显增多,细胞表面突起增多为树突细胞趋向成熟的标志(图5、图6)。即Rac-1肿瘤抗原、MENK及二者联合应用均可促进DC2.4成熟。

图5 未成熟的树突状细胞(3 500×)Fig.5 Impubic dendritic cell(3 500×)

图6 趋向成熟的树突状细胞(3 500×)Fig.6 Mature prone dendritic cell(3 500×)
2.2.3 酸性磷酸酶的检测本实验结果证实,各处理组细胞酸性磷酸酶含量较Id组相比较均有不同程度的减少,且各组间比较亦有统计学意义(图7):各组数据分别为(8.789±0.109)、(8.342±0.049)、(7.274±0.210)、(5.873±0.124)及(4.875±0.220)。即MENK及MENK与肿瘤抗原联合应用均可促进DC2.4成熟。
2.2.4 IL-12的检测IL-12是DC趋向成熟的特异性产物,当细胞趋向成熟时,其分泌的IL-12含量增加。本实验结果表明R、M及RM组细胞分泌水平与Id组相比较均有升高,且组间比较有统计学意义(图8),各组数据分别为(208.250±34.935)、(214.583±32.419)、(300.650±25.699)、(273.467±43.588)及(342.383±36.968)。即Rac-1肿瘤抗原、MENK及二者联合应用均可促进DC2.4成熟。

图7 各组DC2.4酸性磷酸酶含量Fig.7 The quantity of ACP among every group DC2.4
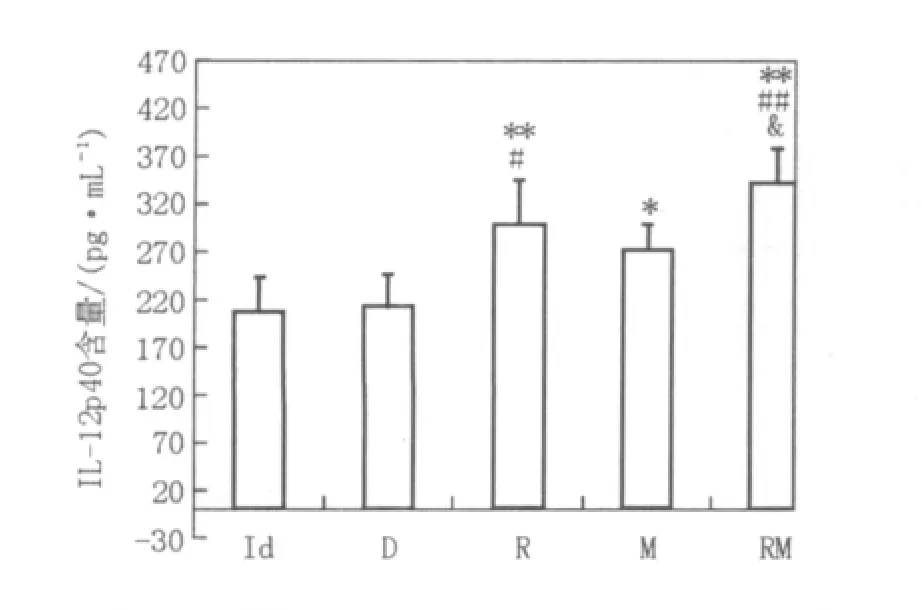
图8 各组DC2.4分泌的细胞因子IL-12含量Fig.8 The quantity of IL-12 secreted by DC2.4 among every group
2.2.5 体外刺激淋巴细胞增殖实验SI检测本实验证实各处理组处理后的DC均可不同程度的刺激淋巴细胞增殖,且组间比较差异有统计学意义(图9)。即Rac-1肿瘤抗原、MENK及二者联合应用均可促进DC2.4成熟。综合分析来看,RM组1∶40处促增殖能力最好,其SI=2.968±0.094。
2.3 对肿瘤细胞杀伤活性的检测
实验结果证实各组诱导淋巴细胞对Rac-1细胞均有强大的杀伤能力,且组间比较有统计学意义(图10),各组数据分别为(1.179±0.142)、(0.782±0.120)、(0.258±0.005)、(0.622±0.047)及(0.129±0.009)。本实验制备的Rac-1特异性树突瘤苗可进行其目的瘤细胞的特异性杀伤,且MENK与肿瘤特异性抗原共同负载后其特异性杀伤功能明显增强。

图9 体外刺激淋巴细胞增殖实验刺激指数(SI)Fig.9 Spur lymphocyte proliferation in vitro
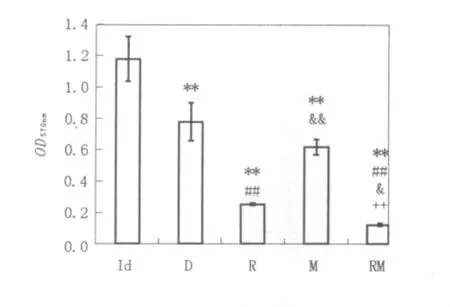
图10 各组DC2.4体外诱导T淋巴细胞对Rac-1细胞的杀伤Fig.10 The killing capability of T lymphocyte to Rac-1 lymphoma cell induced by DC2.4
3 讨论
DC做为专职的抗原提呈细胞,其功能除摄取、加工、呈递特异性抗原外,还是唯一能刺激初始T细胞增殖、诱导初次免疫应答的APC,具有启动特异性免疫应答和诱导免疫耐受的双重功能。DC在机体免疫应答的作用尤其是与肿瘤免疫激活、免疫耐受及相关的治疗性疫苗的研究正在受到高度关注,成为当今肿瘤生物治疗领域备受关注的热点之一[2-4]。近年来,DC疫苗在临床Ⅰ、Ⅱ期实验也取得了令人鼓舞的结果,显示出DC瘤苗在恶性肿瘤治疗中的诱人前景。
DC瘤苗的最早临床应用是治疗淋巴瘤。Hsu等[5]用致敏DC皮下注入B细胞淋巴瘤患者体内,2周后4例患者中1例病变完全消退,所有病人2 a内病情没有继续恶化。随后由于黑色素瘤抗原的研究进展,黑色素的临床治疗报道相对较多。1998年Nature Medieine杂志首次报道了瑞士一所大学采用树突细胞瘤苗治疗晚期黑色素瘤的结果,作者将患者自身肿瘤细胞提取物作为肿瘤抗原,将瘤苗经由腹股沟注入人体,16例患者中有6例获得了客观疗效,其中2例完全缓解[6]。用DC回输骨肉瘤手术后病人也得到了类似的结果,因而认为DC疫苗对临床肿瘤术后的转移和复发有抑制作用。Lichtner等[7]报道了非活动期肺结核的DCI/PB-MC、DC2/PBMC及DCI、DC2绝对数均高于活动期,提示可通过DC数量的变化反映肺结核的疗效。
薛明等[8]证实MENK对成骨细胞有明显的促增殖作用。本课题组前期实验已经证实,应用蛋氨酸脑啡肽对经放化疗后免疫系统受到伤害的晚期肿瘤志愿者进行治疗,患者免疫系统指标全面迅速恢复,淋巴细胞亚群间比例趋于合理,证明蛋氨酸脑啡肽可用于癌症患者的免疫系统恢复治疗。证实MENK单独或联合作用于小鼠CD4+T细胞或树突细胞是均可促进靶细胞的增殖,且提高其生物学活性[9],国外文献亦有相似报道[10]。
本研究证实小鼠Rac-1肿瘤细胞冻融抗原体外冲击制备的DC瘤苗具有典型的DC形态特征与免疫表型特征,采用负载冻融肿瘤裂解物的DC为基础制作疫苗和诱导产生抗原特异性淋巴细胞具有良好的临床应用前景,DC瘤苗在体外能有效诱导肿瘤特异性淋巴细胞,对于小鼠Rac-1肿瘤细胞具有较强的杀伤作用,而且,蛋氨酸脑啡呔能够大大增强这种杀伤活性,提高了DC瘤苗的抗肿瘤作用,这为蛋氨酸脑啡呔应用于临床DC瘤苗的抗肿瘤治疗提供了实验依据与诱人前景。
[1] Shortman,KCauxC.Dendritic cell development:multiplepathways to nature’s adjuvants[J].StemCells,1997,15(6):409-419.
[2] HohlL,Zelle-RieserC,GanderH,et al.1mmunotheraphy of metastatic renal cell carcinoma with tumor lysate-pulse dautologous dendriticcells[J].Clin Cancer Res,2002,8(11):3369-3376.
[3] TangZH,QiuwH,WuGS,et al.Theimmunotherapeutic effect of dendritic cells vaccine modified with interleukin-18 gene and tumor cell lysate on mice with pancreaticcar cinoma[J].World J Gastroenteml,2002,8(5):908-912.
[4] Terasawa H,Tsang KY.Identification and characterization of a human agonist cytotoxic T-lymphocyte epitope of human prostate-specific antigen[J].Clin cancer Res,2002,8(1):41-53.
[5] Hsu FJ,BenikeC,FagnoniF,et al.Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells[J].Nature Med,1996,11(2):52-58.
[6] Murphy GP,Tjoa BA,Simmons SJ,et al.Infusion of dendritic cells pulsed with HLA-A2-specific prostate membrane antigen peptides:a phase in prostate cancer vaccine trial involving patients with hormone-refractory metastatic disease[J].Prosatte,1999,38(1):73-78.
[7] Lichtner M,Rossi R,Mengoni F,et al.Circulating dendriticcells and interferonälpha production in patients with tubereuln-sis:correlation with clinical outcome and treatment response[J].Clin Exp lmmunol,2006,143(2):329-337.
[8] 薛明,高阳,杨谛,等.生物活性肽-蛋氨酸脑啡肽对成骨细胞增殖的影响[J].微生物学杂志,2011,31(2):89-91.
[9] Shan F,Xia Y,Wang N,et al.Functional modulation of the pathway between dendritic cells(DCs)and CD4+T cells by the neuropeptide:methionine enkephalin(MENK)[J].Peptides,2011,32(5):929-937.
[10] von Haefen C,Mei W,Menk M,et al.Ethanol changes gene expression of transcription factors and cytokine production of CD4+T-cell subsets in PBMCs stimulated with LPS[J].Alcohol Clin Exp Res,2011,35(4):621-631.

