维生素A对稳定期COPD患者细胞因子表达的影响Δ
汪俊,余晓丹,刘晓,刘波,徐敏,杨敏丽,李可可,代织文,邵勇(.成都市第五人民医院,成都市 630;2.重庆医科大学附属第一医院,重庆市 40006)
慢性阻塞性肺疾病(COPD)是一种常见、多发、高致残率和高致死率的慢性呼吸系统疾病;是以气道的炎症反应为中心的疾病,且气道炎症反应贯穿疾病的各个阶段。COPD患者慢性炎症的特征是中性粒细胞、巨噬细胞和CD8+淋巴细胞在气道腔、气道壁和肺实质的聚集,这些炎症细胞释放不同的炎症因子(如,肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1、IL-6、IL-8以及白三烯(LT)B4等)从循环系统中趋化炎症细胞,放大炎症效应,诱导结构改变,与氧化应激和蛋白酶/抗蛋白酶失衡等机制共同作用,促进COPD的发生、发展[1]。稳定期COPD患者诱导痰中性粒细胞数以及IL-8、IL-6、IL-10与TNF-α均明显高于正常对照[2]。上皮细胞是参与炎症过程的效应细胞,其可以促进白细胞的特异性聚集,在中性粒细胞迁移、滞留和活化过程中起作用。维生素A(VA)对维持气道上皮的完整性,预防气道细菌感染有重要的作用,因此VA缺乏会影响COPD患者以中性粒细胞为主的炎症反应。既往对VA缺乏的幼儿研究及哮喘动物模型均证实,补充VA能降低炎症因子水平。从理论上推测,给予VA补充治疗后可降低COPD患者气道内及系统的炎症反应。本研究基于上述理论,研究了COPD患者血清VA水平与诱导痰及血清中细胞因子(IL-8、TNF-α、IL-1β)的关系。
1 资料与方法
1.1 一般资料
选择2009年12月-2010年6月成都市第五人民医院呼吸科COPD数据库中稳定期COPD患者100例为研究对象,所有研究对象符合GOLD COPD诊断标准[3],中途退出及失访者16例,共完成84例。其中,男性44例,女性40例,平均年龄67.8岁,轻度、中度、重度、极重度患者的比例为1∶1∶1∶1。所有患者随机均分为对照组、治疗1组和治疗2组,3组患者的性别、年龄、病情程度比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
所有患者采用比利时麦迪肺功能测试仪测定入组时血清VA、血及诱导痰细胞因子(IL-8、IL-1β、TNF-α)水平。所有患者均给予常规治疗。治疗1组在此基础上加服VA胶丸(青岛双鲸药业有限公司,规格:5 000 u,批号:100114)5 000 u,qd;治疗2组加服10 000 u VA(生产厂家,规格同治疗一组),qd。于入组后1个月、3个月、6个月进行随访,随访时再次进行上述指标的检测。
1.3 检测方法
1.3.1 血清VA测定方法 采集静脉血2 mL,避光保存,离心,取血清0.2 mL,加入0.2 mL乙醇沉淀蛋白后,用5 mL正己烷振荡提取1 min,取正己烷层氮气挥干,残渣用0.1 mL甲醇溶解,15 000 r·min-1离心,取上清液进样测定血清VA浓度。色谱条件:Agilent HP1100高效液相色谱仪,C18柱(250 mm×4.6 mm,5 µm,Phenomenex,USA);流速:1.0 mL·min-1;流动相:纯甲醇;检测波长:325 nm;柱温:25℃。
1.3.2 痰的诱导和制备[4]诱导前先用肺功能仪测定1 s用力呼气容积(FEV1)和用力肺活量(FVC),重复3次,取最佳值。研究对象以清水漱口,首先预防性吸入沙丁胺醇气雾剂(葛兰素史克制药公司,规格:50 mg)200 μg,防止吸入高渗盐水引起的气道痉挛,然后超声雾化吸入3%氯化钠溶液[5]15 min后深咳痰液,此后每3 min深咳1次,共20~30 min。要求收集的痰液量至少>1 mL。在吸入过程中密切观察受检者状况,若在操作过程中出现哮喘症状或症状加重则暂停吸入。
将合格标本(镜检见鳞状上皮细胞占有核细胞比例<20%,即为合格标本)加入4倍于痰量的0.1%二硫苏糖醇(DTT)37℃震荡30 min,再加入4倍痰量的磷酸盐缓冲液,通过60 μm的尼龙网过滤,2 000 r·min-1离心10 min,吸取上清液于-70℃冰柜保存。
1.3.3 血样收集与处理 3组患者取空腹静脉血3 mL各2管,其中一管中加有10%EDTA-Na2用于TNF-α的检测,采血后立即1 500 r·min-1离心去除细胞,取1.0 mL血清,加入10 μL抑肽酶,摇匀,-70℃冰柜保存,待测;另一管中不加入抗凝剂和抑肽酶,采血后立即分离血清,-70℃冰柜保存,待测。
1.3.4 细胞因子的检测方法 IL-8、IL-1β、TNF-α水平测定均采用放射免疫分析,试剂盒购自北京北方生物技术研究所,按说明书操作。
1.4 统计学方法
采用SPSS 13.0统计软件处理,各组计量资料前、后比较采用t检验,多组间均数进行方差分析,各组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后血清中VA水平的比较
治疗前,3组VA水平均低于正常人,3组间比较差异无统计学意义(P>0.05)。治疗1个月后,各组VA水平较治疗前无明显变化(P>0.05)。治疗3个月后,2个治疗组VA水平分别较治疗前显著提高(P<0.05),并且3组患者VA含量两两比较差异均有统计学意义,2个治疗组均高于对照组(P<0.05),治疗2组明显高于治疗1组(P<0.05)。治疗6个月后,2个治疗组患者VA水平较治疗3个月时明显增加(P<0.05),且3组间两两比较差异均有统计学意义(P<0.05)。治疗前、后血清中VA水平详见表1。
表1 治疗前后血清中VA水平(mg·mL-1,±s)Tab 1 Levels of vitamin A in serum before and after treatmen(tmg·mL-1,±s)

表1 治疗前后血清中VA水平(mg·mL-1,±s)Tab 1 Levels of vitamin A in serum before and after treatmen(tmg·mL-1,±s)
组别对照组治疗1组治疗2组例数/n 28 28 28治疗前0.34±0.10 0.31±0.09 0.30±0.12治疗1个月后0.35±0.15 0.32±0.11 0.35±0.08治疗3个月后0.32±0.11 0.41±0.15 0.48±0.17治疗6个月后0.36±0.13 0.48±0.08 0.56±0.13
2.2 治疗前后诱导痰中细胞因子的比较
治疗前,3组诱导痰中细胞因子水平无显著性差异(P>0.05)。治疗1个月后,各组诱导痰中细胞因子水平较治疗前无明显变化(P>0.05)。治疗3个月后,2个治疗组细胞因子水平均较治疗前有所下降(P<0.05),但3组比较差异无统计学意义(P>0.05)。治疗6个月后,2个治疗组细胞因子水平均较治疗3个月时明显下降,且3组两两比较差异均有统计学意义(P<0.05);2个治疗组细胞因子水平均明显低于对照组(P<0.05),治疗2组明显低于治疗1组(P<0.05)。治疗前、后诱导痰细胞因子水平详见表2。
表2 治疗前后诱导痰细胞因子水平(ng·mL-1,x ±s)Tab 2 Cytokines levels of induced sputum before and after treatmen(tng·mL-1,±s)

表2 治疗前后诱导痰细胞因子水平(ng·mL-1,x ±s)Tab 2 Cytokines levels of induced sputum before and after treatmen(tng·mL-1,±s)
细胞因子IL-1β IL-8 TNF-α组别对照组治疗1组治疗2组对照组治疗1组治疗2组对照组治疗1组治疗2组治疗前1.63±0.26 1.61±0.56 1.57±0.58 3.73±1.44 3.64±1.89 3.34±1.20 31.12±9.83 30.58±8.71 29.14±7.19治疗1个月后1.59±0.31 1.57±0.61 1.55±0.34 3.69±1.23 3.71±1.75 3.56±1.08 26.23±9.03 18.32±7.56 16.29±8.51治疗3个月后1.62±0.29 1.37±0.42 1.32±0.35 3.65±1.08 3.15±1.31 3.06±1.27 32.08±8.78 24.51±7.98 22.15±6.51治疗6个月后1.67±0.35 1.22±0.28 1.09±0.21 3.57±1.74 2.36±1.39 2.08±1.32 33.45±9.32 20.95±8.41 16.51±6.87
2.3 治疗前后血清中细胞因子的比较
治疗前,3组血清中细胞因子水平比较差异无统计学意义(P>0.05)。治疗1个月后,细胞因子水平较治疗前无明显提高,且3组间比较差异无统计学意义(P>0.05)。治疗3个月后,2个治疗组细胞因子水平均较治疗前有所下降(P<0.05),但3组比较差异无统计学意义(P>0.05)。治疗6个月后,2个治疗组细胞因子水平均较治疗3个月时明显下降(P<0.05),3组两两比较差异均有统计学意义(P<0.05);2个治疗组均明显低于对照组(P<0.05),且治疗2组明显低于治疗1组(P<0.05)。治疗前、后血清中细胞因子水平详见表3。
表3 治疗前后血清中细胞因子水平(ng·mL-1,x ±s)Tab 3 Cytokines levels of serum before and after treatmen(tng·mL-1,±s)
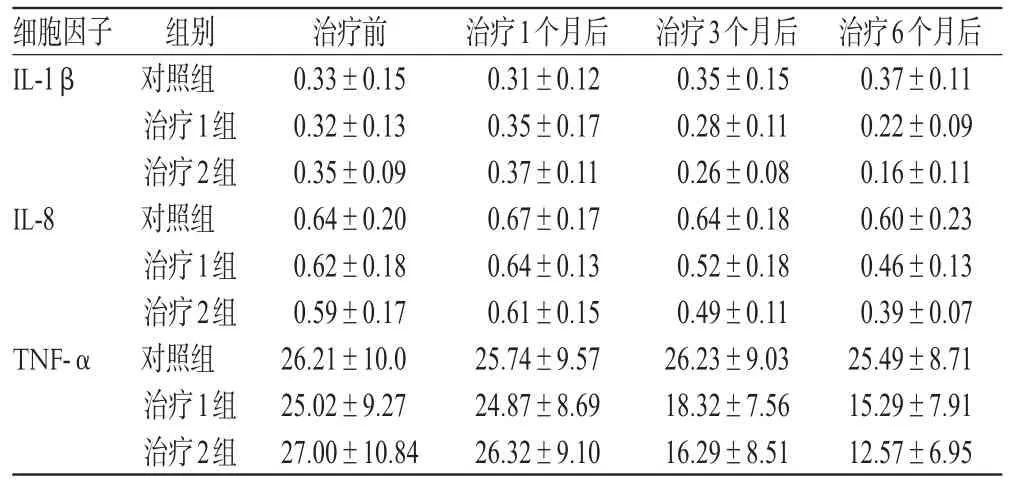
表3 治疗前后血清中细胞因子水平(ng·mL-1,x ±s)Tab 3 Cytokines levels of serum before and after treatmen(tng·mL-1,±s)
细胞因子IL-1β IL-8 TNF-α组别对照组治疗1组治疗2组对照组治疗1组治疗2组对照组治疗1组治疗2组治疗前0.33±0.15 0.32±0.13 0.35±0.09 0.64±0.20 0.62±0.18 0.59±0.17 26.21±10.0 25.02±9.27 27.00±10.84治疗1个月后0.31±0.12 0.35±0.17 0.37±0.11 0.67±0.17 0.64±0.13 0.61±0.15 25.74±9.57 24.87±8.69 26.32±9.10治疗3个月后0.35±0.15 0.28±0.11 0.26±0.08 0.64±0.18 0.52±0.18 0.49±0.11 26.23±9.03 18.32±7.56 16.29±8.51治疗6个月后0.37±0.11 0.22±0.09 0.16±0.11 0.60±0.23 0.46±0.13 0.39±0.07 25.49±8.71 15.29±7.91 12.57±6.95
3 讨论
COPD是由有毒颗粒和气体(主要是吸烟)引起的肺部炎症及全身效应性疾病,不完全可逆的进行性的气流受限是其主要特征。其病理组织学特点是气道上皮细胞、上皮下网状结构、平滑肌细胞和杯状细胞黏液腺等,因慢性炎症而发生结构破坏与修复,产生气道管壁增厚变形,以平滑肌增厚最显著,导致气道管腔狭窄和气道阻力增加,形成气道重塑。产生这一系列病理生理改变的主要环节之一是慢性气道炎症[6]。
VA在维持机体正常功能、调节物质代谢和维持生理功能等方面发挥着重要作用,具有促进生长、消除炎症、调节免疫、维持细胞结构的功能,在呼吸系统的发生、发展中具有重要作用。从动物模型到人体试验均证实[7],VA能促使肺泡上皮的修复。VA水平低下可能对机体产生以下影响:(1)呼吸道黏膜中纤毛柱状上皮细胞消失,并出现鳞状上皮化生、表层角化、脱落阻塞管腔,且腺体失去正常功能、分泌物减少、肺弹性减低、局部非特异性免疫功能降低,病毒或细菌易侵入人体内引起继发感染;(2)影响呼吸道黏膜,使其分泌型免疫球蛋白(SI-gA)分泌减少,从而影响局部免疫功能;(3)可导致细胞免疫功能受损,淋巴细胞转换受到明显影响;(4)可使类固醇激素合成发生障碍及淋巴细胞抑制,降低抗过敏、抗感染的能力[8]。VA对维持气道上皮的完整性,预防气道细菌感染有重要的作用,而COPD患者的气道上皮细胞是参与炎症过程的效应细胞,可以促进白细胞的特异性聚集,并且通过表达重要的中性粒细胞黏附配体,重组人细胞间黏附分子(ICAM-1)在中性粒细胞迁移、滞留和活化过程中起作用。因此,VA缺乏会影响COPD患者以中性粒细胞为主的炎症反应。
大多数人认同,VA缺乏会影响患儿气道上皮细胞的完整性,导致患儿反复呼吸道感染;VA补充后能明显增加幼儿巨噬细胞和中性粒细胞的功能,影响细胞因子IL-1、TNF-α的合成[9]。对哮喘动物模型的研究也证实,VA与哮喘的炎症反应有关。陈慧敏等[10]对哮喘豚鼠的研究表明,补充VA可以减轻哮喘的炎症反应,在一定范围内随VA摄入量增加,效果更显著。方红等[11]对哮喘大鼠的研究得出类似结论,并认为VA对减轻哮喘的炎症反应的作用与TNF有关。近年来,VA在COPD中的作用在理论以及动物实验方面得到了多数学者的认可,但是仍然有研究得出不同的结论,并且针对COPD患者的研究资料较少。2003年,Lucey EC等[12]发表文章称,全反式维甲酸治疗并不能够改善成年肺气肿模型大鼠气道的大小,也不会影响弹性蛋白酶及前胶原mRNA的表达。2004年,Fujita M等[13]的实验也发现视黄醇并不能对大鼠的肺气肿产生有益的影响,认为VA应用于COPD患者对其症状以及肺功能的改善作用并不让人满意,可能的原因在于没有在疾病早期意识到营养支持的重要性并进行补充。VA缺乏在COPD患者中普遍存在,10种老年慢性疾病VA水平分析[14]中发现,肺气肿和肺心病是发生VA缺乏率最高的疾病,分别达到了51.5%和91.6%。并且吸烟等因素导致VA的消耗过多,给予一定剂量的VA补充是必要而且安全的。Mao JT等[15]对严重肺气肿患者给予3个月VA治疗,结果表明,患者对VA的耐受性较好、不良反应轻,并认为进一步的研究应该了解高剂量、长时间及不同剂量的可行性。
本课题组的前期研究已经对稳定期COPD患者以及健康吸烟成人诱导痰和血清中的IL-8、IL-1β、TNF-α水平及血清中VA水平进行了测定。结果显示,稳定期COPD患者诱导痰和血清中IL-8、IL-1β、TNF-α较健康吸烟组均升高,本地区稳定期COPD患者血清VA的浓度低于正常成年人(0.56±0.12)mg·L-1,差异具有统计学意义(P<0.05),这表明COPD患者中存在系统性炎症反应。这种改变不仅与支气管-肺组织的慢性炎症有关,而且可加剧COPD的严重程度并可造成全身炎症反应。同时也提示,稳定期COPD患者具有较低的VA水平。本研究在此基础上对稳定期COPD患者补充VA,观察其能否调节COPD关键细胞因子的表达,进而延缓病程的进展。结果显示,补充VA后,2个治疗组患者血清VA的浓度均有不同程度的上升,服药剂量越大、时间越长,血清VA浓度上升越明显。补充VA1个月后,细胞因子水平较治疗前无明显增加,且3组间比较无统计学差异(P>0.05);3个月后,2个VA治疗组细胞因子水平分别较治疗前有所下降(P<0.05),2组比较差异无统计学意义(P>0.05);6个月后,2个治疗组细胞因子水平较3个月随访时进一步下降,治疗2组下降较治疗1组更明显(P<0.05)。由此可以看出,VA可以下调稳定期COPD患者诱导痰和血清中IL-8、IL-1β、TNF-α的表达水平。TNF-α是细胞因子级联反应的初级因子和触发成分,可使上皮细胞、巨噬细胞和肺组织的核因子-κB(NF-κB)活性增强,并诱导血管细胞黏附因子(VCAM-1)的表达,而VCAM-1参与炎症过程中淋巴细胞、单核细胞和中性粒细胞的黏附和浸润[16,17],引起肺损伤,并诱导产生一系列的细胞因子。IL-1β主要由活化的单核-巨噬细胞产生,是机体前炎症免疫反应的主要诱导剂。IL-8是其中最重要的趋化和激活中性粒细胞(PMN)的细胞因子,主要由单核巨噬细胞在IL-1、TNF-α等诱导下合成与释放[18]。由此推测,VA可能是通过抑制TNF-α的表达[19],进而抑制其他细胞因子的表达,起到抗炎作用的。
综上所述,VA类物质作为一类具有多相性调节作用的物质,对各种炎症、免疫和结构细胞的功能均有调节作用。提高对此类物质广泛生理调节作用的认识,将为COPD的防治提供新的思路。
[1] Groenewegen KH,Postma DS,Hop WC.Increased systemic inflammation is a risk factor for COPD exacerbations[J].Chest,2008,133(2):350.
[2] 陈国忠.慢性阻塞性肺疾病的炎症反应与营养不良密切相关[J].中华临床营养杂志,2009,17(6):328.
[3] Global strategy for the diagnosis,management,and prevention of chronicobstructive pulmonary disease.Global Initiative for Chronic Obstructive Lung Disease[EB/OL].http://www.goldcopd.org/uploads/users/files/GOLDWksh p05Clean.pdf.2010-12.
[4] Brightling CE.Clinical applications of induced sputum[J].Chest,2006,129(5):1 344.
[5] 周向东,邬海桥,李升锦.雾化吸人渗透压对痰液外排的影响[J].临床肺科杂志,2004,9(2):104.
[6] Jeffery PK.Remodeling and inflammation of bronchi in asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2004,1(3):176.
[7] Hind M,Gilthorpe A,Stinchcombe S,et al.Retinoid induction of alveolar regeneration:from mice to man?[J].Thorax,2009,64(5):451.
[8] 郭 超.维生素A与慢性阻塞性肺疾病[J].中国厂矿医学,2008,21(1):102.
[9] 徐世侠,叶广俊,薛 彬,等.维生素A及维生素C对肺巨噬细胞产生活性氧及细胞因子的影响[J].中华儿童保健杂志,1998,6(4):264.
[10] 陈慧敏,蒋卓勤.不同水平维生素A对哮喘豚鼠IL-5和IgE的影响[J].广东医学,2006,27(9):1 294.
[11]FANG Hong,JIN Hongfang,WANG Hongwei.Effect of all-trans retinoic acid on airway inflammation in asthmatic rats and its mechanism[J].Journal of Huazhong Univer-sity of Science and Technology Med Sci,2004,24(3):229.
[12] Lucey EC,Goldstein RH,Breuer R,et al.Retinoic acid does not affect alveolar septation in adult FVB mice with elastase-inducedemphysema[J].Respiration,2003,70(2):200.
[13] Fujita M,Ye Q,Ouchi H,et al.Retinoic acid fails to reverse emphysema inadult mouse models[J].Thorax,2004,59(3):224.
[14] 闻淑军,林国云,李慎果.10种老年慢性病患者血清维生素A水平的调查分析[J].天津医药,1999,27(7):413.
[15] Mao JT,Goldin JG,Dermand J,et al.A pilot study of all-trans-retinoic acid for the treatment of human emphysema[J].Am J Respir Crit Care Med,2002,165(5):718.
[16] Pinto-Plata VM,Livnat G,et al.Systemic cytokines,clinical and physiological changes in patients hospitalized for exacerbation of COPD[J].Chest,2007,131(1):37.
[17] Yang YM,Sun TY,Liu XM.The role of serum leptin and tumor necrosis factor-alpha in malnutrition of male chronic obstructive pulmonary disease patients[J].Chin Med J(Engl),2006,119(8):628.
[18] Marchand AS,Plantier L,Bernuau D,et al.Keratinocyte growth factor expression by fibroblasts in pulmonary fibrosis:poor response to interleukin-1beta[J].Am J Respir Cell Mol Biol,2005,32(5):470.
[19] Besnard V,Nabeyrat E,Henrion A,et al.Protective role of retinoic acid from antiproliferative action of TNF-α on lung epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2002,282(4):86.

