速生杨半纤维素的分级分离、物化特性以及均相酯化
崔红艳 ,刘 玉 ,杨桂花 ,陈嘉川 ,孙润仓 ,J M Fang,J Tomkinson,Z C Geng,J C Liu
(1.山东轻工业学院 制浆造纸科学与技术教育部重点实验室,山东 济南 250353;2.威尔士大学 生物合成中心,英国 威尔士 班戈LL 57 2UW;3.西北农林科技大学,陕西 杨凌 712100)
速生杨半纤维素的分级分离、物化特性以及均相酯化
崔红艳1,刘 玉1,杨桂花1,陈嘉川1,孙润仓2,J M Fang2,J Tomkinson2,Z C Geng3,J C Liu3
(1.山东轻工业学院 制浆造纸科学与技术教育部重点实验室,山东 济南 250353;2.威尔士大学 生物合成中心,英国 威尔士 班戈LL 57 2UW;3.西北农林科技大学,陕西 杨凌 712100)
在20℃下分别用质量分数为1.5%、3.0%、5.0%、7.5%和8.5%的NaOH溶液抽提脱蜡及部分脱木素后的速生杨木16 h,分别可得到65.6%、71.6%、73.8%、85.6%和89.3%的原半纤维素。木聚糖是速生杨细胞壁中最主要的半纤维素。用FT-IR,13CNMR,GPC来进一步确定分离得到的5种半纤维素样品的特性,结果表明:半纤维素包含了1条由D-吡喃木糖基通过β-1,4键连接起来的主链。分别用丙酰氯、己酰氯、十二酰氯和十六酰氯将在20℃、8.5%NaOH溶液抽提16 h得到的半纤维素酯化,反应在均相的N,N-二甲基酰胺(DMF)/LiCl体系中进行,用4-二甲氨基吡啶作催化剂,用三乙胺作中和剂。初步考查了酰氯/无水木糖单元的摩尔比、三乙胺浓度、反应时间和温度对半纤维素衍生物得率和取代度的影响。在给定反应条件下,取代度在0.44和1.44之间。在最佳反应条件下,摩尔比为3∶1、反应温度为75℃和反应时间为40 min时,半纤维素中70%的羟基被十六酰化。从相对分子质量测定的结果可以看出(相对分子质量为48 000~127 200 g/mol):在60~75℃、25~40 min的快速反应中,大相对分子质量的半纤维素只发生了很小程度的降解。
半纤维素;分离;酯化;表征
1 速生杨半纤维素的分离
1.1 原料
速生杨木,树龄12年,1997年12月收获。

干燥后的粗综纤维素在进行碱抽提以前应保持在5℃。速生杨组成:43.8%纤维素,27.1%半纤维素,23.3%木素,1.6%灰分,2.0%蜡。4-二甲基氨基吡啶(DMAP)、三乙胺(TEA),均为试剂 级,无水LiCl在 130℃下干燥 2 h,丙酰氯(PC)、十六酯氯(PAC)、己酰氯(HC)、十二酰氯(LC)。
1.2 半纤维素的分离与注意事项
图1为从部分脱木素的速生杨中分离半纤维素和纤维素流程。
注意事项:(1)馏分中半纤维素联合的糖组分首先需要在2 mol/L的三氟乙酸中水解 2 h(120℃);(2)在40℃下用真空蒸发除去三氟乙酸;(3)干燥后的单糖在二甲基亚砜中用硼氢化钠还原,得到的糖醛(alditol)乙酰化,用1-甲基咪唑作为催化剂;(4) 通过对糖醛乙酸酯(alditol acetates)的气相色谱GC的分析来确定分离得到的半纤维素试样中的中性糖的组成;(5)与半纤维素联连的木素的碱性硝基苯氧化反应在170℃下反应3 h。
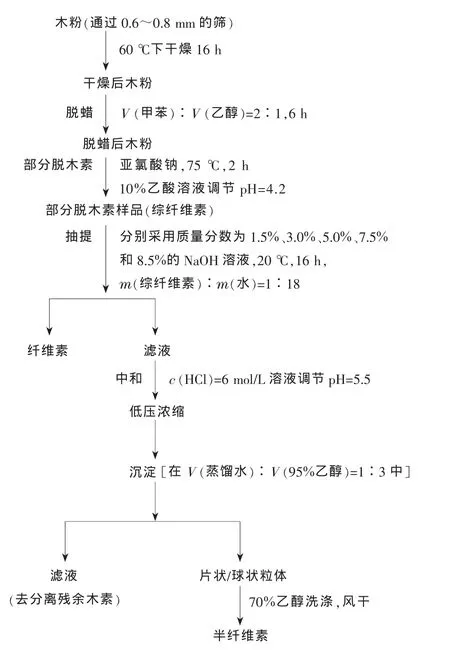
图1 从部分脱木素的速生杨中分离半纤维素和纤维素流程
2 速生杨半纤维素的酯化
2.1 半纤维素的酯化
把在20℃下用质量分数为8.5%的NaOH溶液抽提脱蜡及部分脱木素速生杨木16 h、得到的半纤维素取0.6 g加入到30 mL蒸馏水中,混合物加热到60~80℃,搅拌,直到半纤维素完全溶解(大约5 min)。然后加入30 mL体积的DMF,反应,搅动5 min。在50℃下减压蒸发,除去膨胀凝胶(swollengel)中的水分,然后逐滴加入含有 0.15 g LiCl、0.10 g DMAP,相对应摩尔量的 PC,HC,LC,PAC 以及适量的TEA(占原半纤维素的质量比,TEA预先溶解在15 mL的DMF中)的溶液。搅拌,在给定反应温度下分别反应25、30、35和40 min。反应终止后用冷水冷却至室温,把均相反应混合液缓慢倒入120 mL 95%的乙醇中,搅拌。有机溶剂溶解在乙醇中,从而与沉淀分离。从溶液中分离出来的白色产物经过滤,收集。滤液用乙醇和丙酮彻底洗涤。最终的产品用乙醇纯化6 h(索式抽提器),空气干燥24 h,进一步在烘箱中55℃下干燥16 h。
2.2 酯化半纤维素的特性
得率的计算基于这样一个假设:所有的半纤维素都转化为di-esterified的半纤维素。在这种假设中,得率和取代度分别是100%和2.0。混合溶液中未反应的酰基氯通过溶于95%乙醇和丙酮中从而与产物(产品)分离。如果没有反应发生,并且所有半纤维素在回收过程中未发生反应,那么丙酰化的得率将是54%,乙酰化的得率将是40.2%,十二酰化的得率将是21.7%。酯化半纤维素的平均相对分子质量由 GPC(凝胶渗透色谱,PLgel 5 μm Mixed-D柱)测定。 样品溶于 w(吡啶)∶w(LiCl)[w(吡啶)∶w(LiCl)的浓度为 0.1%质量分数;样品的浓度为0.1%质量分数],200 μL溶液被注射进去。柱子在80℃下用 w(吡啶)∶w(LiCl)以 1 mL/min的速度洗涤。用PL支链淀粉聚糖来校准柱子。溶解度的测定是在4%浓度下的不同种类的有机溶剂中进行。
3 对速生杨半纤维素特性的讨论
3.1 分离半纤维素的得率以及糖组成
在对脱蜡及部分脱木素速生杨木的碱性处理过程中,许多木素分子间、木素与多糖之间的对碱不稳定的化学键也许会被碱破坏。分子中被酸化的部分,例如羧基和酚基在碱性溶液中会发生电离,也可能促使半纤维素和残余木素的增溶,这或许是因为单个碎片溶解性地增加,或许是因为细胞壁的润胀。
表1 为20℃下不同碱浓度处理脱蜡及部分脱木素的速生杨16 h所得到的半纤维素的得率(表1~3中的检测项目的测定方法参见GB/T 2677.5—1993)。

表1 20℃下不同碱浓度处理脱蜡及部分脱木素的速生杨16 h所得到的半纤维素的得率 /%
由表1看出:在 20℃下处理粗综纤维素16 h,当碱溶液的质量分数1.5%上升至8.5%时,碱浓的增大有利于半纤维素的溶出。预测:如果碱浓继续增加,将会有更多的半纤维素溶出。
表2 显示了溶解的半纤维素试样中的中性糖的组成和糖醛酸的含量。

表2 半纤维素试样中的中性糖及糖醛酸的含量/%1)
由表2明显看出,木糖是最主要的糖组分,占总糖含量的78.7%~88.8%。甘露糖和葡萄糖含量较少,鼠李糖、阿拉伯糖、半乳糖含量更少。这说明木糖是杨木细胞壁主要的半纤维素。进一步的研究发现:这些聚合物是不均一的带支链的糖类半纤维素,大约含有200个β-吡喃木糖(β-xylopyranose)残基,通过1,4-苷键连接。碱溶液的质量分数由1.5%增加至8.5%,导致了半纤维素试样中木糖由88.8%减至78.7%,甘露糖由2.2%增至9.0%,葡萄糖由3.5%增至7.2%。
甘露糖和葡萄糖含量随碱浓的增加而增加,说明杨木中也含少量的葡萄糖甘露聚糖(glucomannan),并且葡甘聚糖更易在相对较高碱浓下被抽提。
糖醛酸的含量,主要是葡萄糖醛酸(glucuronic acid)或者 4-O-甲基 -葡萄糖醛酸(MeGlcA)的质量分数为8.4%~12.3%。这个结果表明:MeGlcA取代基随着碱浓的增加更不稳定[1]。
表3 显示了碱抽提残余物中中性糖的组成。
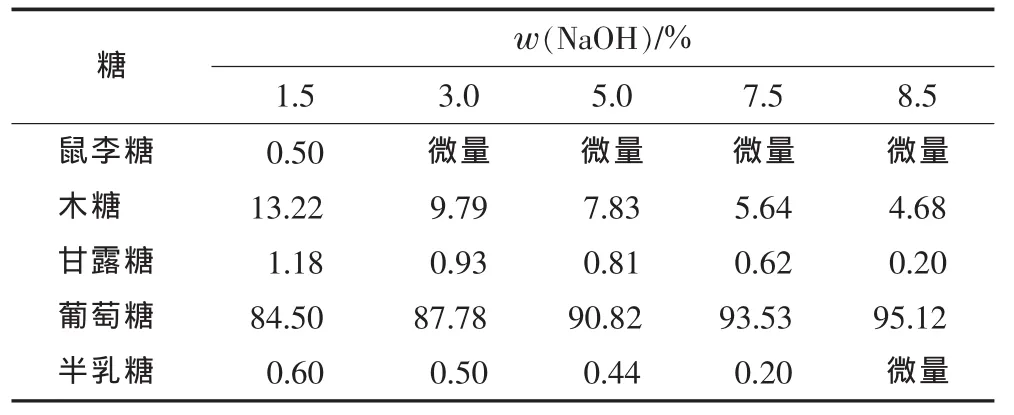
表3 碱抽提残余物中中性糖的组成 /%1)
通过糖组分分析得知,碱处理后的残余物主要由纤维素构成。表3的数据表明:葡萄糖是最主要的糖组分,占总糖组分的84.5%~95.1%。碱溶液的质量分数从1.5%增加至8.5%能导致残余物(残渣)中纤维素的增加,葡萄糖从84.5%增加至95.1%。木糖从13.2%降至4.7%,这与逐渐增加的溶解的半纤维素的量相对应(即溶解的半纤维素的量随碱浓的增加而增加)。残余馏分用质量分数为8.5%的NaOH溶液抽提,仍含有少量的木糖(4.7%)和极少量的甘露糖(0.2%)。较高碱浓(时间16 h)抽提所遭受的这些阻力,意味着速生杨细胞壁中半纤维素与纤维素表面紧密连接,或者说半纤维素非常紧密地连接在纤维素表面[2-3]。
3.2 原半纤维素的相对分子质量分布
分离半纤维素试样的重均相对分子质量、数均相对分子质量和多分散性如表4所示。

表4 原半纤维素试样的重均相对分子质量、数均相对分子质量和多分散性
由表4可见,在给定条件下,NaOH溶液的质量分数从1.5%上升7.5%,平均Mw从38 830 g/mol增加至42 230 g/mol,稍微增长。增加碱浓度有助于杨木中大尺寸分子的半纤维素的溶解。当碱的质量分数增加至8.5%时,平均Mw下降至39 250 g/mol,表明在20℃下用质量分数8.5%的NaOH处理16 h会引起溶解的半纤维素的稍微降解。
图2为20℃时用质量分数为5.0%的NaOH溶液抽提脱蜡及部分脱木素速生杨木16 h所得到的半纤维素试样的GPC相对分子质量分布图。
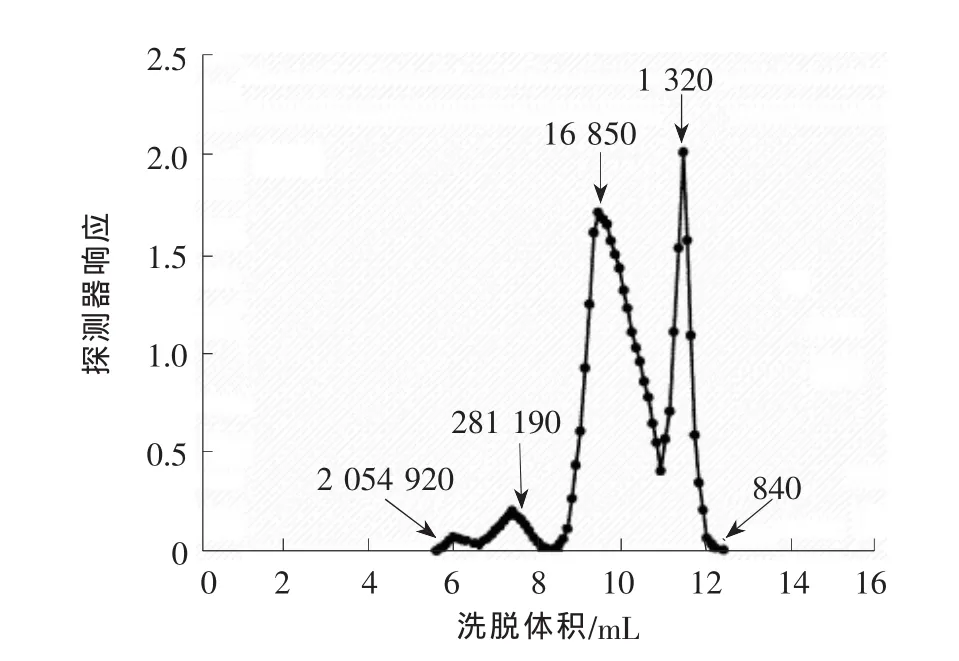
图2 20℃下用5.0%NaOH溶液抽提脱蜡及部分脱木素速生杨木16 h所得到的半纤维素试样的GPC相对分子质量分布图
从图2可看出,相对分子质量范围在2 000 000~840 g/mol之间,有3个尖峰位,相对分子质量分布表现出很宽的多分散性。在1 320 g/mol小峰处有较低的相对分子质量,可能因为在高碱浓抽提过程中,半纤维存在降解。
3.3 原半纤维素的FT-IR光谱图
图3为质量分数分别为 1.5%、5.0%、7.5%和8.5%的NaOH溶液抽提所得到4种半纤维素的FT-IR谱图,光谱检测频度为800~4 000 cm-1。
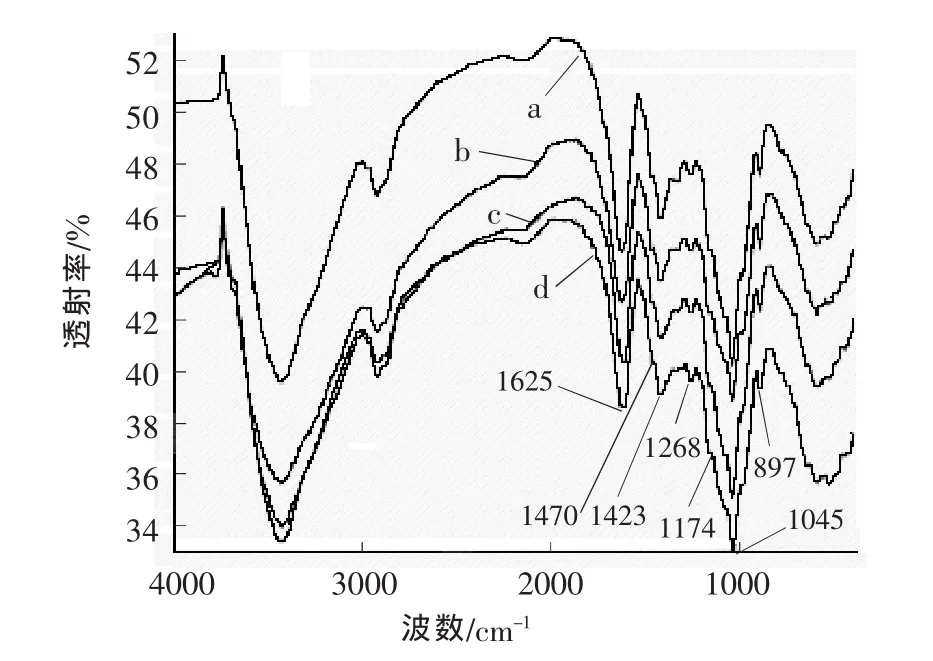
图3 NaOH溶液抽提所得到4种半纤维素的FT-IR谱图
从图3可以看出,4种谱图以及峰的相对强度非常类似,表明4种半纤维素具有相似的结构。1 625 cm-1处的吸收峰主要是与吸收水有关的峰。1 045 cm-1处是主要的吸收峰,是半纤维素中C—O和C—C的伸缩振动,或是C—OH的弯曲振动。897 cm-1处小的尖峰是糖单元间的β-苷键(β-glycosidic)。
图4为20℃下用质量分数分别为1.5%、5.0%、7.5%和8.5%的NaOH溶液处理脱蜡及部分脱木素速生杨16 h所得到的纤维素组分的FT-IR谱图。

图4 NaOH溶液处理脱蜡及部分脱木素速生杨16 h所得到的纤维素组分的FT-IR谱图
图4与图3相似,纤维素谱图没有明显本质上的不同。所有谱图都在1 646 cm-1处有一个强烈的与吸收水有关的峰。 1 434 cm-1、1 375 cm-1、1 322 cm-1、1 169 cm-1、1 070 cm-1、1 023 cm-1和 904 cm-1是纤维素的特征峰[4-11]。
3.4 原半纤维素的13C NMR核磁共振谱图
为进一步得到苷键形式的信息,进行了13C NMR的研究。图5为20℃下用质量分数为8.5%的NaOH溶液处理16 h得到的半纤维素的13C NMR图谱(在D2O中)。

图5 NaOH溶液处理16 h得到的半纤维素的13C NMR图谱
图5中,由1,4-连接的β-D-木糖基单元,可以 由 5 个 强 烈 信 号 定 性 :104.6×10-6、78.3×10-6、77.0×10-6、75.6×10-6和 65.7×10-6,这 5 个信号分别代表着β-D-木糖单元中的 C-1、C-4、C-3、C-2 和C-5。 103.0×10-6、74.1×10-6和 62.1×10-6对应的是D-甘露糖残余物的 C-1、C-3和 C-6。 62.1×10-6处的信号有D-葡萄糖单元中的C-6的叠加。半纤维素中MeGlcA残余物的C-1和C-4信号分别出现在99.9×10-6和 85.2×10-6处。以上这些数据表明:半纤维素主链D-木糖残余物的苷键连接形式是β。半纤维素的这个β-苷键链接结构与针叶木和禾本科植物(谷物茎秆和草)的半纤维素链接一样[12-20]。
3.5 酯化半纤维素的得率和取代度
表5 为酯化半纤维素的得率和取代度。
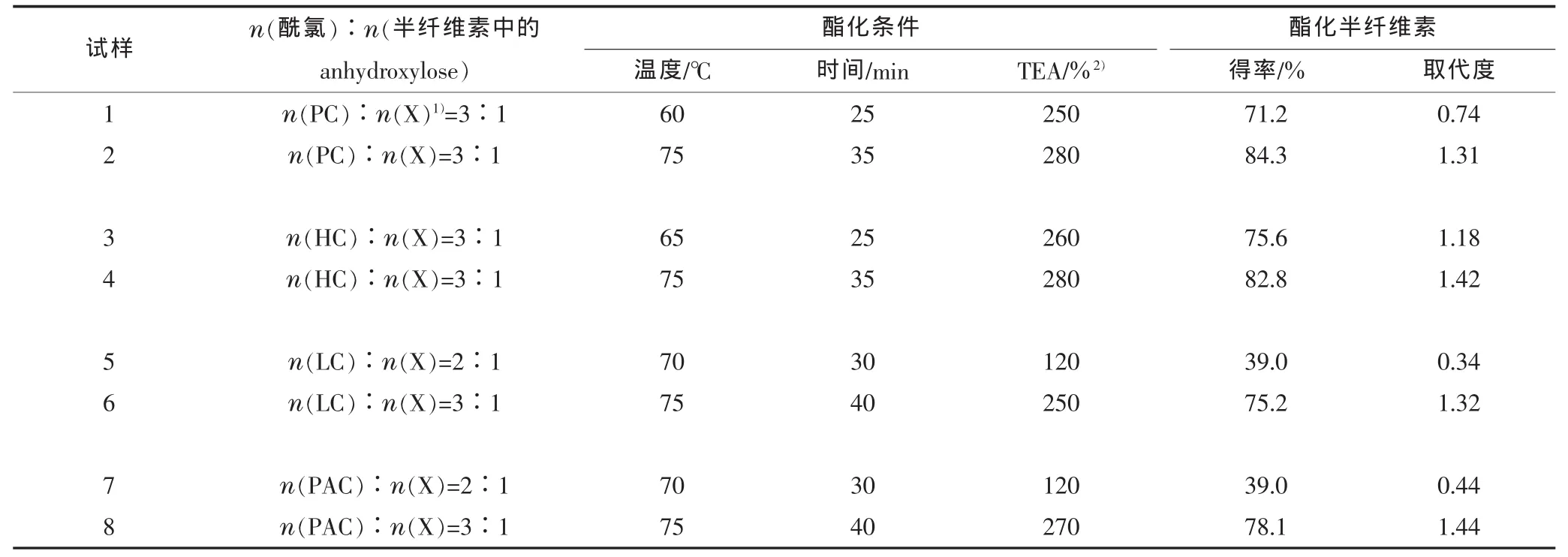
表5 酯化半纤维素的得率和取代度
在没有特意优化反应条件下(反应摩尔比、TEA浓度、温度、时间),就能得到低、中、高的取代度。在酯化反应中没有副反应产物产生,因此,几乎不需要怎么进行提纯。另外,因为在分离产物中几乎没有未发生反应的酰氯(即酰氯基本上全部反应),所以半纤维素衍生物的取代度由酯化半纤维素的百分得率决定(基于假设:每个木糖单元含有2个自由羟基)。
如表5所示,得率从 39.0%到 84.3%,取代度从0.34到1.44。当反应摩尔比最小,TEA浓度最低(120%),即试样 5,得到了最低的得率(39.0%)和取代度(0.34)。这说明:高取代度的反应不会发生,或者说只能得到少量的酯化半纤维素。显然,酰氯/羟基(anhydroxylose)摩尔比的增加、TEA浓度的增加、反应温度的提高和时间的延长都会引起得率和取代度的增加。
摩尔比从 2∶1(试样 5和试样 7)~3∶1(试样6和试样8),反应温度从70℃到75℃,反应时间从30 min到40 min,TEA从120%变化至250%或270%,都会导致酯化半纤维素得率的增加(39.0%到 75.2%或 78.1%)、取代度的增加(从 0.34到 1.32或从 0.44到 1.44)。 试样 1和 2、3和 4也显示了同样的变化。
得率随酰氯浓度增加而增加的原因可以解释为:在高浓度的酯化剂存在情况下,酰氯分子更容易接近半纤维素分子。这可能是半纤维素的羟基是固定的,因此其反应主要依靠于羟基周围的酰氯分子的存在量。延长反应时间有助于酯化的增强,这是因为时间会影响反应试剂在半纤维素上的扩散和吸收。
试样8的高取代度(1.44)意味着原半纤维素中超过70%的羟基被十六酰化(在给定反应条件下)。为获得完全的取代,有必要增加每摩尔自由OH基所对应的酰氯摩尔数、延长反应时间和增加TEA浓度。
可能的反应机理:亲核试剂,例如DMAP攻击酰基的碳中心,并脱除HCl。TEA,作为一种酸接受体(acid acceptor),效率比吡啶更加显著。 盐酸(HCl)是半纤维素酯化产生的一种副产物,它是一种强酸,影响反应的pH,引起产物更大范围的降解。但是,TEA的加入能与强酸反应,生成铵盐,使反应系统的pH稳定在5.5~6.5之间。
在 dipolar-aprotic溶剂中(例如 DMF/LiCl)悬浮的半纤维素的处理能够使聚合物成为膨胀性良好的凝胶悬浮液,并能活化聚合物(此处的聚合物为半纤维素)。DMF/LiCl作为半纤维素衍生物均相系统的另一个显著优点是能够引起(支配)一系列的有机反应,在温和条件下产生高取代度。另外,DMF/LiCl作为酯化半纤维素的溶剂,不但能保证高取代度,而且能保证更加均匀的取代反应的发生,因为此反应试剂具有更大的可亲性(易接近性)。
3.6 酯化半纤维素的FT-IR光谱
图6为十六酯化半纤维素、丙酰化半纤维素和己酰化半纤维素的FT-IR光谱图。

图6 十六酯化半纤维素、丙酰化半纤维素和己酰化半纤维素的FT-IR光谱图
由图6所示:

光谱中3 400 cm-1处的OH基吸收的降低可以说明酯化反应的发生程度与谱a、b、c相对应。光谱a中1 800 cm-1处峰缺失,光谱b、c中也没有此峰,1 700 cm-1处没有羰基的吸收,这些都说明产物是未反应的酰氯,以及酰酸(副产品)[21]。
3.7 酯化半纤维素的相对分子质量
表6 是酯化半纤维素重均相对分子质量、数均相对分子质量、多分散性。理论相对分子质量基于开始时半纤维素 (20℃下用8.5%NaOH溶液处理16 h)的相对分子质量(Mw平均为 39 250 g/mol)。
表6 数据表明,8种酯化半纤维素的相对分子质量比计算值少了10%。结果表明:在均相溶液DMF/LiCl中,75℃下反应40 min,聚合物只有非常少量的降解。

表6 酯化半纤维素的重均相对分子质量、数均相对分子质量、多分散性
3.8 酯化半纤维素的溶解性
每个木糖单元带有1~2个羰基,含这种木糖单元的天然半纤维素是亲水性的。半纤维素分子结构中憎水性酰基的引入会改变其溶解性能,并与取代度有关[22]。目前的结果表明:所有的酯化半纤维素都能溶于80℃下的吡啶,40℃的二甲基亚砜(DMSO),室温下部分溶于氯仿(三氯甲烷),二氯甲烷,甲苯,四氢呋喃(THF)。酯化半纤维素的亲油性有利于其在生物降解/环保型塑料中的应用,目前这方面的工作正在进展之中。
4 小结
分别用质量分数为1.5%、3.0%、5.0%、7.5%和8.5%的NaOH溶液在20℃下处理脱蜡及部分脱木素后的速生杨16 h,分别能够得到65.6%、71.6%、73.8%、85.6%和89.3%的原半纤维素,这些半纤维素的相对分子质量在38 830~42 230 g/mol之间。
木糖是半纤维素试样中最主要的糖组分,另外含有少量的甘露糖和葡萄糖,以及极少量的鼠李糖、阿拉伯糖和半乳糖。这说明速生杨木细胞壁中半纤维素主要是木聚糖,并含有少量的葡甘露聚糖。进一步的13C NMR分析表明:半纤维素含有1条由D-吡喃木糖基通过β-1,4键结合在一起的主链。
将质量分数为8.5%的NaOH溶液、20℃下抽提16 h得到的半纤维素在均相DMF/LiCl系统中酯化,这是一种合适的、快速的和有效的半纤维素的酯化方法。
取代度可以由酰氯/水解羟基单元(anhydroxylose)的摩尔比、TEA的用量、反应时间和反应温度来控制。例如:试样8在下述反应条件下,摩尔比为3∶1、270%TEA、75℃和40 min时,能得到取代度为1.44的酯化半纤维素,并且没有伴随着原半纤维素的降解,原半纤维素中超过70%的羟基被十六酰化。
[1] Blakeney A B,Harris P J,Henry R J,et al.A simple and rapid preparation of alditol acetates for monosaccharide analysis[J].Carbohydrate Research,1983,113(2):291-299.
[2] Ebringerova A,Hromadkova Z,Alfoldi J,et al.Structural and solution properties of corn cob heteroxylans[J].Carbohydrate Polymers,1992,19(1):99-105.
[3] Gupta S,Madan R N,Bansal M C.Chemical composition of pinus caribaea hemicellulose[J].TAPPI Journal,1987,70(6):113-114.
[4] Imamura T,Watanabe T,Kuwahara M,et al.Ester linkages between lignin and glucuronic acid in lignin-carbohydrate complexes from fagus crenata[J].Phytochemistry,1994,37(9):1165-1173.
[5] Kacurakova M,Ebringerova A,Hirsch J,et al.Infrared study of arabinoxylans[J].Journal of Science,Food and Agriculture,1994,66(12):423-427.
[6] Kacurakova M,Belton P S,Wilson R H,et al.Hydration properties of xylan-type structures:an FT-IR study of xylooligosaccharides[J].Journal of Science,Food and Agriculture,1998,77(12):38-44.
[7] Kato A,Azuma J,Koshijima T.Isolation and identification of a new ferulated tetrasaccharide from bagasse lignin-carbohydrate complex containing phenolic acid[J].Agricultural and Biological Chemistry,1987,51(12):1691-1693.
[8] Khalil M I,Hashem A,Hebeish A.Preparation and characterization of starch acetate[J].Starch/Starke, 1995,47(10):394-398.
[9] Kim Y S,Iiyama K,Kurahashi A,et al.Structural feature of lignin in cell walls of normal and fast-growing poplar(Populus maximowiczii Henry)[J].Mokuzai Gakkaishi,1995,41(1):837-843.
[10] Kim Y S,Kurahashi A,Meshitsuka G.Characteristics of the chemicalstructure of lignin in fast-growing poplar(Populus maximowiczii Henry)[J].Mokuzai Gakkaishi,1996,42(8):782-788.
[11] Lawther J M,Sun R C,Banks W B.Extraction,fractionation,and characterization of structural polysaccharides from wheat traw[J].Journal of Agricultural and Food Chemistry,1995,43(8):667-675.
[12] Lepeniotis S,Feuer B I.Synthesis of starch acetate:statistical designed experiments to optimize the reaction conditions[J].Chemometrics and Intelligent Laboratory Systems,1997,36(2):229-243.
[13] McCormick C L,Callais P A.Derivatization of cellulose in lithium chloride and N,N-dimethylacetamide solutions[J].Polymer,1987,28(14):2317-2323.
[14] Patel R R,Angadiyavar C S,Srinivasa Y.Nonwood fibre plants for paper making[J].A Review Nonwood Plant Fibre Pulping,1985,15(3):77-90.
[15] Puls J,Schuseil J.Chemistry of hemicelluloses:relationship between hemicellulose structure and enzymes required for hydrolysis[M].In M P Coughlan&G P Hazlewood,Hemicelluloses and hemicellulases.London:Portland Press,1993:4-5.
[16] Rahn K,Diamantoglou M,Klemm D,et al.Homogeneous synthesis of cellulose p-toluenesulfonates in N,N-dimethylacetamide/LiCl solventsystem[J].DieAngewandleMakromolekulare Chemie,1996,238(6):143-163.
[17] Saikia C N,Ali F,Goswami T,et al.Esterification of high a-cellulose extracted from Hibiscus cannabinus L[J].Industrial Crops and Products,1995,4(1):233-239.
[18] Scalbert A,Monties B,Guittet E,et al.Comparison of wheat straw lignin preparations[J].Chemical and Spectroscopic Characterisations Holzforschung,1986,40(2):119-129.
[19] Sun R C,Lawther J M,Banks W B.Influence of alkaline pre-treatment on the cell wall components of wheat straw[J].Industrial Crops and Products,1995,4(1):127-145.
[20] Sun R C,Lawther J M,Banks W B.Fractional and structural characterization of wheat straw hemicelluloses[J].Carbohydrate Polymers,1996,29(4):325-331.
[21] Sun R C,Fang J M,Goodwin A,et al.Isolation and characterization of polysaccharides from abaca fibre[J].Jorunal of Agricultural and Food Chemistry,1998,46(7):2817-2822.
[22] Williamson S L,Armentrout R S,Porter R S,et al.Microstructural examinationofsemi-interpenetratingnetworksofpoly(N,N-dimethylacrylamide) with cellulose or chitin synthesized in lithium chloride/N,N-dimethylacetamide[J].Macromolecules,1998,31(19):8134-8141.
Fractional Isolation,Physico-chemical Characterization and Homogeneous Esterification of Hemicelluloses from Fast-growing Poplar Wood
CUI Hong-yan1,LIU Yu1,YANG Gui-hua1,CHEN Jia-chuan1,R C Sun2,J M Fang2,J Tomkinson2,Z C Geng3,J C Liu3
(1.Key Laboratory of Paper Science and Technology of Ministry of Education,Shandong Institute of Light Industry,Ji’nan 250353,China;2.The BioComposites Centre,University of Wales,Bangor,Gwynedd,LL 57 2UW,UK;3.The North-Western University of Agricultural and Forest Science and Technology,Yangling 712100,China)
Dewaxed and partially delignified fast-growing poplar wood samples were extracted with 1.5%, 3.0%, 5.0%,7.5%and 8.5%NaOH at 20℃ for 16 h,consequently,65.6%,71.6%,73.8%,85.6%and 89.3%of the original hemicelluloses were found to be solubilized respectively.Xylans were found to be the predominant hemicellulosic components in the cell walls of fast-growing poplar wood.The isolated five hemicellulosic preparations were further characterized by Fourier transform infrared(FT-IR),carbon-13 magnetic resonance spectroscopy(13CNMR) as well as gel permeation chromatography(GPC).The results showed that the hemicelluloses contain a main chain formed by d-xylopyranose residues linked byβ-1,4 linkages.The hemicellulosic preparation, isolated with 8.5%NaOH at 20 ℃for 16 h, was esterified with propionyl, hexanoyl, lauroyl, and palmitoyl chlorides, respectively, in homogeneous N,N-dimethylformamide/lithium chloride system using 4-dimethylaminopyridine as a catalyst and triethylamine as a neutralizer.The effects of molar ratio of acyl chloride/anhydroxylose unit, triethylamine concentration, and reaction time and temperature on the yield and degree of substitution of the hemicellulose derivatives have been primarily examined.The degree of substitution was controlled between 0.44 and 1.44 under the reaction conditions given.Under an optimum condition(sample 8,molar ratio 3∶1), over 70%of the total hydroxyl groups in native hemicelluloses were palmitoylated at 75 ℃ for 40 min.The results obtained from the molecular weight measurements(48 000~127 200 g/mol) revealed only a minimal degradation of the macromolecular hemicelluloses during the rapid reactions at 60~75℃for 25~40 min.
hemicelluloses; fractional isolation; esterification; characterization
TS721+.1
A
1007-2225(2011)06-0012-08
2011-10-10(修回)
崔红艳女士(1985-),制浆造纸专业在读研究生;研究方向:纸浆造纸绿色化学与生物质资源化利用;E-mail:chy4618@163.com。
本文文献格式:崔红艳,刘玉,杨桂花,等.速生杨半纤维素的分级分离、物化特性以及均相酯化[J].造纸化学品,2011,23(6)∶12-19.

