吗啡对猕猴瞳孔光反应能力的影响
孟志强,张玉华,陈南晖,缪应达,胡新天,2,*,马原野,2,*
(1. 中国科学院昆明动物研究所 脑与认知科学国家重点实验室,云南 昆明 650223;2. 中国科学院生物物理研究所 脑与认知科学国家重点实验室,北京 100101;3. 中国科学院研究生院,北京 100049;4. 中国人民银行云南省分行 科技处,云南 昆明 650223)
吗啡对猕猴瞳孔光反应能力的影响
孟志强1,3,张玉华1,陈南晖1,缪应达4,胡新天1,2,*,马原野1,2,*
(1.中国科学院昆明动物研究所 脑与认知科学国家重点实验室,云南 昆明650223;2.中国科学院生物物理研究所 脑与认知科学国家重点实验室,北京100101;3.中国科学院研究生院,北京100049;4.中国人民银行云南省分行 科技处,云南 昆明650223)
光照能明显改变正常人和动物瞳孔的大小,而精神疾病及药物滥用则影响人和动物瞳孔对光的反应性。因此,瞳孔对光反应异常可以用作检测精神疾病和药物滥用的指标。有关药物滥用是如何影响瞳孔对光的反应性的研究还很少。为定量地测量成瘾性药物对瞳孔光反应变化的影响,该文采用猕猴为实验对象,通过在黑暗环境中测量猕猴在吗啡给予前和吗啡给予后的不同时间段,其瞳孔直径大小以及其对光反应能力的变化情况,来系统研究吗啡是如何影响这种非自主性反射系统的。研究发现,吗啡给予降低了猕猴在黑暗环境中的扩瞳反应,并且降低了瞳孔对光反应的收缩率。该文为将瞳孔对光反应特征用作鉴定吸毒者的检测手段提供了实验依据。
猕猴;吗啡;瞳孔直径;瞳孔对光反应
瞳孔是一个在基础神经科学和临床研究当中都很重要的研究对象。由于瞳孔无适应性且不受意识控制,能准确地反映出大脑的精神活动,因而利用瞳孔的光反应特征来研究人类大脑及相关疾病有很多优势,更具有可操作性和可行性。通过检测瞳孔对光反应特征来研究大脑活动的神经基础及相关精神疾病已经有很多报道(Nagai et al, 2002;Fountoulakis et al, 1999;Steinhauer & Friedman, 1995;Kim et al, 1998)。研究发现,早老痴呆患者(Alzheimer’s disease, AD)瞳孔对光反应所需时间较长,而且收缩力度较小(Shi et al, 1998);抑郁症患者瞳孔对光反应的收缩潜伏期比正常人更短(Fountoulakis et al, 1999)。托品酰胺(tropicamide)滴眼剂处理瞳孔之后发现,在相同的光照条件下,正常人瞳孔的直径会变大;而AD和帕金森氏症(Parkinson’s disease,PD)患者瞳孔的最大收缩幅度变小(Granholm et al, 2003)。Steinhauer & Friedman(1995)研究过精神分裂症患者的瞳孔反应特征,试图通过测定瞳孔的光反射特征来及早提示疾病的发生。因此,瞳孔反应特征已经越来越多的被用来研究大脑的功能及相关精神疾病特征(Wang et al, 2005)。
瞳孔光反应特征也被应用于药物滥用的研究。现已知道,大量使用阿片类药物会使瞳孔直径明显变小,即医学上称之为“针样瞳孔”。这方面的证据主要来自对过量使用阿片类药物导致中毒患者的临床观察,而对于药物使用前以及非过量使用后的瞳孔变化情况未做过研究。可是,在志愿者中用药后的瞳孔变化情况也有一些研究,如发现使用吗啡后会导致瞳孔缩小,但是对志愿者的年龄、用药历史、精神疾病情况等很难进行匹配,而且不能研究多次重复给药后瞳孔变化的情况(Knaggs et al, 2004)。因此,系统性地研究阿片类药物对瞳孔的影响成为一个待解决的重要问题。
Gamlin et al (1998)研究表明,猕猴瞳孔对光栅、颜色、光通量等都有明显的反应,其对光反应的特征与人很相似。因此,在本研究中,为了更加详细地了解阿片类药物对瞳孔大小变化的影响,我们采用猕猴作为实验对象,对吗啡如何影响瞳孔的直径及其对光反应能力的变化做了系统研究,为今后用瞳孔变化作为阿片类药物使用的检测指标提供一定的参考依据。
1 材料和方法
1.1 实验动物
本实验采用了3只健康成年猕猴(Macaca mulatta),其年龄为6—7岁,体重在6—8 kg,购自中国科学院灵长类研究中心动物中心,饲养于中国科学院昆明动物研究所实验动物中心,单笼饲养。光照时间7:00 am—7:00 pm,室内温度为(25 ±1)℃。所有实验操作符合NIH动物实验管理条例。
1.2 药 物
实验中使用的药品为东北制药集团公司沈阳第一制药厂生产的盐酸吗啡注射液(10 mg/mL),产品批号:080602-1。用药剂量为1—10 mg/kg体重。给药方式为肌肉注射。
1.3 实验装置
1.3.1 猕猴的固定装置 进行实验时,把猕猴安置在用PE材料制作的专用猕猴椅上,然后将猕猴椅推到做实验的房间内,并固定在实验台上,以避免动物挣扎时椅子位置移动。在椅子背后配有固定头部的装置,可以将猕猴头部固定起来,以防止实验过程中猴子的头部乱动。
1.3.2 光刺激器 它主要有两部分组成:刺激控制软件和刺激光源。刺激控制软件可以设置刺激程序中的各个参数,如刺激前时间、刺激持续时间、刺激间隔时间、刺激次数以及刺激形式(正弦波形式或方波形式)等,以及整个刺激程序的开启和关闭;刺激光源主要由一个正方形矩阵排列的发光二极管(8×8)组成,刺激光源面积大约为15 cm2。我们在实验中一律采用红光作为刺激光,光强度定为30 lx。光刺激器置于猕猴一只眼睛正前方5 cm处。
1.3.3 图像捕获装置 采用高分辨率数码红外摄像头作为瞳孔图像捕获装置,摄像头置于猕猴另一只眼睛正前方5 cm处,通过刺激控制软件来控制摄像头的启动时间、持续图像采集时间,以及多次图像采集的间隔时间。直接将采集的视频文件存入电脑,以备接下来进行图像分析。
1.3.4 猕猴瞳孔和虹膜直径测量方法 当瞳孔图像采集下来之后,我们通过软件来读取和测量不同时间点下瞳孔的直径,并将结果存入电脑进行分析。为了使每次测试的结果具有可比性,我们同时测量了大小相对比较固定的虹膜直径,用瞳孔直径与虹膜直径的比值(瞳孔虹膜比)作为判断瞳孔大小的依据(图1)。
1.4 实验流程
为让猕猴适应整个实验环境和实验流程,在正式实验开始之前,需先进行训练。每只动物的习性不同,其训练时间也有差异,但需要4—6周。在此期间,每天把猕猴带到猕猴椅上,然后推入实验房,将其头部固定在猕猴椅上后,把灯关闭,保持室内全黑环境15 min左右,其后开灯,给些水果和花生作为奖励;再把灯关掉30 min,再给食物奖励,使猕猴消除对实验环境的紧张和应激。每天训练和实验结束后,记录猕猴体重情况,以了解并保持其身体健康。
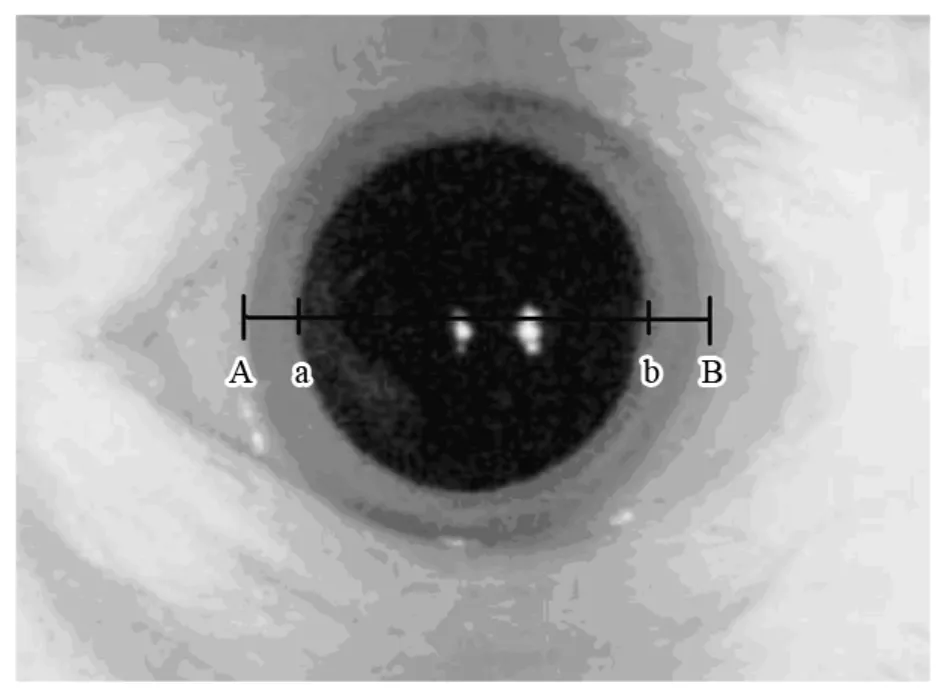
图 1 示静息状态下猕猴瞳孔和虹膜直径Fig. 1 The pupil and iris size of a rhesus monkey in rest
正式实验分为两个时期:给药前测试期(3 d)和给药期(10 d)。
在给药前测试期,每天将猕猴带到猕猴椅上,固定其头部,暗适应15 min。然后肌肉注射生理盐水1 mL,分别在注射生理盐水后5 min、2h、24h记录瞳孔大小。首先测量全黑条件下瞳孔和虹膜的直径,然后测量在全黑条件下光刺激对瞳孔和虹膜的直径。
给药期的实验步骤与给药前期相同,在暗适应15 min后给动物注射吗啡,给药5 min后开始测量全黑条件以及给光条件下瞳孔和虹膜直径。为研究吗啡对瞳孔直径及对光反应能力影响的时间效应,我们分别记录了在给予吗啡5 min、2 h、24 h后在黑暗环境以及给光条件下瞳孔和虹膜直径的变化情况。给药方式为均为肌肉注射,递增式给药,每天给药1次,剂量分别为第一天:1 mg/kg;第二天:2 mg/kg;第三天:4 mg/kg;第四天:8 mg/kg;第五天至第十天:10 mg/kg。
本实验采用自身对照,通过比较对照给药前和给药期间不同时间点的瞳孔大小变化情况来说明吗啡给予对瞳孔对光反应功能的影响。
1.5 数据处理
在实验结束后,将采集到的瞳孔对光反应的视频进行离线分析,通过图像处理软件来读取瞳孔直径的数值。其中瞳孔大小用瞳孔直径与虹膜直径的比值来判断,瞳孔对光反应的收缩率用瞳孔收缩到最小的直径与黑暗条件下瞳孔的最大直径的比值来表示。 因所有数据均来自同一个体的重复测试,故数据分析均采用重复方差检验(repeated ANOVA),分析软件采用SPSS130软件包,P<005作为显著性差异的判定标准。
2 结 果
2.1 在黑暗环境中给予吗啡后猕猴瞳孔虹膜比的变化
猕猴在黑暗环境中,安静状态下,被肌肉注射生理盐水后5 min、2 h以及24 h,其瞳孔虹膜比没有变化,因此取注射生理盐水后各时间点的数据平均值作为给药前数据;而在黑暗环境中给予吗啡后的各不同时间点,猕猴瞳孔的直径有显著的不同(F(2,70)=16574,P<0001,repeated ANOVA)。与肌肉注射生理盐水相比,在吗啡给予初期(前4 d),即剂量比较低的情况下,吗啡给予对在黑暗环境下的猕猴瞳孔虹膜比无明显影响,表明对猕猴瞳孔大小无明显影响;但从第五天开始,在给吗啡5 min以及2 h后,猕猴瞳孔虹膜比均明显降低,给予吗啡2 h后猕猴的瞳孔虹膜比最小,24 h后恢复(图2)。表明在黑暗环境下,持续给予吗啡明显降低瞳孔在黑暗环境中的扩大程度。
2.2 在黑暗环境中给予吗啡后光刺激对猕猴瞳孔虹膜比的影响
为进一步探讨给光刺激条件下,瞳孔对光反应能力的变化情况,我们比较了在黑暗环境中给予生理盐水后和给予吗啡后,不同时间点瞳孔对光刺激的收缩率(收缩的最小瞳孔直径/黑暗条件下瞳孔最大直径)变化。在吗啡给予后不同时间点给光刺激,猕猴瞳孔收缩率显著不同(F(2,70)=11341,P<0001,repeated ANOVA)。与给生理盐水相比较,在吗啡给予5 min后以及24 min后给光刺激,猕猴瞳孔的收缩幅度有降低的趋势。其中给予吗啡5 min后给光刺激,猕猴的瞳孔收缩幅度在第6—8 d明显降低;给予吗啡2 h后给光刺激,猕猴的瞳孔收缩幅度也有明显降低趋势;给予吗啡24 h后给光刺激,猕猴的瞳孔收缩幅度变化不明显,只在第三天达到显著性(图3)。在比较了给予吗啡后不同时间点的瞳孔收缩率之后发现,在第四、第五、第九、第十天给予吗啡后2 h给光刺激,猕猴的瞳孔收缩能力明显降低。
因光照可使瞳孔收缩,该结果表明吗啡降低了瞳孔对光的缩瞳反应。 两项实验结果表明,吗啡降低瞳孔对光的反应性。
3 讨 论
3.1 吗啡对瞳孔光反应能力的急性作用
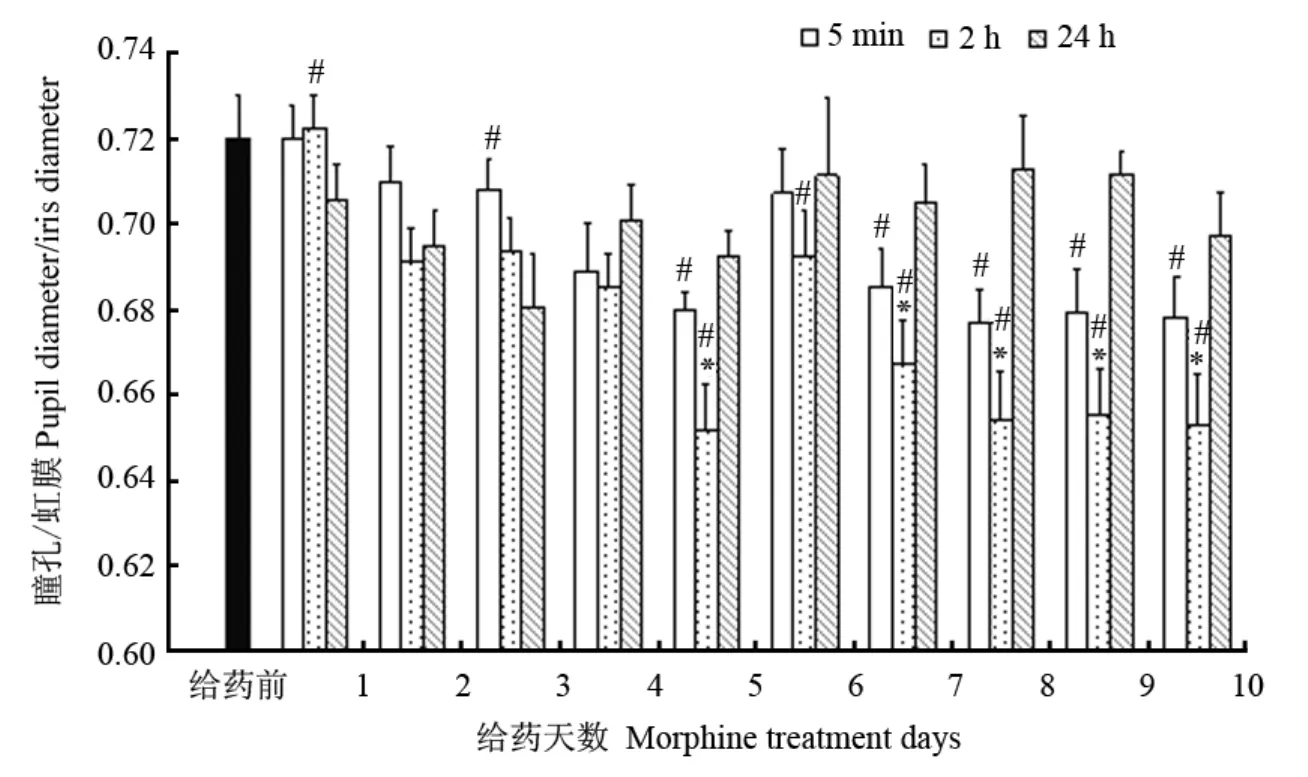
图 2 在黑暗环境下持续给予吗啡后猕猴瞳孔虹膜比值变化Fig. 2 Pupil size difference at different time points during morphine treatment in darkness
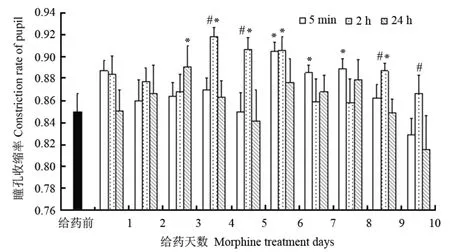
图 3 吗啡给予对猕猴瞳孔对光反应能力的影响Fig. 3 The effects of morphine on pupillary light reflex
通过测量吗啡给予前以及吗啡给予期间不同时间点猕猴瞳孔直径大小以及对光反应能力的变化情况,其结果表明了吗啡的急性作用会导致瞳孔的光反应能力变弱,吗啡影响猕猴在黑暗环境下的扩瞳反应。而这种对瞳孔光反应功能的作用在给药2 h左右的作用非常明显,在24 h后急性作用基本消失。我们的结果与前人做的结果一致,表明了吗啡对扩瞳作用的机制作用(Knaggs et al, 2004)。与前人研究不同的是,我们的实验均是在全黑的环境下进行的,这样就避免了外界其他光线的干扰;同时,由于环境相对密闭和安静,避免了情绪和精神活动的干扰。在瞳孔对光反应的收缩率方面,我们的结果表明,在吗啡给予后瞳孔的收缩幅度开始呈现出下降的趋势,瞳孔的对光收缩率显著降低,表现为瞳孔的最大收缩幅度变小,这种收缩率的降低现象在24 h后逐渐恢复。两项实验结果表明,吗啡降低了瞳孔对光的反应功能。
3.2 吗啡对瞳孔光反应能力的慢性作用
在吗啡的慢性作用方面,我们发现随着吗啡给予次数及剂量的增加,吗啡的缩瞳作用也越来越大,尤其是在第七至第十天,给予吗啡2 h后的瞳孔直径显著缩小。并且在长期给予吗啡后,吗啡的缩瞳作用表现得更为明显,在吗啡给予的后第四天,给予吗啡5 min后就产生比较明显的缩瞳作用。在瞳孔对光反应的收缩率方面,第四、第五、第九、第十天给予吗啡后2 h的瞳孔收缩能力明显降低,说明吗啡对瞳孔收缩能力的影响可能有一定的积累效应。尽管我们的结果表明吗啡改变了猕猴瞳孔的对光反应特性,但其内在神经机制还有待进一步深入研究。
3.3 实验中可能存在的问题
在实验中我们没有发现吗啡给予会对其瞳孔收缩潜伏期和收缩速率有影响,可能是由于我们的视频采集设备时间精确率不够(15帧/s);同时,由于我们光刺激装置面积不够大,虽然猕猴头部是被固定住的,但是眼球运动对实验结果还是会有一定的影响,这些都是以后需要改进之处。在本实验中,我们采用递增的给药方式,因此,实验所得到的结果可能是由于下列一种或多种因素所导致:吗啡的急性作用、累积效应以及吗啡剂量的累积增加,这在以后的研究中应尽量避免这些因素同时出现。
3.4 实验的应用价值及展望
我们采用猕猴作为研究对象,初步探讨了在吗啡使用过程中,瞳孔直径大小及对光反应能力的变化这个问题。我们通过测量在完全黑暗条件以及给光条件下的瞳孔大小及对光反应能力变化情况,发现了吗啡对瞳孔影响的一些特征。对于今后研发利用瞳孔对光反应的动态特征来检测阿片类药物的使用提供了可能。目前的阿片类药物滥用监测手段主要是采用胶体金法测定尿样中的相关物质含量,配合毛细管电泳技术和液相色谱技术,这些方法需要的检测时间相对较长,不利于快速检测和取证(Deng et al, 2002)。如果能通过判定瞳孔对光反应特征来确定药物滥用与否,将会是一种快捷方便准确的方法(Richman et al, 2004)。因此,我们的结果为今后研发及应用此技术提供了参考依据。
由于每种成瘾性物质可能会有不同的生理作用。因此,在今后的工作中,我们还会继续探讨其他药物,如可卡因、冰毒等对瞳孔大小变化的影响。另外,由于很多其他精神疾病以及机体损伤也会对瞳孔对光反射功能产生一定影响(Barbur et al, 2004;Bergamin et al, 2003;Granholm et al, 2003),因此,在实际应用中如何鉴定不同疾病或不同药物对瞳孔对光反应功能影响的特点将是进一步研究的目标。
Barbur JL, Moro S, Harlow JA, Lam BL, Liu M. 2004. Comparison of pupil responses to luminance and colour in severe optic neuritis [J]. Clin Neurophysiol,115: 2650-2658.
Bergamin O, Zimmerman MB, Kardon RH. 2003. Pupil light reflex in normal and diseased eyes: Diagnosis of visual dysfunction using waveform partitioning [J]. Ophthalmology,110: 106-114.
Deng YP, Sun GK, Wei W, Lu XX. 2002. Determination of abused drugs in urine samples[J].Chn J Drug Depend,11(2): 117-119 [邓艳萍,孙桂宽,魏 伟,吕宪祥. 2002.尿样中滥用药物的检测分析.中国药物依赖性杂志,11(2): 117-119.]
Fountoulakis K, Fotiou F, Iacovides A, Tsiptsios J, Goulas A, Tsolaki M, Ierodiakonou C. 1999. Changes in pupil reaction to light in melancholic patients [J]. Int J Psychophysiol,31: 121-128.
Gamlin PD, Zhang H, Harlow A, Barbur JL. 1998. Pupil responses to stimulus color, structure and light flux increments in the rhesus monkey [J]. Vision Res,38: 3353-3358.
Granholm E, Morris S, Galasko D, Shults C, Rogers E, Vukov B. 2003. Tropicamide effects on pupil size and pupillary light reflexes in Alzheimer's and Parkinson's disease [J]. Int J Psychophysiol,47: 95-115.
Kim M, Barrett AM, Heilman KM. 1998. Lateral asymmetries of pupillaryresponses [J]. Cortex,34: 753-762.
Knaggs RD, Crighton IM, Cobby TF, Fletcher AJ, Hobbs GJ.2004.The pupillary effects of intravenous morphine, codeine, and tramadol in volunteers [J]. Anesth Analg,99: 108-112.
Wang JK, Xu XF, Ma YY. 2005. Measurement of pupil reflex and psychiatric disorders [J]. J Int Psychiatry,3: 156-159. [王继堃,许秀峰,马原野. 2005.瞳孔的变化及测量与精神疾病的关系.国际精神病学杂志,3: 156-159.]
Nagai M, Wada M, Sunaga N. 2002. Trait anxiety affects the pupillary light reflex in college students [J]. Neurosci Lett,328: 68-70.
Richman JE, McAndrew KG, Decker D, Mullaney SC. 2004. An evaluation of pupil size standards used by police officers for detecting drug impairment [J]. Optometry,75: 175-182.
Shi XM, Uchiyama H, Fukumoto I. 1998. A study for objective measurement of the senile dementia by light reflex [J]. JJME Biomed Eng,12(9): 210-214.
Steinhauer SR, Friedman D. 1995. Cognitive Psychophysiological Indicators of Vulnerability in Relatives of Schizophrenics[M]// Miller, GA. High Risk Research in Psychopathology, New York: Springer, 158-180.
Effects of Morphine on Pupillary Light Reflex in Monkeys
MENG Zhi-Qiang1,3, ZHANG Yu-Hua1, CHEN Nan-Hui1, MIAO Ying-Da1, HU Xin-Tian1,2,*, MA Yuan-Ye1,2,*
(1. State Key Laboratory of Brain and Cognitive Science, Kunming Institute of Zoology, the Chinese Academy of Sciences, Kunming, 650223, China;
2. State Key Laboratory of Brain and Cognitive Science, Institute of Biophysics, the Chinese Academy of Sciences, Beijing 100101, China;
3. Graduate University of the Chinese Academy of Sciences, Beijing 100049, China;
4. Department of Science and Technology, Yunnan Branch, People’s Bank of China, Kunming 650223, China)
The pupil size of both human and other animals can be affected by light. Many kinds of psychiatrical and psychological disorders, such as drug abuse, associate with abnormal properties of pupillary light reflex. Thus, the properties of pupillary light reflex could serve as an indicator for drug abuse detection. However, the effect of drug abuse on pupillary light reflex is till unclear. To assess the effects of addictive drugs on pupillary light reflex quantificationally, in the present study, we examined the effects of morphine on pupil diameter and pupillary light reflex in rhesus monkeys. By measuring the pupil diameter at different timing points before and after the administration of morphine, we found that morphine administration reduced the diameter of pupil and decreased the constriction rate. Our present results provide an experimental support for applying the properties of pupillary light reflex as a reference in addicts’ detection.
Monkey; Morphine; Pupil diameter; Pupillary light reflex
Q959.848;R339.145;R996;R595.4
A
0254-5853-(2010)03-0282-05
10.3724/SP.J.1141.2010.03282
2009-11-17;接受日期:2010-05-13
国家高技术研究发展计划(“863”项目)(O7013810, 2006AA02A116);国家自然科学基金(NSFC 30530270;30670669;30870825;30770700)
*通讯作者(
),Tel/Fax:0871-5193083, E-mail: MA Yuan-ye: yuanma0716@vipsinacom; HU Xin-tian: xthu@mailkizaccn

