KOH活化微孔活性炭对对硝基苯胺的吸附动力学
李坤权,郑 正,罗兴章,蒋剑春 (.复旦大学环境科学与工程系,上海 2004;2.南京农业大学工学院,江苏 南京 200;.中国林业科学研究院林产化学研究所,江苏 南京 20042)
KOH活化微孔活性炭对对硝基苯胺的吸附动力学
李坤权1,2,郑 正1*,罗兴章1,蒋剑春3(1.复旦大学环境科学与工程系,上海 200433;2.南京农业大学工学院,江苏 南京 210031;3.中国林业科学研究院林产化学研究所,江苏 南京 210042)
以互花米草为原料,经过碳化、KOH活化两步法制备了低成本、高比表面的微孔活性炭SAAC.通过静态实验研究了活性炭SAAC对水溶液中对硝基苯胺的吸附特性,并从动力学角度探讨了吸附机理.结果表明,微孔活性炭SAAC对对硝基苯胺吸附动力学数据符合准二级方程,吸附速率在前25min由内扩散控制,而后由膜扩散与内扩散共同控制.Freundlich方程能更好地描述对硝基苯胺在活性炭SAAC上的等温吸附行为;在15℃时,活性炭SAAC对对硝基苯胺的Langmuir最大吸附量为719mg/g.
KOH活化;对硝基苯胺;微孔活性炭;吸附机理
对硝基苯胺主要通过生产废水排放进入水环境, 污染地表水和地下水,对人类健康有较大的危害,能引起血液中毒、皮肤湿疹及皮炎等症,属我国水污染控制中的优先控制污染物[1-2].目前,对硝基苯胺废水治理的方法主要有萃取法、氧化还原法、生物法和吸附法[3-5],其中吸附法被认为最有效,因此不少学者把目光投向原料来源广泛、吸附能力强、再生性强以及无二次污染的植物基活性炭[6-8].
传统的活性炭制备原料为煤炭、木材及椰壳,这3种原料因来源有限或生长周期过长,生产出的活性炭成本较高[6].互花米草(Spartina alterniflora) 是我国沿海地区分布最广的盐沼植被,但作为外来入侵物种,2003年被列入我国首批16种入侵种黑名单.互花米草具有很高的生产力,每年干物质产率高达3 154g/m2[9],同时其秸秆内部呈海绵状,有许多竖直的通气孔,适合活性炭对比表面积、孔容及吸附能力的要求.
本研究以互花米草为原料,以 KOH为活化剂,制备了微孔发达、比表面巨大的高性能活性炭.测定了其对对硝基苯胺的吸附能力,研究了吸附动力学行为,并从动力学角度探讨了对硝基苯胺在活性炭上的吸附机理,为互花米草基活性炭吸附法处理对硝基苯胺生产废水的工程应用提供理论指导和技术支持.
1 材料与方法
1.1 试剂与仪器
高纯氮(99.999%)购于信息产业部南京第五十五研究所技术开发总公司,互花米草茎杆产地为江苏省海门市,KOH、盐酸均为分析纯,购于上海化学试剂有限公司.
主要仪器包括自动物理吸附仪(ASAP-2020,美国麦克公司),元素分析仪(德国Elementar Vario MICRO型),紫外分光光度计(英国 Unicam公司)、智能温控仪(AI-708P,厦门宇电自动化科技有限公司)、高温管式电阻炉(厦门宇电自动化科技有限公司)、酸度计(PHS-2C,上海康仪仪器有限公司)集热式磁力(DF-II型,金坛市金祥龙电子有限公司)等.
1.2 活性碳的制备及表征
1.2.1 活性炭的制备 将成熟的互花米草茎杆清洗、烘干后用粉碎机粉碎,过 20目筛,在50mL/min的氮气流保护下,以 50℃/min升至450
℃,恒温炭化 1h.按照 3:1(KOH:碳化料)的浸渍比,将样品浸渍在KOH溶液中12h,将上述浸渍后的碳化料混和物在 105℃下烘干,置于管式炉中,在50mL/min的氮气流保护下,以10℃/min升至活化温度800℃,并恒温活化1.5h.将上述活化后的样品浸泡于0.1mol/L的盐酸中,在恒温振荡器中振荡12h以上,再用热的蒸馏水清洗到pH值为7.0,烘干即得活性炭,记作SAAC.
1.2.2 吸附剂的物化性质表征 样品的孔结构与孔径分布利用美国麦克公司ASAP-2020自动物理吸附仪测定,采用BET方程计算活性炭总比表面,Horvath-Kawazoe(H-K)方程、Dubinin-Astakhov (D-A)方程计算活性炭微孔孔容.用德国Elementar Vario MICRO型元素分析仪测定活性炭中C、H、N、O等元素的含量.
1.3 活性炭SAAC对对硝基苯胺的吸附实验
1.3.1 等温线的测定 分别称取不同质量的活性炭(0.010~0.100g),并投入容量为 250mL磨口锥形瓶,加入100mL浓度为200mg/L、pH值为7.6的对硝基苯胺溶液,分别在15,25,35℃下振荡48h至吸附平衡,然后使用定量滤纸快速过滤,利用英国 Unicam公司紫外分光光度计在 波长381nm处测定对硝基苯胺的平衡浓度,测定前用0.1mol/L的盐酸或氢氧化钠溶液将溶液调到pH8.0.
活性炭吸附对对硝基苯胺的平衡吸附量(qe)根据式(1)计算:

式中:C0和Ce分别为溶液中对硝基苯胺的初始浓度和吸附平衡浓度,mg/L;V为溶液体积,mL;W为活性炭的质量,g.
1.3.2 吸附动力学的测定 吸附动力学试验装置如图1所示,配有减少水汽蒸发的防蒸盖、容量为1000mL的锥形瓶,配制200 mg/L 对硝基苯胺溶液,取 500mL的上述溶液至锥形瓶中,采用0.1mol/L的NaOH和HCl调节溶液pH值至7.6,而后置于DF-II型集热式磁力加热搅拌器内,使溶液调节至实验温度.加入一定量的吸附剂后开始计时,在前10min内每2min取1次样,而后每30min取 1次样.在预定的时间点从取样孔处取出 1mL的溶液,溶液稀释后在离心器中以2000r/min转速分离出吸附剂,以准确测定溶液的浓度.

图1 动力学吸附实验装置示意Fig.1 Adsorption apparatus for kinetic experiment
2 结果与分析
2.1 活性炭SAAC的表征
互花米草基活性炭SAAC的BET比表面积、总孔孔容、微孔容积、平均孔径(Dp)、等电点pHPZC及其 C、H、N、O等元素的含量如表 1所示.从表1可见,KOH活化制备的互花米草基活性炭SAAC的总孔容积为1.374cm3/g,BET比表面积为2825m2/g,远大于工业用水处理活性炭一级标准(500 m2/g).此外,活性炭SAAC的微孔容积占其总孔孔容积的50%以上,且Dp<2nm,按照国际理论与应用化学协会(IUPAC)的分类标准,活性炭SAAC属于微孔炭.

表1 活性炭SAAC的主要表面结构特征Table 1 Main characteristics of activated carbon SAAC
2.2 时间对吸附的影响
在0.300g/L和0.500g/L吸附剂剂量下,活性炭 SAAC对对硝基苯胺的平衡吸附量分别为698.12mg/g和391.32mg/g.由图2可知,在2种不同吸附剂剂量下,对硝基苯胺在活性炭SAAC上的吸附随时间的变化呈现相似的趋势,并在60min内基本达到吸附平衡.总体上看,活性炭SAAC对对硝基苯胺的吸附随时间变化可以分为3个部分:在最初的25min内,吸附量随时间变化有较大的增加,并且在25min时吸附量已达到饱和吸附量的70%;在随后的35min内,吸附随时间变化缓慢增大,且吸附量增至饱和吸附量的90%以上;在吸附60min时,吸附基本达到饱和,吸附量随时间变化较小.
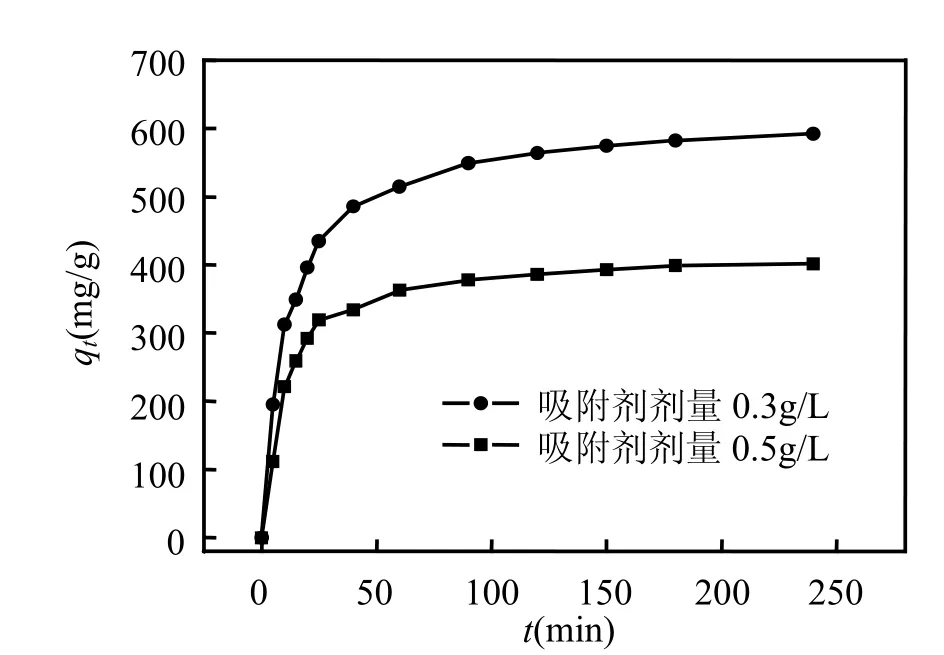
图2 时间对活性炭SAAC吸附硝基苯胺的影响Fig.2 Effect of contact time on the adsorption of p-nitroaniline onto activated carbon SAAC
2.3 吸附动力学的拟合
选择在0.300g/L和0.500g/L两种不同吸附剂量下,对对硝基苯胺在活性炭SAAC上的吸附动力学数据进行研究,并用准一级、假二级和Elovich 动力学方程对其进行拟合.
准一级吸附模型 采用Lagergren方程计算吸附速率[10]:
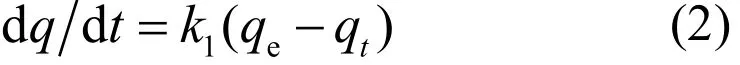
式中:qt和 qe分别为 t 时刻与平衡态时的吸附量,mg/g; k1为准一级吸附速率常数,min-1.对式(2)从t=0到t>0(q=0到q>0)进行积分,可以得到:

假二级吸附模型 建立在速率控制步骤是通过电子共享或得失的化学吸附基础上的假二级动力学方程表达式为[11]:
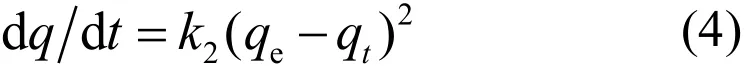
对式(4) 从t = 0 到t > 0 ( q = 0 到q > 0) 进行积分,可以得到:
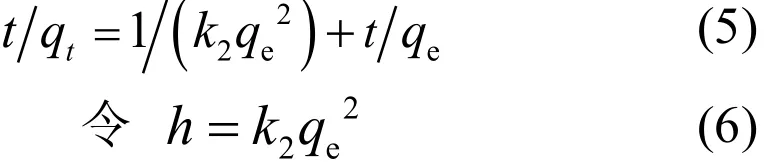
式中:h为初始吸附速率常数,mg/(g⋅min) .
Elovich 动力学方程是 20世纪 30年代由Elovich提出的[12],他认为,吸附速率随吸附剂表面吸附量的增加而成指数下降,其简化的数学表达式为:

式中:αE为初始吸附速率常数,mg/(g⋅min); βE为脱附速率常数,g/mg.
采用准一级、假二级和Elovich 3种动力学方程对活性炭SAAC吸附对硝基苯胺的动力学数据进行Origin非线性拟合,拟合结果如图3所示,拟合所得的各模型参数计算结果如表2所示.
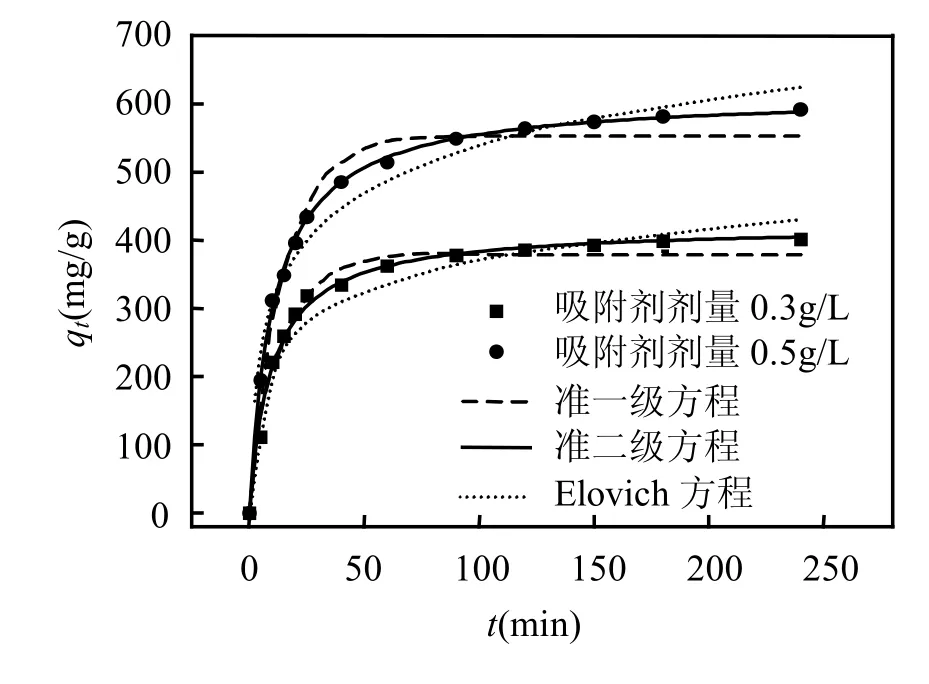
图3 活性炭SAAC对对硝基苯胺的吸附动力学曲线Fig.3 Different kinetic plots for the adsorption of p-nitroaniline onto activated carbon SAAC
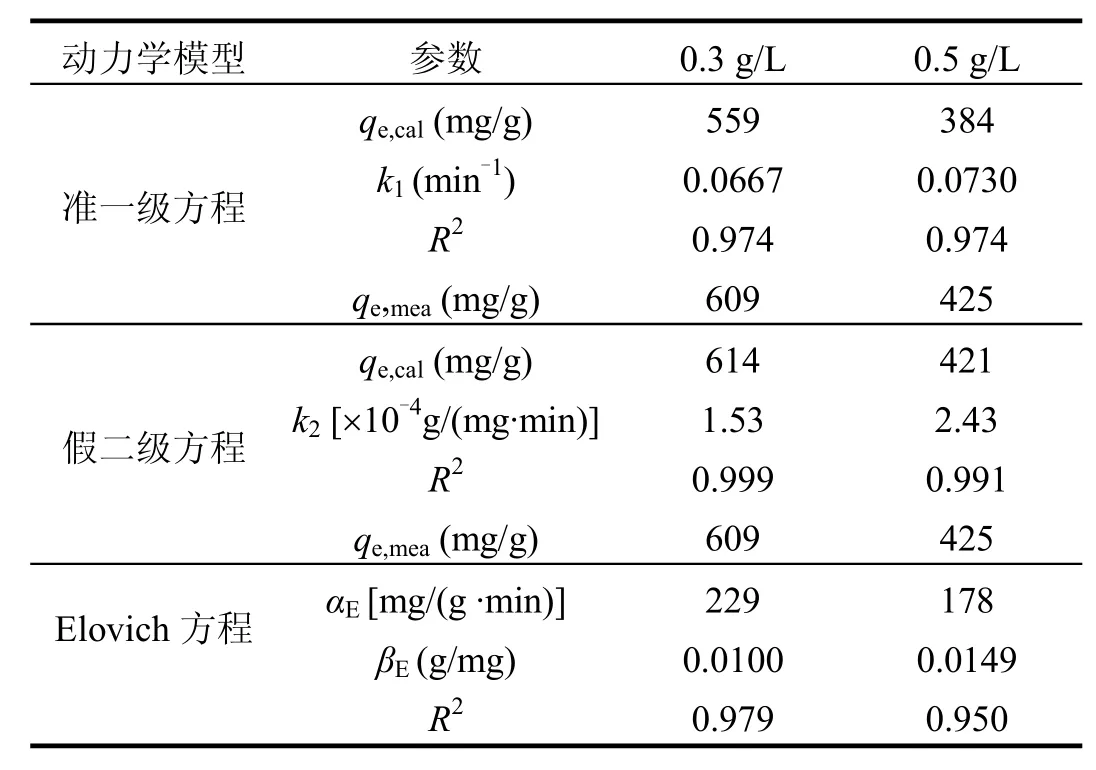
表2 活性炭SAAC吸附对硝基苯胺的动力学拟合参数Table 2 Parameters of three kinetic models for adsorption of p-nitroaniline onto SAAC
从图3可见,与准一级方程和Elovich方程相比,假二级动力学方程拟合曲线能更好地与数据点重合.由表2可见,利用origin曲线拟合所得的假二级动力学方程相关系数R均高于0.99,而且,从假二级方程计算得到的 qe,cal与实验得到的qe,exp非常接近.以上结果表明,假二级方程能更好地描述活性炭SAAC对对硝基苯胺的吸附动力学过程.而准一级方程拟合的相关系数相对较低,同时从准一级方程计算得到的 qe,cal与实验得到的 qe,exp相差较大,以上结果表明,准一级方程不能较好地描述对硝基苯胺在活性炭 SAAC上的吸附.这是因为准一级方程有其局限性,通常只适合对吸附初始阶段的动力学描述,而不能准确地描述吸附的全过程[13].假二级模型包含了吸附的所有过程,如外部液膜扩散、表面吸附和颗粒内扩散等[14],更真实全面地反映了对硝基苯胺在活性炭上的吸附过程.
2.4 活性炭 SAAC对对硝基苯胺的吸附速率控制
吸附质从液相被吸附到吸附剂颗粒中,需经历以下3个步骤:一是吸附质从水相主体通过吸附剂表面的一层假想的流体介膜扩散至颗粒外表面,即膜扩散阶段;二是吸附质从颗粒外表面进入颗粒内孔中向颗粒内表面扩散,即内扩散阶段;三是吸附反应阶段.吸附过程的总速率取决于上述过程最慢的阶段.一般而言,上述最后一步的吸附反应速度很快,迅速在微孔表面各点上建立吸附平衡,因此,总的吸附速率由膜扩散、内扩散或由两者共同控制.为确定对硝基苯胺在活性炭上的吸附速率控制步骤,采用粒子内扩散模型方程对活性炭SAAC吸附对硝基苯胺的动力学数据进行分析.
Weber-Morris颗粒内扩散方程[15]

式中:Kw内扩散速率常数 mg/(g⋅min0.5);t为吸附时间.截距b则反映了边界层效应.通过以qt对t0.5作图,直线部分的斜率即为内扩散速率常数Kw.Weber 和 Morris认为,如果吸附量 qt与 t0.5呈线性关系并通过原点,则表明吸附由内扩散控制.若不通过原点,截距b越大,膜扩散在速率控制步骤中的影响也越大[15].
Dumwald-Wagner颗粒内扩散方程[16]

式中:F为吸附分离系数,可由式(10)计算得到.

式中:qt和 qe分别为 t 时刻和平衡态时的吸附量,对式(9)进行傅里叶转换可以得到:

如果 B ⋅ t-t图是通过或靠近原点的直线,那么吸附速率控制步骤为粒子内扩散控制,否则为膜扩散控制[16].
从总体上看,qt对t0.5呈现多线段(图4),说明活性炭SAAC对对硝基苯胺的吸附由内扩散与膜扩散共同控制.聚类分析结果表明,活性炭SAAC对对硝基苯胺吸附的Weber–Morris曲线分为2个线性部分:第1部分直线段为吸附的前25min,直线通过原点,说明在这一时间段里,活性炭SAAC对对硝基苯胺的吸附速率控制步骤为粒子内扩散控制;第2部分为吸附的25min以后,不通过原点,且直线截距b较大,说明在这一时间段里,膜扩散对活性炭SAAC吸附对硝基苯胺起到了重要作用.

图4 不同吸附剂量下活性炭SAAC吸附对硝基苯胺的Weber–Morris曲线Fig.4 Weber–Morris plots for p-nitroaniline adsorption onto activated carbon SAAC

图5 不同吸附剂剂量下活性炭SAAC对对硝基苯胺吸附的B⋅t-t图Fig.5 B⋅t vs t plots for p-nitroaniline adsorption onto activated carbon SAAC at different adsorbent
为进一步验证上述结果,采用 Dumwald-Wagner颗粒内扩散方程对0.300g/L和0.500g/L两种吸附剂剂量下活性炭SAAC对对硝基苯胺的吸附动力学数据作进一步的分析.活性炭SAAC吸附对硝基苯胺的B⋅t对t(t<25min)作图,结果如图5所示.在0.300g/L和0.500g/L 2种不同吸附剂剂量下,活性炭SAAC对对硝基苯胺的吸附,在吸附前期,B⋅t-t图呈直线,相关系数分别为0.984和0.965,在y轴上的截距分别为0.02757和-0.0799,说明在前期(t<25min),对硝基苯胺在活性炭SAAC上的吸附速率控制步骤为粒子内扩散控制,这与Weber–Morris曲线得出的结论相一致.
2.5 活性炭SAAC对对硝基苯胺的吸附等温线

图6 不同溶液温度下对硝基苯胺在活性炭SAAC上的吸附等温线Fig.6 Adsorption isotherm for p-nitroaniline onto SAAC at different temperatures
由图6 可见,活性炭SAAC对对硝基苯胺的平衡吸附量随溶液温度的升高而降低,表明对硝基苯胺在活性炭SAAC上的吸附为放热反应.采用Langmuir和Freundlich等温方程对吸附平衡数据进行非线性拟合,等温方程参数拟合结果如表 3所示.比较表 3中的拟合相关系数可知, Freundlich 方程能更好地描述对硝基苯胺在活性炭SAAC上吸附行为.在不同温度下,拟合得到Freundlich常数n均大于1,表明活性炭SAAC对对硝基苯胺的吸附为优惠吸附.互花米草活性炭SAAC对对硝基苯胺的Langmuir最大吸附量为719mg/g,大于商业大孔树脂(318mg/g)、棉杆活性炭(460mg/g)及胡敏酸(1.8mg/g)等吸附剂.以上结果表明,互花米草基活性炭SAAC是处理对硝基苯胺废水的一种潜在良好吸附剂.

表3 对硝基苯胺在活性炭SAAC上的吸附等温拟合参数Table 3 Isotherm parameters for p-nitroaniline adsorption onto SAAC
3 结论
3.1 以互花米草为原料,KOH为活化剂,制备出的活性炭SAAC的BET比表面积为2825m2/g,总孔容积为 1.374cm3/g,H-K微孔容积 1.192cm3/g,优于城市与工业水处理用活性炭一级标准.
3.2 活性炭SAAC对水溶液中的对硝基苯胺吸附效率高,最大吸附量为 719mg/g,在吸附进行25min内即可达到饱和吸附量的70%.
3.3 准二级方程能更好地描述对硝基苯胺在活性炭SAAC上的吸附动力学行为,吸附平衡数据符合Freundlich方程,吸附为优惠吸附,低温有利于吸附.
3.4 颗粒内扩散方程研究表明,对硝基苯胺在活性炭SAAC上的吸附前期由颗粒内扩散控制,后期由颗粒内扩散控制与膜扩散共同控制.
[1] Bhunia F, Saha N C, Kaviraj A. Effects of aniline–an aromatic amine to some freshwater organisms [J]. Ecotoxicology, 2003,12: 397-403.
[2] Chung K T, Chen S C, Zhu Y Y. Toxic effects of some benzamines on the growth of Azotobacter vinelandii and other bacteria [J]. Environ. Toxicol. Chem., 1997,16:1366-1369.
[3] 沈力人,杨品钊,陈丽亚.液膜法处理对硝基苯胺废水的研究 [J].水处理技术, 1997,23(1):45-47.
[4] Sun J.H, Sun S P, Fan M H. A kinetic study on the degradation of p-Nitroaniline by Fenton oxidation process [J]. J. Hazard. Mater., 2007,148:172-177.
[5] Saupe A. High-rate biodegradation of 3- and 4-nitroaniline [J]. Chemosphere, 1999,39:2325-2346.
[6] Chang Hun Yun, Yun Heum Park, Chong Rae Park. Effect of pre-carbonization on porosity development of activated carbons from rice straw [J]. Carbon, 2001,39(4):559-567.
[7] Hayashi J, Horikawa T, Takeda I. Preparing activated carbon from various nutshells by chemical activation with K2CO3[J]. Carbon, 2002,40(13):2381-2386.
[8] Suarez-Garcia F, Martinez-Alonso A, Tascon J M D. Porous texture of activated carbons prepared by phosphoric acid activation of apple pulp [J]. Carbon, 2001,39(7):1111-1115.
[9] 钦 佩,谢 民,陈素玲,等.苏北滨海废黄河口互花米草人工植被贮能动态 [J]. 南京大学学报, 1994,7(3):488-493.
[10] Lagergren S. About the theory of so-called adsorption of soluble substances [J]. Kungliga Svenska Vetenskapsakademiens Handlingar, 1898,24:1-39.
[11] Ho Y S. Adsorption of heavy metals from waste streams by peat [D]. Birmingham, UK: University of Birmingham, 1995.
[12] Chien S H, Clayton W R. Application of Elovich equation to the kinetics of phosphate release and sorption in soil [J]. Soil Sci. Soc. Am. J., 1980,44:265-268.
[13] 丁世敏,封享华,汪玉庭,等.交联壳聚糖多孔微球对染料的吸附平衡及吸附动力学分析 [J]. 分析科学学报, 2005,21(2):127-130.
[14] Chang M Y, Juang R S. Adsorption of tannic acid , humic acid , and dyes from water using the composite of chitosan and activated clay [J]. J. Colloi. Interface Sci., 2004,278:18-25.
[15] Weber W J Jr, Morris J C. Kinetics of adsorption on carbon from solution [J]. J. Sanitary Eng. Div. Proceed Am. Soc. Civil Eng., 1963,89:31-59.
[16] Boyd G E, Adamson A W, Myers L S. The exchange adsorption of ions from aqueous solutions by organic zeolites II: kinetics [J]. J. Am. Chem. Soc., 1947,69:2836-2848.
Adsorption kinetics of p-nitroaniline onto microporous carbon activation with KOH.
LI Kun-quan1,2, ZHENG Zheng1*, LUO Xing-zhang1, JIANG Jian-chun3, (1.Environmental Science and Engineering Department, Fudan University, Shanghai 210093, China;2.College of Engineering, Nanjing Agricultural University, Nanjing 210031, China;3.Institute of Chemical Industry of Forest Product, Chinese Academy of Forestry, Nanjing 210031, China). China Environmental Science, 2010,30(2):174~179
Low-cost activated carbon was prepared from Spartina alterniflora from a two-step thermo-chemical process by KOH activation. The adsorption equilibrium and kinetic behavior of p-nitroaniline onto the carbon was investigated by conducting a series of batch adsorption experiments, and adsorption mechanism was discussed from kinetic point of view. The pseudo-second-order model was found to explain the adsorption kinetics most effectively. It was also found that the pore diffusion played an important role in the adsorption, and intra-particle diffusion was the rate-limiting step at the first 25 min for the temperatures of 15, 25 and 35 ℃. The Freundlich isotherm was found to best describe the experimental data. The maximum adsorption capacity of p-nitroaniline was found to be 719 mg/g for initial p-nitroaniline concentration of 200 mg/L at 15℃.
KOH activation;p-nitroaniline;microporous carbon;adsorption mechanism
X703.5
A
1000-6923(2010)02-0174-06
2009-07-22
“十一五”国家水专项资助项目(2008ZX07101-005)
* 责任作者, 教授, hjzzheng@fudan.edu.cn
李坤权(1976-),男,江苏南京人,助理研究员,博士,主要从事水处理技术、固体废物处置和利用方面的研究.发表论文10余篇.

