荧光图像早期癌症诊断仪的临床应用研究
【作 者】叶衍铭,萧树东,戈之诤,郑家骠,夏敬芳,姜智敏
上海市消化疾病研究所内镜荧光图像研究课题组,上海市,200001
我国卫生部在颁发的2004年到2010年的《中国癌症预防与控制规划纲要》中指出,中国的癌症危害已经日益严重。癌症是以细胞异常增殖及转移为特点的一大类疾病,它的发病原因与有害环境、不良的生活方式及遗传易感性等都有很大的关系。2000年全球新发的癌症病例约有1000万,死亡620万,现患病例2200万。预计到2010年癌症新发病例将达到1500万,死亡1000万,现患病例3000万。癌症正在成为人类的第一杀手,是一种死亡率很高的疾病,大多数癌症患者存在术后复发转移率高和预后差的情况。根据统计报告,5年生存率仅在10~30%。大量临床病例证明,癌症的早期诊断、早期治疗,其彻底治愈可以达到90%左右。其治疗生存率低的原因,正是癌症早期诊断的困难所造成。随着DR、CT、MRI、CT-PET的普及应用,越来越多的较小恶性肿瘤被较早期发现。但是,癌前病变,体积很小,形态特征不典型,甚至肉眼很难识别的恶性肿瘤,通常还是不能被识别。目前,世界上正兴起荧光内镜早期癌症诊断系统的研究,有望成为解决以上不足的一种早期癌症诊断新技术。
人体组织在短波长光如紫外光、紫光和蓝光等照射后,可以诱发组织内许多荧光基团和物质,如胶原、强力蛋白、还原型烟酸胺腺嘌呤二核苷酸(NADH)、黄素膘嘌呤二核苷酸(FAD)亚铁血红素生成合成途中或细胞感染产生的卟啉等产生不同颜色的荧光,这称之为人体组织的自体荧光。由于人体组织层次结构复杂,各类内源性荧光分布广,因此所产生的组织荧光光谱波段很宽,分布在450~750 nm范围内[1-3]。而来自于粘膜下层的正常胃肠道组织的自体荧光光谱表现为明显的绿色特征的光谱,如图1中A所示,荧光光谱峰在500-510 nm。胃肠道组织癌变或发生癌前早期癌变后,因癌症组织形态异常和内源性荧光物质变化的共同作用的结果,使其光谱则以绿色荧光减弱和红光荧光增强为主要特征,如图1中B所示,与正常胃肠道组织的荧光光谱有着明显差别。

图1 荧光波长(nm)Fig.1 Autofl uorescence spectrum
自20世纪80年代,萧树东、Cathren等[4-5]报道应用激光诱发自体荧光光谱(LIFS)临床检测胃癌和结肠腺瘤以来,国内外学者的大量研究[6-8]表明,LIFS对胃肠道早期肿瘤和癌前病变的诊断具有很高的敏感性和特异性,可为胃肠道病变诊断提供更多有关形态改变和生化异常的补充信息。LIFS的最大的缺陷在于仅能对组织进行单一点的检查,每次检测的胃肠道粘膜的面积仅为2~4 mm2,获得信息缺乏组织连贯性,不可避免存在取样误差,影响了LIFS的诊断准确率[9],限制了其在临床中应用。

图2 荧光图像早期癌症诊断仪在胃癌诊断中应用示意图Fig.2 Light-Tnduced fl uorescence endoscopy used in gastric cancer diagnosed
荧光图像内镜成像LIFE系统所具有的组织检查的连贯性、大面积、快速、实时的自体荧光检测的新技术被极大关注,成了近年来早期癌症和癌前病变诊断研究的主攻方向[10]。荧光图像内镜成像系统多数是采用癌症荧光光谱特征中比值的识别技术,我们研制的荧光图像早期癌症诊断仪(图2)正是利用这一原理制作而成,在我们的系统中采用蓝紫色激光进行激发,在高灵敏CCD前分别用透过绿光(490-570 nm)和透过红光(625-690 nm)滤色片记录下的红色和绿色图像,然后,将这二幅图像进行数字化处理,计算出这二幅图像所对应各点的 R(红光)和 G(绿光)的荧光比值后,得到一幅以R(红光)/G(绿光)比值大小分布的数字图像,然后将这数字图像用加权办法,根据R/G(癌)>R/G(正常)的原则,采用某一光谱比值R/G的数值为恶变的阈值(设定为F)为判断依据,把癌变组织部位R/G>F地方显示为红色、正常组织部位R/G<F的地方显示为绿色,这样就形成一幅用于诊断的癌变部位显示红色而正常部位为绿色的假彩色图像。从这幅假彩色的图像中,根据不同的颜色很容易把癌变的部位与正常部位区分开来,达到诊断的目的。在我们的装置中除了蓝紫色激光照明外,还加上白光照明,并采用先进的两光源快速切换、双通道图像同步跟踪读取技术,使之能在同一时段里获得检测位置的真彩色图像和荧光假彩色诊断图像进行实时的同屏显示,如图3和图4所示。

图3 胃癌病灶部的图像Fig.3 Gastric cancer image

图4 正常胃粘膜的图像Fig.4 Nomal mucosal image
从这些实时、快速同屏显示的真彩色图像与荧光假彩色图像的对照中,使癌变的部位和范围都一目了然地表示出来。荧光图像(LIFE)成像诊断技术还可以克服荧光光谱(LIFS)技术所存在的观察范围小和检测部位没有组织连贯性的缺点,实现在很短的时间内扫描整个检查部位,避免了荧光光谱(LIFS)所存在的取样误差,快速捕捉可疑病灶信息,精确引导活检,为提高了早期癌症的检出率提供可靠的技术保障。
我们研制的荧光图像早期癌症诊断仪目前已进入初步的临床试验,进行了离体105病例中的210个标本的检测。其中癌症病灶标本100个(胃癌61,食管癌15,直肠癌29)以及正常消化道粘膜组织和良性肿瘤标本共110个。我们研制的荧光图像早期癌症诊断仪检查结果与病理检查的结果对照见表1所示。

表1 癌症荧光图像诊断与病理结果对照Tab.1 Light-induced fluorescence endoscopy diagnosed results
从以上初步研究结果表明,我们研制的系统对胃肠道癌症诊断的敏感性、特异性、诊断率分别为94.0%、95.5%和94.8%,具有很高的应用价值。
为了深入研究在我们系统中所采用的光谱比值大小作为癌症存在与否的一个重要的指征及其应用价值,我们对129例病人用蓝紫色激光诱发的荧光光谱(LIFS)的测量数据,用荧光图像中所使用的条件做光谱比值的数值运算,研究其中所展示的癌症荧光特征的规律。具体是我们在129例病人(48例癌症、81例正常)测了129条荧光光谱曲线后,按照荧光图像使用的G(绿光)滤光(490-570 nm)波段与R(红光)滤光(625-690 nm)波段的计算出R(红光)/G(绿光)荧光强度的比值,以其大小顺序排列并作图(如图5所示)。48例癌症为图5的A曲线分布,81例正常为图5的B曲线分布。从这两条曲线可以看出,癌症的光谱R/G的比值集中在图中R/G比值大的上方,正常部位的R/G比值却集中在图中R/G比值小的下方,从而得到下面这样的规律:癌症组织的R/G比值要大于正常组织的R/G比值,而且也进一步证实荧光光谱比值的大小确实是研究肿瘤良恶性的一个重要指征。在此也与荧光图像一样,采用R/G比值的阈值F为判据的话,取阈值F=20,当相于R/G比值为0.20,最后得到诊断的结果就像图5中示意那样:在48例癌症中,43例为癌症荧光特征(5例为假阴性);81例正常中,75例为正常荧光特征(6例为假阳性),其诊断敏感度、特异性、诊断率分别为87.8%、92.6%、90.7% 。
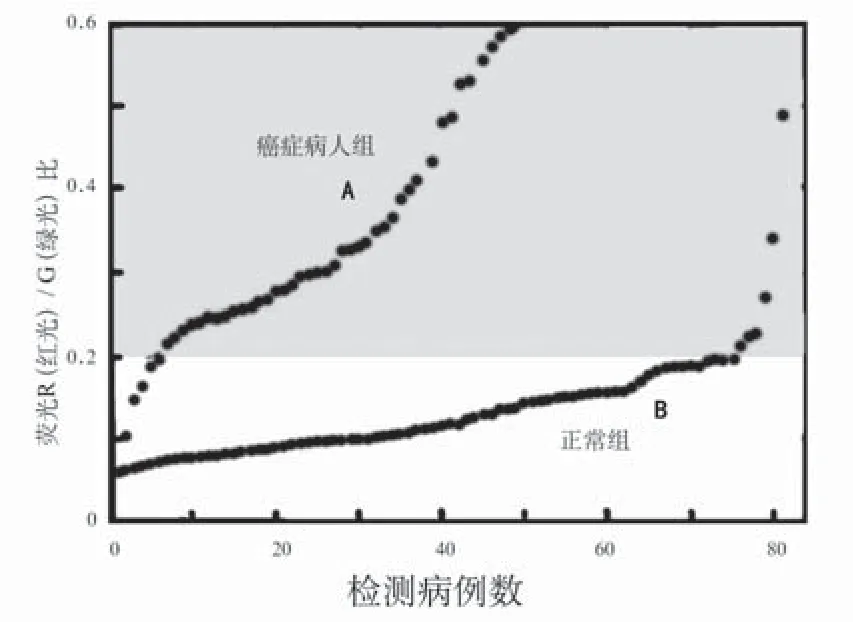
图5 检测病例的荧光比Fig.5 Fluorescence ratio map of diagnose case
从以上研究中可以看到:
(1) 我们的装置是通过检测红光图像和绿光图像进行图像空间中各像点红光强度与绿光强度之比大小的比较,采用其R/G比值中某一数值为阈值F来决定癌症是否存在,即是R(红光)/G(绿光)的比值大于F时表现为癌症特征(红色)图像;而R(红光)/G(绿光)的比值小于F时表现正常组织(绿色)图像,阈值F大小是根据临床具体情况进行设定的。荧光图像诊断中所采用的光谱比值阈值定则分析法是一种可量化、客观和可靠的检测方法,是荧光光谱研究成果在荧光图像中的具体应用。在荧光光谱测量像图5中所展示的规律——癌症组织的光谱比值大于正常组织的光谱比值,正是我们荧光图像早期癌症诊断仪的重要判定依据。
(2) 本文在临床试验中所得到的结果与国内外学者的研究相当接近[11-13],揭示了诱发组织的自体的荧光图像检测是诊断癌症和癌前病变的一个有效方法。本文所展示采用同一癌变的判定方法的二种检测手段所得到的结果可以看到,荧光图像(LIFE)检测所得到的结果要好于荧光光谱(LIFS)。由此可以发现荧光图像(LIFE)能做到在大范围内、快速同时探测到极多像点部位的荧光信息,避免了荧光光谱(LIFS)中存在的一次只检测一点的所产生随机测量误差,因此可以得到更为满意的结果,这正是荧光图像(LIFE)具有更好的优越性和实用性所在。
(3) 从我们临床研究的实验发现,癌组织和癌前病变组织中参与产生红色荧光的荧光物质是很少的,导致红色荧光发射非常微弱,要探测这样微弱的信息,必须采用超高灵敏的成像系统才能捕捉到这些微光图像。系统运转在高灵敏的条件下会带来许多干扰,如灵敏度高的图像探测器线性范围自然就窄,非线性的影响会导致荧光光谱比值反常;灵敏度高其抗杂散光的能力就差,而反射光、散射光的干扰都会使测到的信息失去真实性等,都会严重影响诊断准确性和可靠性。如何选好光谱滤色片加强对反射光、散射光有效的隔离;如何设定在线性区工作的实验条件以及进行必要的非线性的补偿,是我们课题所重点关注的与提高诊断率息息相关的重大问题。
(4) 在临床应用中,发现消化道正常粘膜以及一些良性肿瘤如多发性腺瘤、息肉等在探测时都显示正常特征的绿色图像,所发现的 5例假阳性都发生在有明显病灶的良性肿瘤中,2例是周边伴有大面积炎症的胃溃疡患者,1例是出现在萎缩性胃炎中发生糜烂的地方,还有2例是间质瘤患者的病灶上。在这些病例的病灶中是怎样一种病理变化引起癌症特征荧光增强,而这些微小的病理变化是否是潜在癌前病变前兆等一系列临床问题,仍有待进一步研究和探讨。然而,就这些病变而言,其间质瘤是一种容易恶变的疾病;在反复发作胃溃疡周边部的炎症容易转化非典型增生的肠生化,这些病灶能得到及时发现,在诊断中仍具有警示作用,有利于对病情跟踪和随访。
(5) 从临床初步应用研究中可以看到本装置在癌症诊断中有相当高的敏感性,可能在癌的潜伏期还没有形成明显的形态特征前比其它诊断手段能早发现病灶。本系统还具有以动态图像(80 ms内更换一次)的方式,通过转动镜头可实现大视野、大范围采集任何检查部位形态特征(真彩色图像)和荧光特征(假彩色图像)的图像信息,非常直观、简便、实时、快速发现发生在任何部位的可疑病灶,并能在图像的监视中定位指示活检,为提高早期癌症的检出率起到极其重要的作用,具有非常广阔的应用前景。
[1]Mayinger B,Horner P, Jordan M,et al.Endoscopic fluorescence spectroscopy in the upper GI tract for the detection GI cancer.of Initial experience[J]. Am J Gastroenterol,2001,96(9):2616-2621.
[2]DaCosta RS, Andersson H, Wilson BC.Molecular fluorescence excitation-emission matrices relevant to tissue spectroscopy[J].Photochemphotobiol,2003,78(4):384-392.
[3]DaCosta RS,Wilson BC,Marcon NE.Photodiagnostic techniques for the endoscopic detection ofpremalignant gastrointestinal lesions[J].Digestive Endoscopy,2003,15(3):153-173.
[4]萧树东、吴叔明、张德中.内镜氙离子(Xe+)激光激发自体荧光在胃癌诊断中的应用[J].内镜,1988,5:129-131.
[5]Cothren RM,Richards-Kortum R,Sivak MV,et al.Gastrointestinal tissue diagnosis by laser-induced fluorescence spectroscopy at endoscopy[J].Gastrointest Endosc,1990,36(2):105-111.
[6]Kapadia CR, Cutruzzola FW, O’Brien KM, et al. Laserinduced fluorescence spectroscopy of human colonic mucosa[J].Detection of adenomatous transformation.Gastroenterology,1990,99(1):150-157.
[7]萧树东,戈之铮,钟喨,等.胃癌自体荧光的光谱诊断[J].胃肠病学,2002,7(1):21-23.
[8]Mayinger B, Jordan M, Horner P, et al.Endoscopic lightinduced autofluorescence spectroscopy for the diagnosis of colorectal cancer and adenoma[J].J Photochem Photobiol B,2003,70(1):13-20.
[9]DaCosta RS, Wilson BC, Marcon NE. Optical techniques for the endoscopic detection of dysplastic colonic lesions[J]. Curr Opin Gastroenterol,2005,21(1):70-79.
[10]Haringsma J, Tytgat GN, Yano H, et al. Autofluorescence endoscopy: feasibility of detection of GI neoplasms unapparent to white light endoscopy with an evolving technology[J].Gastrointest Endosc,2001,53(6):642-650.
[11]Kobayashi M, Tajiri H, Seike E, et al. Detection of early gastric cancer by a real-time autofluorescence imaging system[J]. Cancer Lett,2001,165(2):155-159.
[12]Nakaniwa N, Namihisa A, Ogihara T,et al.Newly developed autofluorescence imaging videoscope system for the detection of colonic neoplasms[J]. Digestive Endoscopy,2005,17(3):235-240.
[13]Kara MA, Peters FP, Ten Kate FJ, et al, Endoscopic video autofluorescence imaging may improve the detection of early neoplasia in patients with Barrett’s esophagus[J].Gastrointest Endosc,2005,61(6):679-685.
——记嘉荫县红光乡燎原村党支部

