混合热休克蛋白/肽疫苗与IL-2联合免疫治疗肉瘤的实验研究
眭翔,郭全义,袁玫,崔雪梅,卢世璧
肿瘤的免疫治疗在经历大量实验研究后已开始应用于临床,这也是提高肿瘤治疗效果的一个新途径,肿瘤的主动特异性免疫治疗(疫苗)和过继免疫治疗[如淋巴因子激活的杀伤细胞(LAK 细胞)]均有一些临床试用的初步结果[1-3],但其治疗效果尚不够理想。目前,联合应用各种免疫方法将有望提高肿瘤免疫治疗的效果,但免疫治疗后机体免疫系统可能会产生免疫负调作用,如调节性 T 细胞(Treg)的增加,所以如何克服这一负调作用也是现今免疫治疗面临并有待克服的问题。因此,为了提高肿瘤的免疫治疗效果,我们设计应用热休克蛋白/肽(mixed heat shock protein/peptides,mHSP/P)疫苗和重组人 IL-2(rhIL-2)加用低剂量环磷酰胺(cyclophasphade,Cy)对小鼠肉瘤进行联合免疫治疗,观察这种联合免疫对小鼠肉瘤疗效的增强作用。
1 材料与方法
1.1 材料
SPF 级 BALB/C 小鼠,雌性,6~8周龄,体重 18~22 g,购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2000-0006],按啮齿类动物饲养方法和条件饲养于我院 SPF 级动物房。小鼠肉瘤 S180 细胞由军事医学科学院王玉芝教授惠赠,取小鼠腹水中瘤细胞,液氮冷冻保存。rhIL-2 购自北京双鹿药业股份有限公司,Cy 购自江苏恒瑞医药股份有限公司,Sephacryl S-200HR凝胶层析柱购自瑞典 Amersham Biosciences公司。
1.2 方法
1.2.1 细胞接种 S180 细胞按常规方法进行解冻、复苏,台盼蓝染色拒染法计数活细胞数 ≥ 95%。用 DMEM 培养液调整至 5×104/只,以 0.1ml 于小鼠背部皮下注射。
1.2.2 疫苗分离制备 从 S180 细胞肉瘤组织分离混合 mHSP/P 疫苗,具体步骤为:①取小鼠皮下S180 细胞肉瘤组织,剪碎研磨,加入 10 倍体积的细胞裂解液(30 mmol/L NaHCO3、0.5 mmol/L 苯甲基磺酰氟,pH 7.1),振摇破膜;②将上述获得的细胞裂解液于4 ℃、75000×g 离心 2.5 h,弃沉淀,取上清透析;③上 Sephacryl S-200HR 凝胶层析柱,加入分子筛洗脱液,分步收集,在相对分子质量(5~20)×104段截取收集洗脱液,即为混合mHSP/P 疫苗;④经 12% SDS-PAGE 分析后进行常规蛋白质印迹鉴定。
1.2.3 实验分组与治疗方案 于S180 细胞接种后第 2 天开始进行实验并分组。
⑴ mHSP/P + Cy + rhIL-2:20 μg/只于小鼠下肢腹股沟皮下注射 mHSP/P,每 7 d 免疫 1 次;第3 次 mHSP/P 免疫后次日 3 mg/只于小鼠腹腔注射 Cy 1 次;Cy 注射后第 3 天于小鼠皮下注射不同剂量的rhIL-2,分别为每次 1×104IU/只(I组、5只小鼠)、5×104IU/只(C组、10只小鼠)、1×105IU/只(D组、10只小鼠)、1×106IU/只(H组、5只小鼠),连续 5 次,每天 1 次,此即为第 1 疗程结束。第 1 疗程完成后7 d 开始进行第 2 疗程,即 mHSP/P 免疫 1 次后进行 Cy和rhIL-2治疗,方案同前;第 2 疗程完成后7 d 再开始进行第 3 疗程,方案同第 2 疗程。共 3个疗程。
⑵ Cy + mHSP/P + rhIL-2:E组。3 mg/只于小鼠腹腔注射 Cy 1 次后1 d 进行 mHSP/P 免疫,mHSP/P、rhIL-2 剂量均与C组治疗方案相同,仅1个疗程。10只小鼠。
⑶单用 mHSP/P:B组。20 μg/只于小鼠下肢腹股沟皮下注射 mHSP/P,每 7 d 免疫 1 次,共免疫 3 次。10只小鼠。
⑷ Cy + mHSP/P:F和G组。3 mg/只于小鼠腹腔注射 Cy 1 次后1 d 进行 mHSP/P 免疫(20 μg/只、每 7 d 免疫 1 次、共免疫 3 次)。其中 F组为2个疗程,G组为1个疗程。每组各10只小鼠。
⑸对照组:A组。注射 0.1ml 生理盐水。10只小鼠。
1.2.4 疗效观察指标 自肿瘤移植后至第 45 天,每隔 3 d 观察并记录小鼠肿瘤的生长变化,按下列公式:V=L×W×W/2(L 为肿瘤最长径,W 为与L 垂直的最宽径)计算肿瘤体积。以肿瘤移植后3个月仍无瘤生长或肿瘤逐渐缩小至消失为参照标准,观察各组小鼠的无瘤生存情况,同时记录死亡鼠的生存期(长期存活鼠按生存 90 d 计算),进行平均生存期比较。以对照组的肿瘤体积为参照,计算肿瘤移植后第 35 天各组小鼠的肿瘤生长抑制率,肿瘤生长抑制率=[1-(实验组肿瘤体积/对照组肿瘤体积)]×100%。
1.3 统计学处理
应用 SPSS 10.0 统计学软件进行数据处理。肿瘤体积的比较采用单因素方差分析,生存期的比较采用 Kaplan-Meier 单因素分析,以 P<0.01 为差异有统计学意义。
2 结果
2.1 混合 mHSP/P 疫苗的鉴定
从 S180 细胞肉瘤组织获得混合 mHSP/P 疫苗,每克瘤重得量为2.5 μg。12% SDS-PAGE和蛋白质印迹分析结果显示在相对分子质量约为110、96、70、60 处分别可见包含 HSP110、Gp96、HSP70、HSP60的混合 mHSP 疫苗的特异性条带(图 1)。
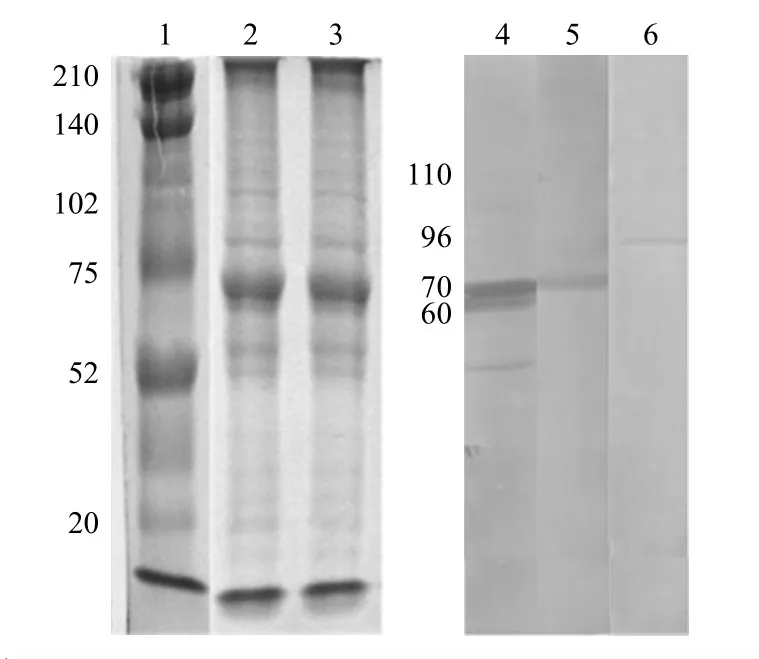
图1 混合 mHSP/P 疫苗的SDS-PAGE和蛋白质印迹分析Figure1 SDS-PAGE analysis and Western blotting of the mHSP/P
2.2 肿瘤生长体积
与对照组(A组)比较,C组小鼠的肿瘤体积明显缩小,抗肿瘤效应明显,其次为D和E组(均P<0.01);而其余各组小鼠的肿瘤体积与对照组(A组)相比均无明显差异(图 2)。
2.3 小鼠的无瘤生存与平均生存期比较
C组无瘤生存小鼠数量最多(3/10),其次为D组(2/10)和E、F组(各 1/10);而其余各组均未见无瘤生存小鼠(表1,图 3)。平均生存期比较结果显示,B、C、D、E、I组分别与对照组(A组)相比差异均有统计学意义(均 P<0.01)(表1);其中 C组小鼠的生存期延长效果最佳,平均延长了 26 d。
2.4 肿瘤移植后第 35 天肿瘤生长抑制率
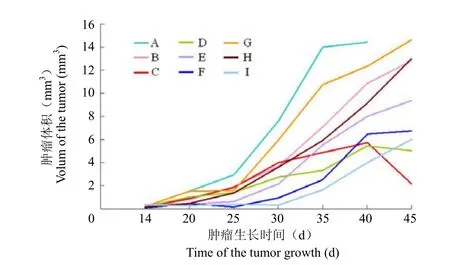
图2 免疫治疗后各组荷瘤小鼠的肿瘤体积生长曲线Figure2 Tumor growth curre of S180 tumor in mice after various treatments

表1 免疫治疗后各组荷瘤小鼠的生存情况Table1 Effect of various vaccinations on the survival of S180 tumor-bearing mice
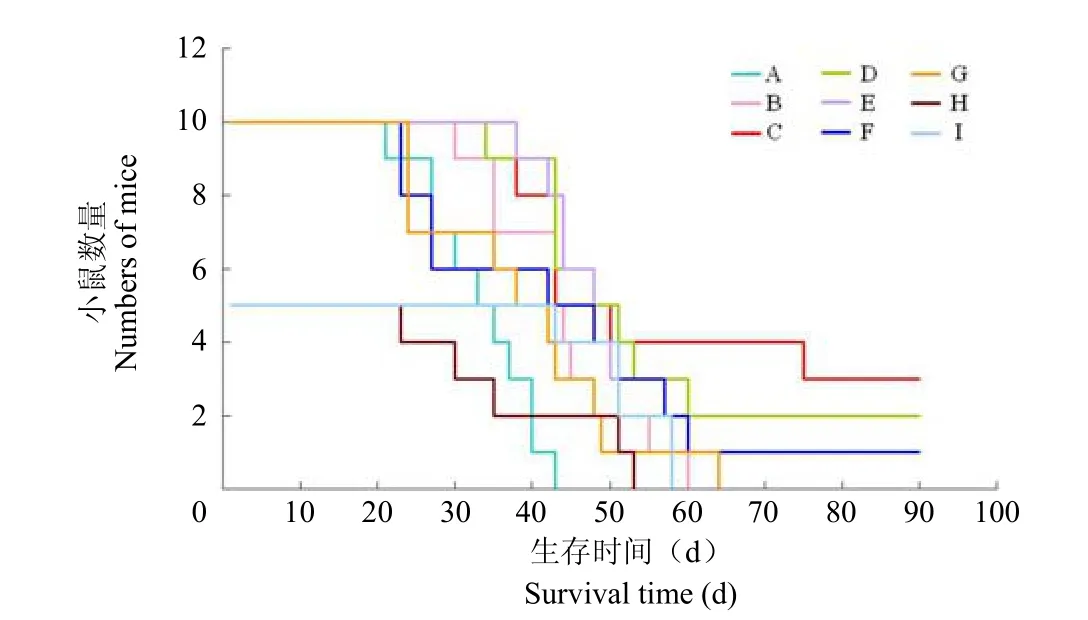
图3 免疫治疗后各组荷瘤小鼠的Kaplan-Meier 生存曲线Figure3 Effect of various vaccinations on the survival of S180 tumor-bearing mice
I组抑瘤效果最佳,而 G组最差。各组抑瘤率由高至低依次为I(88.3%)、F(82.1%)、D(76.0%)、C(65.1%)、E(60.4%)、H(57.5%)、B(49.2%)、G(23.1%)组。
3 讨论
作为分子伴侣,mHSP 存在于细胞内,具有与蛋白相结合和稳定蛋白的作用,在肿瘤细胞中会表达增多,并可与多种肿瘤抗原肽相结合;从肿瘤细胞中分离提取 HSP/P,以之为疫苗注射入机体后,被抗原递呈细胞摄取后与MHC结合,抗原递呈细胞成熟后活化淋巴细胞,产生抗肿瘤效应;并且由于HSP能与多种抗原肽结合,因而是多价疫苗[4-6]。我们曾应用混合 mHSP/P 为疫苗进行预防性免疫治疗,即在移植肿瘤细胞前先注射疫苗,取得了良好的抑制肿瘤生长作用[7],但此疫苗应用于肿瘤治疗(即先移植肿瘤后进行免疫治疗)的效果不佳,因此我们考虑采用联合免疫方法以增强其疗效。IL-2 在临床应用时需加大剂量才会有效,而其毒副作用又限制了其应用,以 IL-2 作为疫苗的辅助治疗药物,只用较小的剂量即可增强肿瘤的免疫治疗作用,这已有相关报道,但多应用于对免疫较为敏感的肿瘤,如黑色素瘤及肾癌等[8-9],用于肉瘤治疗的报道甚少。而小剂量 Cy 具有抑制 Treg 细胞的作用,可以降低免疫负调作用[10],因此本研究采用混合 mHSP/P 疫苗加 rhIL-2和小剂量 Cy 联合治疗,以观察其对小鼠肉瘤的免疫治疗效果。
本实验结果表明:①3 种免疫制剂联合应用可使部分肿瘤消退(治愈),并明显延长生存期,较单用 mHSP/P 好;②适量的rhIL-2 与mHSP/P 联合应用时可以增强免疫治疗作用,但大剂量反而不好(1×106IU/只),最适剂量应为5×104~1×105IU/只;③多疗程免疫较单疗程(E组)效果好,不仅 mHSP/P 要多疗程应用,rhIL-2 及Cy 也要同时多疗程应用,因为据报道一般在给药 14 d 后Cy 才能发挥增强 T 细胞的杀伤作用[11];④Cy +mHSP/P 2个疗程(F组)较单疗程(G组)效果好,可能与Cy 降低了免疫负调作用有关,这也与文献报道相一致[12]。
为降低免疫抑制作用,特别是 Treg 细胞,我们加用小剂量的Cy,然而关于应用 Cy的时机与剂量也有不同的报道[11-12]。我们分别选择在疫苗前、疫苗后rhIL-2 前应用 Cy,结果表明在疫苗前或疫苗后rhIL-2 前均可应用。综上所述,本研究的强化免疫方案为临床肉瘤治疗提供了较为详细的参考基础。
[1]Ueda Y, Sonoyama T, Itoi H, et al.Locoregional adoptive immunotherapy using LAK cells and IL-2 against liver metastases from digestive tract cancer.Gan To Kagaku Ryoho, 2000, 27(12):1962-19625.
[2]Parmiani G, Testori A, Maio M, et al.Heat shock proteins and their use as anticancer vaccines.Clin Cancer Res, 2004, 10(24):8142-8146.
[3]Aalamian M, Fuchs E, Gupta R, et al.Autologous renal cell cancer vaccines using heat shock protein-peptide complexes.Urol Oncol,2006, 24(5):425-433.
[4]Srivastava P.Interaction of heat shock proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses.Ann Rev Immunol, 2002, 20:395-425.
[5]Ishii T, Udono H, Yamano T, et al.Isolation of MHC class I-restricted tumor antigen peptide and its precursors associated with heat shock proteins hsp70, hsp90, and gp96.J Immunol, 1999, 162(3):1303-1309.
[6]Rivoltini L, Castelli C, Carrabba M, et al.Human tumor-derived heat shock protein 96 mediates in vitro activation and in vivo expansion of melanoma- and colon carcinoma-specific T cells.J Immunol, 2003,171(7):3467-3474.
[7]Cui XM, Tang Y, Yuan M, et al.Experimental study of mixed heat shock protein /peptide for treatment of sarcoma in mice.Chin J Exp Surg, 2006, 23(5):636.(in Chinese) 崔雪梅, 汤宇, 袁玫,等.混合热休克蛋白/肽复合物疫苗疫防治小鼠肉瘤.中华实验外科杂志, 2006, 23(5):636.
[8]Berinstein NL.Enhancing cancer vaccines with immunomodulators.Vaccine, 2007, 25 Suppl 2:B72-B88.
[9]Kudo-Saito C, Garnett CT, Wansley EK, et al.Intratumoral delivery of vector mediated IL-2 in combination with vaccine results in enhanced T cell avidity and anti-tumor activity.Cancer Immunol Immunother,2007, 56(12):1897-1910.
[10]Mihalyo MA, Doody AD, McAleer JP, et al.In vivo cyclophosphamide and IL-2 treatment impedes self-antigen-induced effector CD4 cell tolerization: implications for adoptive immunotherapy.J Immunol,2004, 172(9):5338-5345.
[11]Salem ML, Kadima AN, El-Naggar SA, et al.Defining the ability of cyclophosphamide preconditioning to enhance the antigen-specific CD8+ T-cell response to peptide vaccination: creation of a beneficial host microenvironment involving type I IFNs and myeloid cells.J Immonother, 2007, 30(1):40-53.
[12]Di Paolo NC, Tuve S, Ni S, et al.Effect of adenovirus-mediated heat shock protein expression and oncolysis in combination with low-dose cyclophosphamide treatment on antitumor immune responses.Cancer Res, 2006, 66(2):960-969.