阿法骨化醇对SD大鼠骨合成的影响
刘晓青,田晓艳,R.B.Setterberg,Webster S.S.Jee
自1922年美国著名的生物化学家Elmer Mc-Collum发现vitamin D(Vit D)以来,Vit D及其类似物已用于多种骨代谢性的疾病如佝偻病(rickets)、骨软化症(osteomalacia)、肾性骨营养不良等;Vit D缺乏也是导致老年人骨质疏松症的重要危险因素。Vit D及其类似物对与骨形成密切相关的成骨细胞的分化和发育具有重要的调节作用,可保护成骨细胞,减缓衰老。成骨细胞体外实验[1-2]证实,阿法骨化醇(alfacalcidol,ALF)抑制骨髓基质细胞向脂肪细胞分化,向成骨细胞转化,增加成骨细胞的数量,刺激成骨细胞;ALF通过增加骨生长因子、骨形态蛋白和骨基质蛋白的合成,增加Vit D受体(VDR)数目。
Vit D的活性代谢物主要有阿法骨化醇[1α-(OH)D3]和骨化三醇[1,25(OH)2D3],活性 Vit D结合VDR。研究报道[3-4]活性Vit D类似物增加骨量,阿法骨化醇对OVX大鼠和老年♂大鼠胫骨中段皮质骨有骨合成作用,刺激骨外膜骨形成,超偶联促进骨内膜面骨形成,预防Fischer-344 OVX大鼠的骨丢失和老年♂ SD大鼠松质骨丢失。Weber等[5]观察到 1α-hydroxyvitamin D2和 1α-hydroxyvitamin D3促进去卵巢大鼠皮质骨骨合成,在较高的中毒浓度,可能诱导皮质骨内骨重建。这些研究都建立在骨丢失的模型上,本实验采用骨组织形态计量学技术,探讨不同剂量ALF对♀SD大鼠胫骨松骨和皮质骨的影响,并比较其作用的部位差异性。
1 材料与方法
1.1 试剂和仪器
1.1.1 试剂 药物:阿法骨化醇来自 Calbiochem公司(La Jolla,CA,USA),配制贮存液:将其溶解在体积分数为100%的乙醇中,质量浓度为100 mg·L-1,避光,4℃冰箱贮存。注射液:每周用棉子油稀释阿法骨化醇贮存液,其终浓度为0.005、0.025、0.05、0.1 mg·L-14个剂量;标记物和其它试剂购自美国Sigma公司。
1.1.2 实验仪器 低速度锯(Buehler,Illinois,USA);骨切片机(LEICA RM 2165 Rotary Microtome,Germany);骨磨片机(Trimmer,Buffalo Dental MFG Co.USA);图像分析系统(OsteoMeasure,USA);显微镜(Olympus,Japan);照相机(Sony dxc-970MD camera,Japan);数据分析统计软件(StatView 5.0.1,USA)。
1.2 实验方法
1.2.1 动物实验 8.5月龄正常未交配♀ Sprague-Dawley大鼠 74 只(Portage,MI,USA),平均体质量(320±12.4)g。每笼6~7只,饲养笼规格为(58×36×28)cm3,保证动物有足够的活动空间。使用标准饲料(Harlan Teklad,USA)含有0.95%钙,0.67%磷,4.5 IU·g-1Vit D3)。所有动物自由摄食、摄水,在(22±2)℃,通风良好,湿度(55±10)%的条件下适应性饲养2周。根据上述实验目的按体质量将大鼠随机分为6组:基础组、棉籽油空白对照组、阿法骨化醇 0.005、0.025、0.05、0.1 μg·kg-1·d-14 个剂量组。
Tab 1 Effects of ALF on cancellous bone static parameters of the proximal tibial metaphyses(PTM)in rats( ± s,n=6 or 7)

Tab 1 Effects of ALF on cancellous bone static parameters of the proximal tibial metaphyses(PTM)in rats( ± s,n=6 or 7)
*P<0.05 vs baseline;#P<0.05 vs vehicle
Group Dose/μg %B.Ar/% Tb.Wi/μm Tb.N/#·mm -1 Tb.Sp/μm Baseline 25.19 ±2.77 57.30 ±4.72 4.41 ±0.52 171.86 ±23.70 Vehicle 22.26 ±4.96 50.47 ±7.11 4.40 ±0.68 180.90 ±34.86 ALF 0.005 24.99 ±3.02 54.93 ±5.34 4.58 ±0.68 167.44 ±28.99 0.025 25.18 ±5.69 53.53 ±6.86 4.66 ±0.59 164.15 ±33.38e 0.05 26.93 ±5.02 53.39 ±6.21 5.05 ±0.75 148.45 ±30.27 0.1 35.50 ±4.20*# 68.85 ±12.29*# 5.16 ±0.62*# 126.56 ±17.50*#
Tab 2Effects of ALF on cancellous bone dynamic parameters of the proximal tibial metaphyses(PTM)in rats±s,n=6 or 7)
Tab 2Effects of ALF on cancellous bone dynamic parameters of the proximal tibial metaphyses(PTM)in rats±s,n=6 or 7)
*P<0.05 vs baseline;#P<0.05 vs vehicle
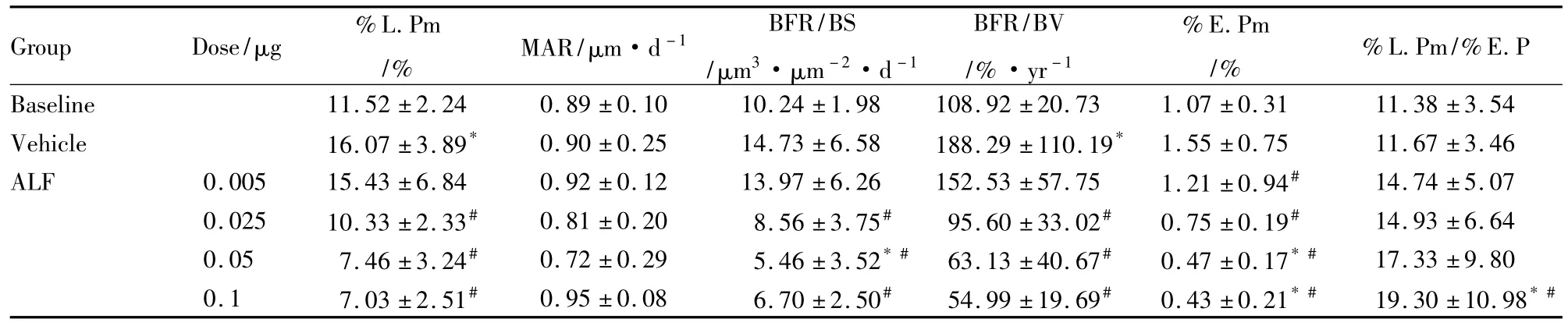
Group Dose/μg %L.Pm/% MAR/μm·d-1 BFR/BS/μm3·μm -2·d -1 BFR/BV/%·yr-1%E.Pm/%%L.Pm/%E.P Baseline 11.52 ±2.24 0.89 ±0.10 10.24 ±1.98 108.92 ±20.73 1.07 ±0.31 11.38 ±3.54 Vehicle 16.07 ±3.89* 0.90 ±0.25 14.73 ±6.58 188.29 ±110.19* 1.55 ±0.75 11.67 ±3.46 ALF 0.005 15.43 ±6.84 0.92 ±0.12 13.97 ±6.26 152.53 ±57.75 1.21 ±0.94# 14.74 ±5.07 0.025 10.33 ±2.33# 0.81 ±0.20 8.56 ±3.75# 95.60 ±33.02# 0.75 ±0.19# 14.93 ±6.64 0.05 7.46 ±3.24# 0.72 ±0.29 5.46 ±3.52*# 63.13 ±40.67# 0.47 ±0.17*# 17.33 ±9.80 0.1 7.03 ±2.51# 0.95 ±0.08 6.70 ±2.50# 54.99 ±19.69# 0.43 ±0.21*# 19.30 ±10.98*#
Tab 3Effects of ALF on cortical bone static parameters of the tibial shaft(TX)in rats(±s,n=6 or 7)
Tab 3Effects of ALF on cortical bone static parameters of the tibial shaft(TX)in rats(±s,n=6 or 7)
*P<0.05 vs baseline;#P<0.05 vs vehicle
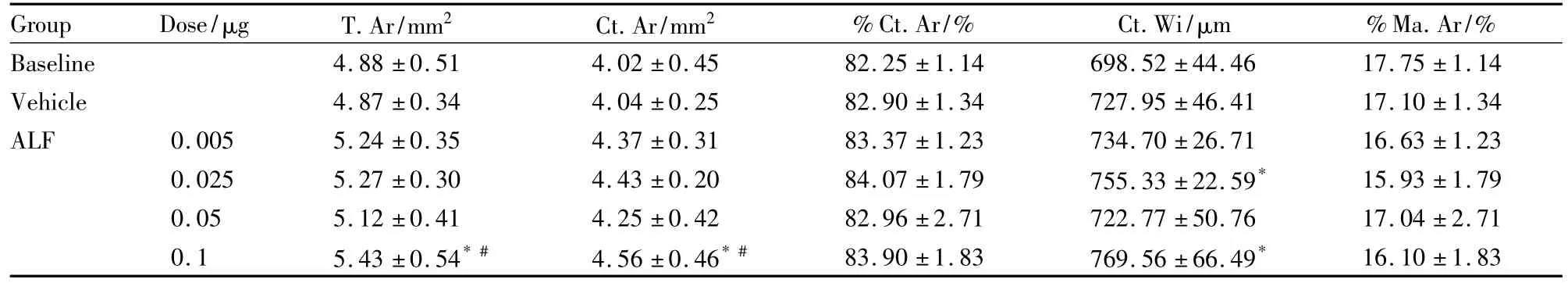
Group Dose/μg T.Ar/mm2 Ct.Ar/mm2 %Ct.Ar/% Ct.Wi/μm %Ma.Ar/%Baseline 4.88 ±0.51 4.02 ±0.45 82.25 ±1.14 698.52 ±44.46 17.75 ±1.14 Vehicle 4.87 ±0.34 4.04 ±0.25 82.90 ±1.34 727.95 ±46.41 17.10 ±1.34 ALF 0.005 5.24 ±0.35 4.37 ±0.31 83.37 ±1.23 734.70 ±26.71 16.63 ±1.23 0.025 5.27 ±0.30 4.43 ±0.20 84.07 ±1.79 755.33 ±22.59* 15.93 ±1.79 0.05 5.12 ±0.41 4.25 ±0.42 82.96 ±2.71 722.77 ±50.76 17.04 ±2.71 0.1 5.43 ±0.54*# 4.56 ±0.46*# 83.90 ±1.83 769.56 ±66.49*16.10 ±1.83
Tab 4Effects of ALF on cortical bone dynamic parameters of the tibial shaft(TX)in rats(±s,n=6 or 7)

Tab 4Effects of ALF on cortical bone dynamic parameters of the tibial shaft(TX)in rats(±s,n=6 or 7)
*P<0.05 vs baseline;#P<0.05 vs vehicle
Group Dose/μg %Ps-L.Pm/%Ps-MAR/μm·d-1 Ps-BFR/BS/μm3·μm -2·d -1%Ec-L.Pm/%Ec-MAR/μm·d-1 Ec-BFR/BS/μm3·μm-2·d -1%Er.Pm/%Baseline 18.23 ±11.08 0.84 ±0.12 14.73 ±7.22 4.04 ±3.68 0.1 ±0.00 0.40 ±0.37 0.82 ±0.17 Vehicle 13.61 ±0.26 0.79 ±0.08 10.76 ±1.36 14.45 ±6.90 0.18 ±0.19* 2.01 ±1.19 1.09 ±0.20 ALF 0.005 23.73 ±5.17 0.74 ±0.21 18.30 ± 9.08 14.08 ±8.27 0.38 ±0.48* 7.73 ±11.99 0.78 ±0.16 0.025 25.98 ±16.43 0.91 ±0.33 29.79 ±25.55 9.83 ±7.08 0.32 ±0.39 3.75 ±5.86 0.78 ±0.14 0.05 35.19 ±16.37 0.94 ±0.24 34.50 ±22.27 9.93 ±4.92 0.10 ±0.00 0.99 ±0.49 0.74 ±0.40 0.1 47.93 ±16.38*#1.12 ±0.13*#54.84 ±25.62*#5.57 ±6.78 0.36 ±0.45#4.17 ±9.18 0.35 ±0.08
基础组在实验开始时尸检取材。棉籽油空白对照组给与棉籽油,阿法骨化醇不同剂量组分别每天按灌胃给药,灌胃量为 5 ml·kg-1·d-1,每周称体质量1次,并按体质量变化调整给药量,共给药12周。每天检查所有大鼠的一般健康情况。
1.2.2 荧光标记 在实验开始d 1,所有大鼠皮下注射 Xyenol Orange 90 mg·kg-1·d-1;所有动物在处死前d 14、d 13皮下注射钙黄绿素(Calcein)10 mg·kg-1·d-1,处死前 d 4、d 3 皮下注射钙黄绿素。
1.2.3 骨标本取材和骨组织形态计量学测量 实验结束后,阿佛丁(avertin)腹腔注射麻醉动物,剂量为0.5 g·kg-1体质量。右心室抽血处死,取左、右侧胫骨。右侧胫骨上端和中段用慢速锯做额状面剖开,固定于体积分数为70%的乙醇,做骨组织形态计量学分析;收集血液、离心后进行血清生化分析。
开腔后的胫骨近端PTM(proximal tibial metaphysis)和中段TX(tibial shaft),Villanueva染液染色,固定和脱水,脱脂,浸透,包埋,磨片,超声清洗,脱水,中性树脂封固,用以进行骨组织形态计量学测量。
采用PTM骨厚片,测量胫骨近段干骺端生长板下1~4 mm范围内次级松质骨中的骨组织形态计量学动态参数和静态参数。测量前首先避开生长板下缘1 mm宽的初级松质骨范围,然后以此向下推移3 mm测量。测量方法、参数表达、参数计算等按文献报道[6-7]。松质骨骨组织形态计量学静态参数:描述骨量的多少和骨小梁的形态结构,用于评价药物防治效果。动态参数包括骨形成参数、骨转换参数和骨吸收参数,通过动态参数,可了解骨表面矿化量和速率,解释静态参数变化的原因。
2 结果
2.1 阿法骨化醇对大鼠胫骨近端松质骨的骨组织形态计量学的影响 从Tab 1可见,松质骨骨量阿法骨化醇剂量依赖性增加,可增加骨的连接性并改进骨小梁的微观结构。0.1 μg·kg-1·d-1阿法骨化醇治疗组与棉籽油空白对照组比较,骨小梁面积百分数(%B.Ar)增加59%,骨小梁数目(Tb.N)增加了17%,骨小梁的宽度 (Tb.Wi)升高了38%;骨小梁的分离度(Tb.Sp)下降30%。从Tab 2的动态参数可见,骨转换降低,骨吸收抑制,骨吸收大于骨形成,导致骨的正平衡。在0.025、0.05和0.1 μg·kg-1剂量治疗组中①反映骨形成的指标明显下降:%L.Pm分别下降36%,53%,49%;每单位骨组织骨形成率(BFR/TV)分别下降36%、57%、37%;每单位骨小梁表面周长骨形成率(BFR/BS)分别下降42%、62%、47%。而骨转换指标,每单位骨面积骨形成率(BFR/BV)也分别下降49%、65%、64%。②反映骨吸收的指标:骨吸收周长百分数%E.Pm下降 52%、70%、72%。在 0.1 μg·kg-1·d-1治疗组中,估计的骨平衡指标(%L.Pm/%E.Pm)明显增加到94%,暗示在最高剂量治疗情况下,大鼠骨小梁处于正性平衡状态。
除以上结果,我们还发现一个特殊情况,阿法骨化醇治疗各剂量组明显增加骨芽指标。在0.025、0.05和0.1 μg·kg-1剂量的治疗组,胫骨近端 PTM骨小梁表面可见到非典型的特殊骨形成——骨芽(Fig 1)。
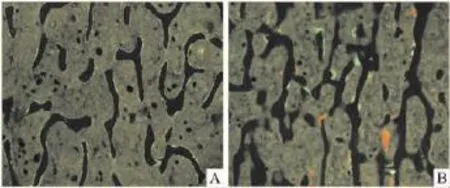
Fig 1 Trabecular“bone buds”of PTM(right picture)Atypical bone formation pattern“bone buds”(small,local and focal newly formed bone attached on bone suface,some are red,some are gree)was observed on trabecular sufaces of the PTM treated with 0.1 μg·kg-1·d -1ALF(B);bone connectivity of trabcular at 0.1 μg·kg-1·d-1ALF group that have bone buds(B)is much better than Aging control group(A)
总之,0.1 μg·kg-1阿法骨化醇治疗组骨小梁结构改善;刺激骨形成,骨芽增多,而增加PTM松质骨骨量。
2.2 胫骨中段皮质骨的骨组织形态计量学分析阿法骨化醇0.1 μg·kg-1剂量组的骨组织总面积(T.Ar)明显增加11%,皮质骨面积(Ct.Ar)上升13%,而且骨外膜面荧光周长百分数 (%Ps-L.Pm)明显增加287%,骨表面骨形成率(Ps-BFR/BS)上升729%;但在骨内膜面荧光周长百分数(%En-L.Pm)明显下降61%和骨内膜面吸收周长(%En-E.Pm)下降40%。在骨内膜面,双荧光有很大的个体差异,0.05 μg·kg-1剂量的 7 个大鼠,没有双荧光,在 0.1μg·kg-1·d-1剂量,只有两个大鼠有双荧光。当没有双荧光时,矿化沉积率 (MAR)定为0.1 μm·d-1[5],因此在骨内膜面的动态参数有很大的标准差 (Tab 3、4)。
3 讨论
关于阿法骨化醇对♀大鼠胫骨近段骺端松质骨(PTM)和胫骨中段皮质骨(TX)的研究结果包括:① 0.1 μg·kg-1·d-1治疗组,血钙增加 5% ,而血磷水平在3个较高剂量增加幅度为25% ~41%;②0.1 μg·kg-1阿法骨化醇剂量依赖性增加胫骨近段骺端骨量;③ 骨组织形态计量学结果,0.1 μg·kg-1剂量的阿法骨化醇显示有明显的促骨合成反应,刺激骨芽的骨形成,抑制骨吸收超过抑制骨形成,骨的合成和分解呈动态正平衡,从而增加胫骨近段骺端松质骨骨量,改善骨小梁的结构;④0.1 μg·kg-1阿法骨化醇治疗组刺激胫骨中段皮质骨骨外膜骨形成,增加骨矿化沉积率,皮质骨面积绝对值增加,但皮质骨面积相对百分数未改变。
0.1 μg·kg-1·d-1阿法骨化醇仅引起血钙增加5%,其剂量比临床剂量高5~7倍(对50~70 kg的病人,其临床用量为 0.02 ~0.014 μg·d-1)。另外,当剂量为 0.005 μg·kg-1·d-1,血磷升高19%,当剂量为 0.1 μg·kg-1,血磷升高 41%。这个剂量是病人用药剂量的3倍,所以,临床上我们应该监控血磷水平。
本研究得到了不同剂量的阿法骨化醇对未处理的♀大鼠PTM松质骨的骨形态计量学的详细结果,以前研究报道了阿法骨化醇对去卵巢大鼠和老年的♂大鼠的PTM松质骨的影响,其均为高骨转换骨质减少模型[3-5]。而对去卵巢大鼠模型的研究仅报道了阿法骨化醇对去卵巢大鼠PTM的骨形态计量学静态参数的影响[5]。我们的研究发现 0.1 μg·kg-1剂量的阿法骨化醇抑制骨吸收,抑制BMU骨重建,维持或增加骨形成,从而增加骨量,改善骨结构,其具有抗骨重建和促骨合成作用。其抗骨重建作用保留骨,充填骨吸收空洞,增加骨矿化[3-5,8];其促骨合成作用体现在刺激骨小梁的微建造,促进骨芽的形成,导致骨动态正平衡,进一步增加骨量,改进骨微结构[8-9]。我们的发现与阿法骨化醇治疗的OVX的大鼠腰椎的变化一致[3]。以上骨重建—抗骨代谢与骨建造—促骨合成作用呼应著名的骨计量学创始人、骨科专家 Frost“机械稳态假设”理论[10-11],阿法骨化醇降低产生最低效应的骨建造和骨重建的应变域值的调定点,刺激骨微建造,增加骨量;抑制BMU(basical multicellular units)骨重建的骨丢失[12]。
我们看到了一个特别的非典型的骨形成现象:新形成的、小的、集中的、花蕾状的新骨出现在骨小梁的表面,新骨表面有单荧光或双荧光覆盖。在偏振光的显微镜下,骨芽胶原纤维走向不同于它们附着的骨小梁纤维走向,据有以上所有特点的新骨定义为骨芽。骨芽的出现暗示了阿法骨化醇激活或促进成骨细胞活性。德国著名的骨科教授Erben等[9]曾报道骨芽的产生和它的形成微解机制发生在高剂量(0.1、0.2 μg·kg-1)骨化三醇的 OVX’d ♀大鼠;Li等[13]报道产生在 0.1 和 0.2 μg·kg-1的阿法骨化醇治疗的老年♂大鼠腰椎和胫骨中段。然而,当前研究首先报道阿法骨化醇诱导♀大鼠的骨芽形成在PTM的松质骨骨表面。我们认为骨芽的形成可能机制在于:松质骨的微建造或混合微建造/骨重建诱导所致[9,13]。然而,在大鼠的胫骨中段皮质骨骨内膜面我们没有发现骨芽形成位点,Li等研究发现出现在老年♂大鼠,可能是剂量的差异性。
阿法骨化醇对皮质骨的影响,在未处理♀大鼠、OVX大鼠以及老年♂大鼠胫骨皮质骨的骨形态计量学静态参数没有定量的差异性[3-5,13]。所有研究均报道阿法骨化醇刺激骨外膜骨矿化沉积率和微弱的骨内膜的正性平衡。12周的治疗期限不足够产生有显著意义的皮质骨的静态参数的变化。
总而言之,0.1 μg·kg-1阿法骨化醇治疗 12周,具有抗骨代谢和促骨合成作用,增加♀大鼠松质骨的骨量,改进骨微结构。其促骨合成作用表现在:刺激皮质骨骨外膜的骨形成;促进松质骨骨芽骨形成。其抗骨代谢作用表现在抑制骨小梁骨表面和皮质骨骨内膜面的骨吸收,抑制骨吸收大于骨形成,产生正性的内膜骨平衡状态。目前的研究结果显示[14-15]阿法骨化醇对♀大鼠有剂量依赖性增加松质骨骨量,改进骨小梁的结构,增加骨强度,具有骨合成和抗骨吸收作用,增加肌力作用,可以作为青年人和绝经后妇女预防骨质疏松症的用药。
[1]van Driel M,Pols H A,van Leeuwen J P.Osteoblast differentiation and control by vitamin D and vitamin D metabolites[J].Curr Pharm Des,2004,10(21):2535 -55.
[2]Shevde N K,Yamamoto H,Clagett-Dame M,et al,A novel vitamin D analogue exhibits selective anabolic actions in osteoblasts that result in enhanced bone formation[J].J Bone Miner Res,2002,17:S153.
[3]Li M,Li Y,Healy D R,et al.Alfacalcidol restores cancellous bone in ovariectomized rats[J].J Muscul Neur Int,2003,3:39 - 46.
[4]Shiraishi A,Takeda S,Masaki T,et al.Alfacalcidol inhibits bone resorption and stimulates formation in an ovariectomized rat model of osteoporosis:distinct actions from estrogen[J].J Bone Miner Res,2000,15(4):770 -9.
[5]Weber K,Goldberg M,Stangassinger M,Erben R G.1α-hydroxyvitamin D2is less toxic but not bone selective relative to 1αhydroxyvitamin D3in ovariectomized rats[J].J Bone Miner Res,2001,16(4):639 -51.
[6]Baron R,Vignery A,Neff L,et al.Processing of undecalcified bone specimens for bone histomorphometry[M]//Recker,ed.Bone Histomorphometry:Techniques and Interpretation.Boca Raton,FL,CRC Press,1983:13 -35.
[7]Parfitt A M,Drezner M K,Glorieux F H,et al.Bone Histomorphometry:Standardization of nomenclature,symbols,and units.Report of the ASBMR Histomorphometry Nomenclature Committee[J].J Bone Miner Res,1987,2:595 -610.
[8]Shiraishi A,Higashi S,Masaki T,et al.Comparison of Alfacalcidol and Menatetrenone for the treatment of bone loss in an ovariectomized rat model of osteoporosis[J].Calcif Tissue Int,2002,71:69-79.
[9]Erben R G,Brown S,Stangassinger M.Therapeutic efficacy of 1α,25-dihydroxyvitamin D3and calcium in osteopenia ovariectomized rats:evidence for a direct anabolic effect of 1α,25-dihydroxyvitamin D3on bone[J].Endocrinology,1998,139:4319 -28.
[10]Frost H M.Perspectives:The role of changes in mechanical usage set point in the pathogenesis of osteoporosis[J].J Bone Miner Res,1992,7:253 -62.
[11]Frost H M.Skeleton structural adaptation to mechanical usage(SATMU).Redefining Wolff’s law:The bone modeling problem[J].Anat Rec,1990,266:403 -13.
[12]Jee W S.Anabolic agents and osteoporosis:quo Vadis[J]?J Musculoskelet Neuronal Interact,2000,1(2):107 -11.
[13]Li M,Healy D R,Li Y,et al.Alfacalcidol prevents age-related bone loss and causes an atypical pattern of bone formation in aged male rats[J].J Musculoskelet Neuronal Interact,2004,4:22 - 32.
[14]Runge M,Schacht E.Multifactorial pathogenesis of falls as a basis for multifactorial intervention.J Musculoskelet Neuronal Interact,2005,5:127 -34.
[15]Schacht E,Richy F,Reginster J Y.The therapeutic effects of alfacalcidol on bone strength,muscle metabolism and prevention of falls and fractures[J].J Musculosket Neuronal Interact,2005,5(3):273-84.

