具有手性中心的新型双哌啶衍生物的合成*
冉维津, 张月成, 王 芳, 赵继全
(河北工业大学 化工学院,天津 300130)
手性金雀花碱(Ⅰ)是一种配位良好的手性二齿配体,其金属络合物在仲醇的氧化动力学拆分[1]、烯丙基的不对称烷基化[2]、有机锂化合物与亚胺的加成[3]等一系列反应中都有很好的催化性能。但Ⅰ是一种稀有的天然生物碱,人工合成难度大,来源受到限制,不利于大规模的应用。因此,合成与Ⅰ结构类似的化合物,构筑与Ⅰ-M(Ⅱ)催化性能相似的催化剂体系显得尤为重要。研究发现Ⅰ的母体结构具有双哌啶骨架,因此有人[4~6]合成了双哌啶衍生物作为二齿配体用于不同的配位催化反应,但是与Ⅰ-M(Ⅱ)催化性能相比仍有差距。为此,考虑到Ⅰ结构的刚性[7],我们拟合成带手性中心的三齿双哌啶衍生物,作为Ⅰ的替代品。该类三齿化合物与金属配位有可能形成刚性的带有手性中心的配合物,用于不对称催化反应。
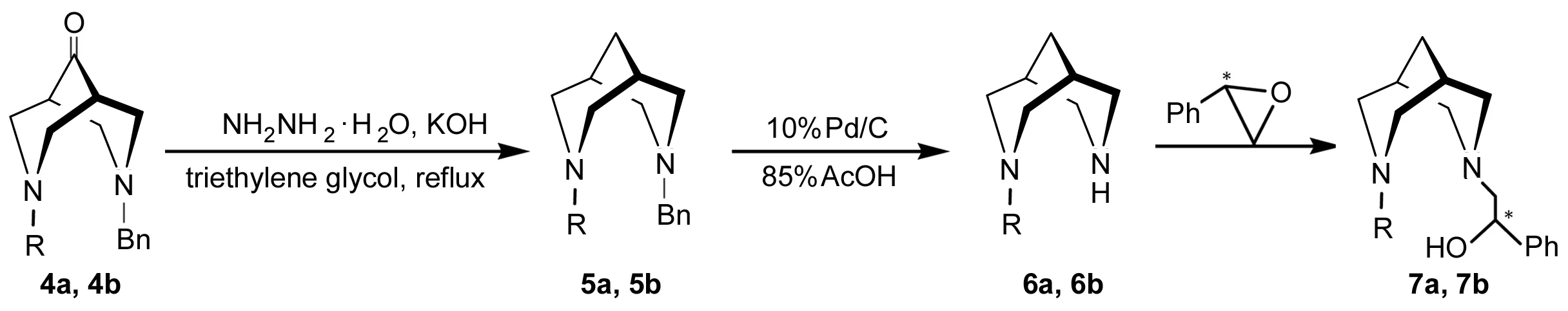
本文以简单的有机胺和丙烯酸甲酯为起始原料,依次经Michael加成、Dieckmann环合、脱羧、Mannich反应、黄鸣龙还原、钯碳催化脱苄基、与(R)-环氧苯乙烷加成等七步反应合成了两种新的具有手性中心的双哌啶骨架三齿配体化合物(7a和7b, Scheme 1)。
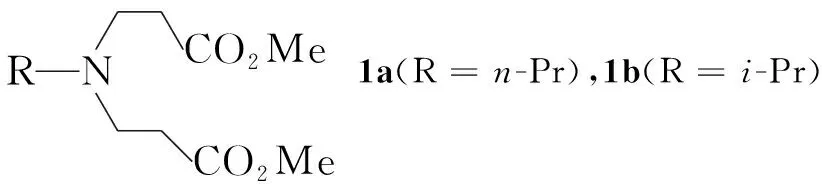
2a, 2b3a, 3b
2a, 2b3a, 3b
2a, 2b3a, 3b
Scheme 1
1 实验部分
1.1 仪器与试剂
XT-4型双目显微熔点仪(温度未校正);WZZ-2S/2S型数字式自动糖度/旋光仪;Bruker AC-P 300型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Vector 22型傅立叶变换红外光谱仪(KBr压片);VGZAB-HS型高分辨有机磁质谱仪(EI源,70 eV, 200μA); SP-6800A型气相色谱仪(GC)。
10%Pd/C,分析纯,阿尔埃莎(天津)化学有限公司;(R)-环氧苯乙烷,分析纯,百灵威化学技术有限公司;其余所用试剂均为分析纯;甲醇和甲苯使用前除水。
1.2 合成
(1)1的合成
在四口烧瓶中加入甲醇500 mL,丙烯酸甲酯68.88 g(800 mmol),搅拌下于0 ℃~10 ℃滴加正丙胺18.91 g(320 mmol),滴毕,于40 ℃反应(GC监测)。旋蒸除去过量的丙烯酸甲酯和甲醇得淡黄色油状液体N,N-二(丙酸甲酯基-3)正丙胺(1a),收率91.5%,纯度95.3%(GC,下同)。
用类似方法合成淡黄色油状液体N,N-二(丙酸甲酯基-3)异丙胺(1b),收率92.5%,纯度94.8%。
(2)3的合成
氮气保护下,在四口瓶中加入甲醇130 mL,金属钠7.4 g(320 mmol),待金属钠反应完毕,减压蒸除过量的甲醇制得甲醇钠;加入甲苯400 mL,加热至回流,搅拌下滴加1a70.97 g(290 mmol),滴毕,蒸出低沸点物质直至反应液温度达到105 ℃~110 ℃,回流反应4 h。冷却至室温,加入少量水,用浓盐酸(4×40 mL)萃取,合并盐酸层得含2a的盐酸溶液。回流脱羧5 h。冷却,用40%NaON溶液调至pH 12~13,用二氯甲烷(4×60 mL)萃取,合并萃取液,用无水硫酸钠干燥,蒸除溶剂,减压蒸馏得无色透明油状液体N-正丙基-4-哌啶酮(3a),收率79.3%,纯度96.1%;1H NMRδ: 0.94(t,J=7.4 Hz, 3H, CH3), 1.56(m, 2H, CH2CH3), 2.42(t,J=7.6 Hz, 2H, CH2CH2CH3), 2.47[t,J=6.0 Hz, 4H, C(O)CH2], 2.74(t,J=6.2 Hz, 4H, NCH2)。
用类似方法合成无色透明油状液体N-异丙基-4-哌啶酮(3b),收率56.3%,纯度95.8%;1H NMRδ: 1.07(m, 6H, CH3), 2.45[t,J=6.0 Hz, 4H, C(O)CH2], 2.80(t,J=6.0 Hz, 4H, NCH2), 2.93(m, 1H, CH)。
(3)4的合成[8,9]
在单口瓶中加入3a28.20 g(200 mmol)的甲醇(150 mL)溶液,冰水浴冷却,搅拌下滴加冰乙酸12.00 g(0.20mol)和甲醇60 mL的混合物,滴毕得A。
氮气保护下,在四口瓶中加入甲醇200 mL,苄胺21.40 g(200 mmol),搅拌下于10 ℃~20 ℃滴加冰乙酸12.00 g(20 0mmol),滴毕,加入94%多聚甲醛12.76 g(400 mmol),于室温搅拌15 min后滴加A,滴毕,回流反应(GC跟踪终点)。冷却、过滤,滤液旋蒸浓缩,残留物用40%KOH调节pH 12~13,用二氯甲烷(4×70 mL)萃取,合并萃取液,用无水硫酸钠干燥,旋蒸浓缩得酒红色黏稠油状液体,放入冰箱中冷冻结晶,过滤得棕黄色固体,用正戊烷重结晶得浅黄色晶体7-苄基-3-正丙基-3,7-二氮杂双环[3.3.1]壬烷-9-酮(4a),产率54.2%, m.p. 56.1 ℃~56.4 ℃;1H NMRδ: 0.91(t,J=7.2 Hz, 3H, CH3), 1.47(m, 2H, CH2CH3), 2.35(t,J=7.2 Hz, 2H, CH2CH2CH3), 2.58[s, 2H, C(O)CH], 2.82(m, 4H, NCH2), 3.02(m, 4H, NCH2), 3.55(s, 2H, PhCH2), 7.23~7.35(m, 5H, PhH); IRν: 3 054, 2 958, 2 901, 2 876, 2 814, 1 732, 1 709, 1 602, 1 495, 1 460, 1 352, 747 cm-1。
用类似方法合成7-苄基-3-异丙基-3,7-二氮杂双环[3.3.1]壬烷-9-酮(4b)。前段后处理同4a,无水硫酸钠干燥,旋蒸浓缩得酒红色黏稠油状液体,减压蒸馏,收集(210~220) ℃/1.2 kPa馏份,放入冰箱中冷冻结晶,过滤得黄色固体,用正戊烷重结晶得淡黄色至白色晶体4b,产率48.9%, m.p.48.8 ℃~49.7 ℃(48.8 ℃~49.7 ℃[9]);1H NMRδ: 1.02(d,J=6.4 Hz, 6H, CH3), 2.58[s, 2H, C(O)CH], 2.85(m, 5H, NCH2, NCH), 3.05(m, 4H, NCH2), 3.53(s, 2H, PhCH2), 7.23~7.33(m, 5H, PhH); IRν: 3 055, 3 031, 2 964, 2 896, 2 824, 1 734, 1 601, 1 495, 1 460, 746, 706 cm-1。
(4)5的合成
氮气保护,向四口瓶中依次加入82%KOH 12.0 g(176 mmol),二缩三乙二醇70 mL,4a6.0 g(22 mmol)及80%水合肼5.5 g(88 mmol),回流反应4 h;蒸出肼和水的混合物至反应液温度为160 ℃,再回流反应2 h;继续蒸出肼和水的混合物至反应液温度为200 ℃~210 ℃,再回流反应4 h。冷却至室温,加水30 mL,用乙醚(5×30 mL)萃取,合并萃取液,依次用10%NaOH溶液(3×30 mL),饱和食盐水(3×30 mL)洗涤,无水硫酸钠干燥,蒸除溶剂得深黄色黏稠液体,减压蒸馏得无色透明液体7-苄基-3-正丙基-3,7-二氮杂双环[3.3.1]壬烷(5a),产率83.0%,纯度97.7%;1H NMRδ: 0.93(t,J=7.2 Hz, 3H, CH3), 1.48(m, 4H, CH2CH3, CHCH2CH), 1.90(br s, 2H, CHCH2CH), 2.22(t,J=7.2 Hz, 2H, CH2CH2CH3), 2.33(m , 4H, NCH2), 2.72(m, 4H, NCH2), 3.46(s, 2H, PhCH2), 7.20~7.41(m, 5H, PhH); IR谱图中无C=O吸收峰。
用类似方法合成无色透明液体7-苄基-3-异丙基-3,7-二氮杂双环[3.3.1]壬烷(5b),产率82.6%,纯度97.2%;1H NMRδ: 1.04(d,J=6.4 Hz, 6H, CH3), 1.51(s, 2H, CHCH2CH), 1.91(br s, 2H, CHCH2CH), 2.40(m, 2H, NCH2), 2.52(s, 2H, NCH2), 2.66(m, 5H, NCH2, NCH), 3.45(s, 2H, PhCH2), 7.20~7.43(m, 5H, ArH); IR谱图中无C=O吸收峰。
(5)6的合成[10]
氮气保护,在三口瓶中加入10%Pd/C 0.50 g, 85%乙酸15 mL,5a3.80 g(14.7 mmol),搅拌下于25 ℃~30 ℃通入H2(TLC监测)。过滤,滤液旋蒸浓缩后在冰水浴冷却下用40%KOH溶液调至pH 11~12,用乙醚(3×10 mL)萃取,合并萃取液,用无水硫酸钠干燥,旋蒸除去溶剂得淡黄色油状液体,减压蒸馏得无色透明油状液体3-正丙基-3,7-二氮杂双环[3.3.1]壬烷(6a) 2.0 g,产率83.0%,纯度97.7%;1H NMRδ: 0.90(t,J=7.2 Hz, 3H, CH3), 1.47(m, 2H, CH2CH3), 1.65(s, 3H, CHCH2CH, CHCH2CH), 1.81(d,J=14.0 Hz, 1H, CHCH2CH), 2.14(t,J=7.2 Hz, 2H, CH2CH2CH3), 2.27(d,J=11.2 Hz, 2H, NCH2), 2.91(d,J=13.6 Hz, 2H, NCH2), 3.04(m, 4H, NCH2), 3.33(br s, 1H, NH); IRν: 3 321(N-H), 2 959, 2 910, 2 854, 2 800, 2 769, 2 731 cm-1。
用类似方法合成无色透明液体3-异丙基-3,7-二氮杂双环[3.3.1]壬烷(6b),产率58.0%,纯度97.0%;1H NMRδ: 1.03(d,J=6.8 Hz, 6H, CH3), 1.62(m, 3H, CHCH2CH, CHCH2CH), 1.70(d,J=12.0 Hz, 1H, CHCH2CH), 2.54(m, 3H, NCH2, NCH), 2.98(m, 6H, NCH2), 3.37(br s, 1H, NH); IRν: 3 319(N-H), 2 964, 2 908, 2 854, 2 792, 2 767, 2 730 cm-1。
(6)7的合成
氮气保护,在两口瓶中加入NaH 1.15 g(27 mmol),无水甲苯10 mL和6a2.82 g(15 mmol),回流反应至没有气泡产生得B。
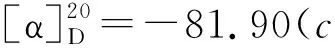
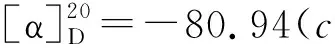
2 结果与讨论
在4的1H NMR谱图中,由于羰基的吸电子作用,其桥头碳上的氢在2.58出现共振峰。还原后的5由于失去了羰基的吸电子作用,桥头碳上的氢向高场至1.90~1.91;在1.48~1.51处的峰为羰基还原后生成的亚甲基氢的共振峰。6在3.33, 3.37出现的小包峰为仲胺氢的共振峰;在3 321 cm-1和3 319 cm-1出现了仲胺N-H的伸缩振动特征吸收峰与之呼应。
在7的NMR谱图中,PhCH受苯环和羟基的强拉电子作用的影响出现在4.69~4.71;与之对应的碳出现在69.8和69.1;羟基活泼氢在6.32和6.17处出现小包峰。在3 259 cm-1和3 222 cm-1处的宽峰为羟基形成氢键后的振动吸收峰。m/z287为[M-1]+,是7失去醇质子得到的碎片峰,m/z270是7脱去一分子水得到的碎片峰,另外这些峰的丰度都很低,这些都符合醇类化合物的质谱特征[11]。
3 结论
以有机胺和丙烯酸甲酯为起始原料经过Michael加成、Dieckmann环合、脱羧、Mannich反应、黄鸣龙还原、钯碳催化脱苄基、与环氧化物加成等7步反应合成了两种新型的具有双哌啶骨架的三齿化合物,其中4a,5a,6a,7a和7b为未见文献报道的新化合物。预期这些双哌啶衍生物有可能通过两个氮原子以及一个羟基氧与过渡金属配位形成刚性的过渡金属配合物,在一些配位催化反应中显示出较好的催化性能。
[1] Trend R M, Stoltz B M. An experimentally derived model for stereoselectivity in the aerobic oxidative kinetic resolution of secondary alcohols by (sparteine)PdCl2[J].J Am Chem Soc,2004,126(14):4482-4483.
[2] Togni A. Asymmetric allylic alkylation catalyzed by palladium-sparteine complexes[J].Tetrahedron:Asymmetry,1991,2(7):683-690.
[3] Arrasate S, Lete E, Sotomayor N. Synthesis of enantiomerically enriched amines by chiral ligand mediated addition of organolithium reagents to imines[J].Tetrahedron:Asymmetry,2001,12(14):2077-2082.
[4] Breuning M, Steiner M, Mehler C,etal. A flexible route to chiral 2-endo-substituted 9-oxabispidines and their application in the enantioselective oxidation of secondary alcohols[J].J Org Chem,2009,74(3):1407-1410.
[5] Lesma G, Cattenati C, Pilati T,etal. New chiral diamino ligands as sparteine analogues.Application to the palladium-catalyzed kinetic oxidative resolution of 1-phenyl ethanol[J].Tetrahedron:Asymmetry,2008,19(11):1363-1366.
[6] Genet Cédric, McGrath M J, O'Brien P. Evaluation of sparteine-like chiral diamines in the enantioselective lithiation-electrophilic trapping of anO-alkyl carbamate[J].Org Biomol Chem,2006,4:1376-1382.
[7] Mueller J A, Cowell A, Sigman M S,etal. Origin of enantioselection in chiral alcohol oxidation catalyzed by Pd[(-)-sparteine]Cl2[J].J Am Chem Soc,2005,127(42):14817-14824.
[8] Garrison G L, Berlin K D, Scherlag B J,etal. 3,7,9-Triheterabicyclo[3.3.2]decan-10-ones:An unusual family of heterocycles obtained from 3,7-diheterabicyclo[3.3.1]nonan-9-ones[J].J Org Chem,1993,58(27):7670-7678.
[9] Berlin K D, Scherlag B J, Clarke C R,etal. Salts of 3-azabicyclo(3.3.1) nonanes as antiarr-hythmic agents and precursors thereof[P].US 5 110 933,1992.
[10] Smissmant E E, Ruenitz P C. Analogues of Sparteine.Ⅱ.Synthesis ofN-monoalkylbispidines andN,N′-dialkylbispidines[J].J Org Chem,1976,41(9):1593-1597.
[11] McLafferty F W. Interpretation of mass spectra(第三版)[M].北京:化学工业出版社,1987.

