细菌胞外聚合层在氧化含砷金精矿生物氧化过程中的作用
富 瑶,杨洪英,崔日成,范有静,王 承
细菌胞外聚合层在氧化含砷金精矿生物氧化过程中的作用
富 瑶,杨洪英,崔日成,范有静,王 承
(东北大学 材料与冶金学院,沈阳 110004)
通过研究含砷金精矿细菌氧化过程中各项工艺指标的变化,测定pH值、电压、砷离子浓度、细菌数量和胞外聚合层中多糖含量及结构,探讨胞外聚合层中多糖在细菌氧化含砷金精矿过程中的作用。结果表明:当电压由500 mV升到650 mV、As(Ⅲ)快速转化为As(Ⅴ)时,单个细菌可通过消耗胞外聚合层中的多糖来抵御砷离子的毒害;当电压稳定在650 mV、砷离子价态转化减缓时,细菌胞外聚合层中的多糖参与矿物的氧化反应;在砷离子胁迫下,多糖含量降低幅度可超过20%,即细菌可通过改变单个菌体胞外聚合层中多糖的产量来防止细胞受到侵害。
含砷金精矿;细菌冶金;胞外聚合层;多糖
含砷金矿是难处理金矿的重要类型,也是我国矿产开发的有价资源;这类矿石中的金被毒砂和黄铁矿等硫化物包裹,使其直接氰化浸出率很低。因此,要提高金的浸出率,氰化之前必须进行氧化预处理[1]。目前,工业上应用的氧化预处理工艺主要有焙烧氧化、加压氧化和细菌氧化[2];其中细菌氧化预处理,由于其简单易行、成本低、能耗小且环境友好[3−8],被称为“绿色冶金工艺”[9]。
基于上述原因,当今国际生物冶金领域里,细菌氧化浸出含砷金矿的机制研究活跃;而细菌胞外聚合层(Extracellular polymers)作为细菌氧化硫化物的反应场所,不仅是菌体的保护层,更是细菌氧化硫化物本质信息的携带者[10−11]。细菌氧化含砷金矿过程中,由于硫化物分解、砷离子不断溶解到矿浆中,细菌处于砷胁迫状态,为此菌体采取应激策略,其胞外聚合层也随之调整。本文作者以细菌胞外聚合层与砷离子的作用关系为切入点,考察细菌氧化含砷金精矿过程中,细菌胞外聚合层中多糖含量和结构随其他工艺指标的变化规律,探讨细菌胞外聚合层的耐砷作用;为进一步研究细菌胞外聚合层的抗砷机理和细菌氧化含砷金矿的生物机制提供基础依据。
1 实验
1.1 实验矿样
实验所采用的矿样采自湖南某高砷浮选精矿,磨矿粒度小于38 µm的占90%以上,主要元素成分如下:Au 129.1 g/t,S 17.70%,As 15.35%。矿石经XRF测量的化学成分如表1所列。其XRD谱如图1所示。测试表明,矿石主要由SiO2、Fe2O3、SO3和As2O3等化学成分组成;主要物相为毒砂、黄铁矿、石英和磁铁矿。
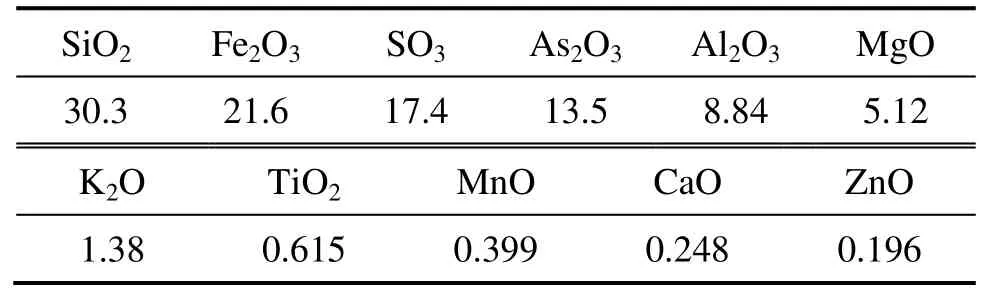
表1 含砷金精矿的化学成分Table 1 Chemical compositions of arsenic-bearing gold concentrate (mass fraction,%)
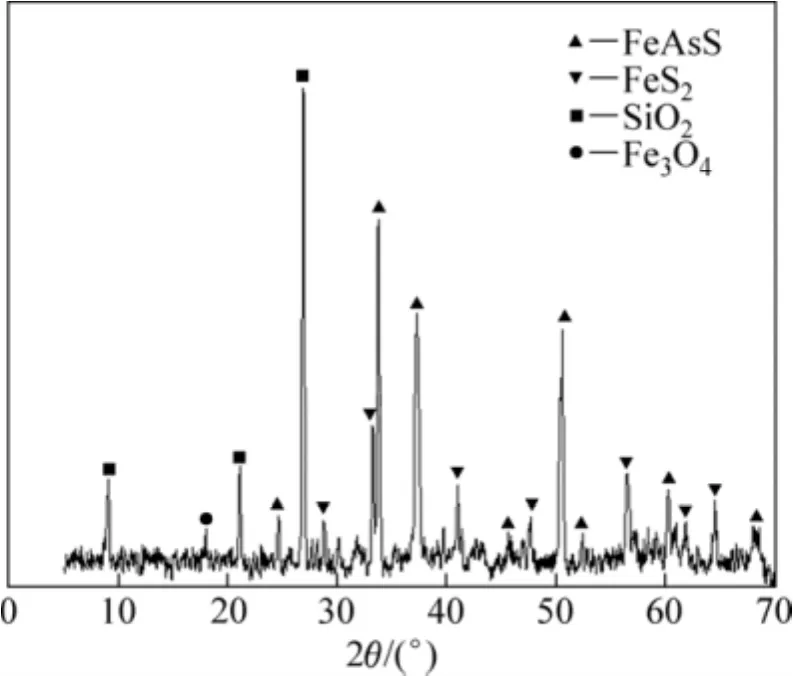
图1 含砷金精矿的XRD谱Fig.1 XRD pattern of arsenic-bearing gold concentrate
1.2 菌种
菌种为3种菌株组成的混合浸矿细菌,经实验室长期驯化,具有优良的嗜酸耐砷性;实验主要以Fe2+、S为能源,在pH为1.0~2.5、中温条件下化能自养。
1.3 实验方法
1.3.1 细菌浸矿实验
将同批活化至生长稳定期的菌液分装于5个500 mL的三角瓶中,每瓶各200 mL;分别加入1.1节中所述矿石,矿石用量及样品编号如表2所列。用体积比为1∶1的硫酸调节矿浆pH为1.60,置于恒温振荡培养箱中,经46 ℃、190 r/min培养。整个实验过程中以0#无矿体系作为其他体系的对照。

表2 含砷金精矿矿石用量Table 2 Dosage of arsenic-bearing gold concentrate
1.3.2 胞外聚合层中多糖的提取
取 3.0 mL 矿浆上清液于离心管中,经 11 500 r/min常温离心12 min,收集沉淀,沉淀中加入3.0 mL 3%EDTA溶液,混匀;经11 500 r/min常温离心12 min,上清液用孔径为0.45 µm微孔滤膜过滤,滤液为待测的多糖样品。
1.3.3 测定指标
矿浆的pH和电压采用雷磁pHS−2F pH计测定;细菌数量采用血球计数板计数;液砷浓度采用次亚磷酸盐滴定法测定[12];多糖含量采用苯酚−硫酸法测定[13],并使用TU−1901紫外可见分光光度计测定吸光度,根据标准曲线计算含量;多糖的结构分析采用Spectrum One红外光谱仪扫描,固体样品采用KBr压片。
2 结果与讨论
2.1 pH的变化
细菌氧化含砷金精矿过程中,测定各个体系中pH的变化结果如图2示。由图2可知,在0~8 d内,0#对照体系因为没有矿物的氧化反应,pH稳定在 1.73左右;在含矿体系中,0~1 d内由于细菌需要适应矿石与菌液组成的新环境,矿物氧化处于延滞状态,pH无明显变化;1~3 d内由于细菌氧化矿石使得体系中的 H+迅速变化,且产 H+量高于耗 H+量,进而 1#~4#体系的 pH迅速降低,由原来的 1.70~1.80降低到1.55~1.65;在 3~8 d内体系中的 H+产耗平衡,此间0#~4#体系的 pH 由大到小的顺序为 0#、1#、2#、3#和4#,即矿浆浓度越高,pH越低。
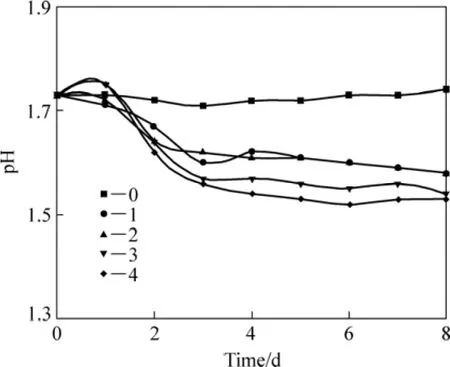
图2 含砷金精矿生物氧化过程中pH随时间的变化Fig.2 Variation pH value of with time during arsenic-bearing gold concentrate biooxidation process
2.2 电压的变化
图3所示为细菌浸矿过程中各个体系的电压变化结果。由图3可知,在0#对照体系中,0~4 d内电压基本无变化,5 d后由于体系中Fe3+生成沉淀,电压开始下降。1#~4#体系中,0~1 d内由于矿物溶解释放大量的Fe2+,溶液中Fe3+/Fe2+电位的比值减小,使得各体系的电压均降低到550 mV以下,且矿浆浓度越大,电压降低幅度越大;在随后的1~3 d内,体系中的Fe2+迅速氧化为Fe3+,溶液中Fe3+/Fe2+电位的比值急剧增大,因而1#和2#体系的电位迅速升高,且在第3 d达到650 mV以上;同样在第4 d 3#和4#体系的电位也升高到650 mV以上。整个氧化过程中,电位由大到小的顺序为0#、1#、2#、3#和4#,即矿浆浓度越高,Fe2+溶出量越多,电位上升速度越慢,可达最高电位越低。

图3 含砷金精矿生物氧化过程中电位随时间的变化Fig.3 Variation of potential with time during arsenic-bearing gold concentrate biooxidation process
2.3 As离子浓度的变化
矿物氧化过程中As(Ⅲ)和As(Ⅴ)的变化趋势如图4和5所示。分析两图发现,在细菌氧化的第1 d,由于Fe2+富集、电压下降,体系中的As(Ⅲ)也随之快速蓄积;因而在第1 d,1#、2#和3#体系的As(Ⅲ)浓度达到最大值,分别为 0.26、0.42和0.73 g/L,4#体系的As(Ⅲ)浓度则在第2 d后达到0.90 g/L。在氧化1~4 d后,由于1#~4#体系的电压由500 mV迅速上升到650 mV,体系中Fe3+浓度急速升高,As(Ⅲ)借此可迅速被Fe3+氧化成 As(Ⅴ);进而体系中的 As(Ⅲ)浓度明显下降,相应的As(Ⅴ)浓度快速上升。在氧化过程的4~8 d,电压趋于平稳,Fe3+浓度变化较小,As(Ⅲ)和 As(Ⅴ)的浓度变化也随之减缓。氧化过程中砷离子浓度的变化速率由大到小的顺序为 4#、3#、2#和 1#,即矿浆浓
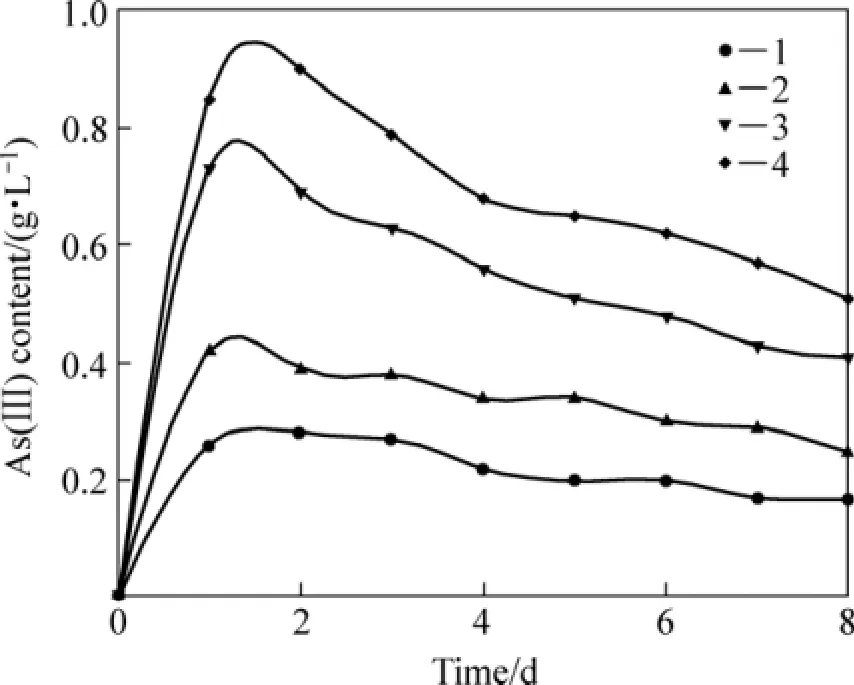
图4 含砷金精矿生物氧化过程中As(Ⅲ)浓度随时间的变化Fig.4 Variation of As(Ⅲ) concentration with time during arsenic-bearing gold concentrate biooxidation process
图5 含砷金精矿生物氧化过程中 As(Ⅴ)浓度随时间的变化
Fig.5 Variation of As(Ⅴ) concentration with time during arsenic-bearing gold concentrate biooxidation process度越大,可提供的Fe3+浓度越高,As(Ⅲ)氧化成As(Ⅴ)的速率越快。
2.4 细菌数量的变化
图6所示为细菌在浸出金精矿过程中细菌数量随时间的变化。在0#对照体系中,由于没有加入矿物,细菌没有新营养源可利用,菌体一直处于衰亡状态,因而菌数缓慢减少。含矿体系中,随矿浆浓度的增大,细菌的对数生长期加长,菌体繁殖数量增多。在1#~4#体系中,细菌的生长行为可分为如下4个阶段:1) 延滞期。0~1 d细菌需要适应加入矿物的新环境,生长处于停滞状态,菌数无明显变化;2) 对数期。延滞期后,1#和2#体系中的细菌进入为期1 d的对数生长阶段,而在3#和4#体系中,因矿浆浓度提高,细菌可利用的营养物质增多,对数生长期则延长为2 d;3) 稳定期。在对数期后,各体系中的细菌均进入为期 4 d的稳定生长阶段,此时细菌的繁殖量等于死亡量,1#~4#体系中的细菌菌数分别稳定在 4.5×107、6.0×107、8.5×107、9.5×107cell/mL;4) 衰亡期和稳定期。由于可利用的营养物质耗尽,细菌因缺养而开始衰亡,菌数缓慢减少。

图6 含砷金精矿生物氧化过程中细菌数量随时间的变化Fig.6 Variation of bacterial count with time during arsenic-bearing gold concentrate biooxidation process
2.5 胞外聚合层中多糖含量的变化
2.5.1 单个菌体胞外聚合层中多糖含量的变化
单个菌体胞外聚合层中多糖含量的变化如图7所示。在0#对照体系中,细菌由于没有营养来源,处于自然衰亡状态,其胞外聚合层通过产生大量的多糖包裹菌体来抵御这种胁迫,所以多糖含量不断升高。1~4 d内,当外界pH、电压、砷离子浓度和菌数急剧变化时,1#~4#体系中细菌的多糖含量先减少后增大;4~6 d内,由于矿浆体系中各项指标稳定,细菌适应环境,多糖产量开始减少;6~8 d后,氧化过程结束,细菌的多糖产量也趋于稳定。纵向比较整个氧化过程,矿浆浓度越高,砷离子价态转化越快,单个菌体胞外聚合层中的多糖含量越少;以含量最高的第4 d为例,2#、3#、4#体系中多糖含量分别为 1#体系的 77.0%、53.9%、46.1%,均降低20%以上。

图7 含砷金精矿生物氧化过程中单个菌体胞外聚合层中多糖含量随时间的变化Fig.7 Variation of polysaccharide content of EPS in single thallus with time during arsenic-bearing gold concentrate biooxidation process
2.5.2 单位菌液胞外聚合层中多糖含量的变化

图8 含砷金精矿生物氧化过程中单位菌液胞外聚合层中多糖含量随时间的变化Fig.8 Variation of polysaccharide content of EPS in unit bacterial liquid with time during arsenic-bearing gold concentrate biooxidation process
单位菌液胞外聚合层中多糖含量的变化如图8所示。综合分析图6~8可知,0#对照体系中细菌数量不断减少,但单个菌体的多糖含量增多,使得单位菌液的多糖含量趋于稳定。1#~4#体系中,细菌数量在1~4 d时迅速增多,多糖得到积累,使得单位菌液胞外聚合层中多糖含量增高,均达到11 mg/mL以上;4~6 d时,细菌数量稳定,单个菌体的多糖含量减少,部分多糖又吸附到矿物表面参与矿物的氧化反应,使得单位菌液胞外聚合层中多糖含量降低。
2.6 细菌胞外聚合层中多糖的红外光谱分析
以0#和2#体系中的多糖为例,红外光谱分析无矿和含矿体系下细菌胞外聚层中多糖的结构,结果如图9所示。0#和2#体系中的多糖均含有波数为 1 633.09 cm−1、1 405.46 cm−1和 1 000~700 cm−1的伸缩振动C=C键、弯曲振动C—H键和弯曲振动=C—H键;且在700 cm−1处,两种体系下多糖的C—H键约偏移15 cm−1,推测这种偏移是由含矿体系中的多糖与矿浆中的离子结合而引起的。
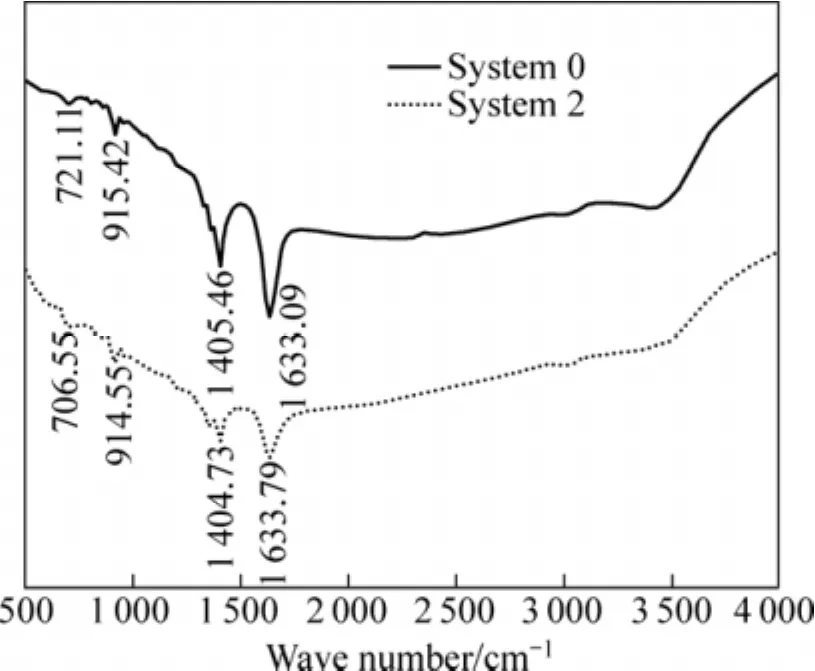
图9 含砷金精矿生物氧化过程中细菌胞外聚合层中多糖的红外光谱Fig.9 Infrared spectra of polysaccharide in EPS during arsenic-bearing gold concentrate biooxidation process
2.7 讨论
综合分析pH、电压、砷离子浓度、细菌数量、多糖含量以及多糖结构之间的相互关系,推测胞外聚合层中的多糖在浸矿细菌氧化含砷金精矿的不同阶段具有如下作用。
1) 延滞期的保护作用。由于砷酸盐是磷酸盐的类似物,可被细菌的磷酸盐转移系统所转移[14],干扰细胞内磷酸化中间体的形成,使细菌表现出“磷酸盐饥饿”的症状[15];因而含砷金精矿氧化初期,即当pH由1.75降至1.55、电压由600 mV降至500 mV、As(Ⅲ)浓度迅速升高,细菌处于生长延滞期时,细菌通过外聚合层中多糖的转化或转移作用,将砷离子甲基化或沉淀,从而降低菌体周围有害离子的浓度,限制有害离子的跨膜吸收,进而避免细菌受侵害。
2) 对数期的蓄积作用。矿浆pH稳定在1.55~1.65、电压由 500 mV 升至 650 mV,As(Ⅲ)快速氧化为As(Ⅴ)、总砷毒性降低,细菌处于对数生长期时,细菌数量增多,胞外聚合层中多糖得到积累、含量增高,为参与矿物氧化做准备。
3) 稳定期的氧化作用。矿浆pH约为1.50、电压约为650 mV,As(Ⅲ)和As(Ⅴ)比例一定,细菌处于稳定生长期时,菌体逐步吸附到矿石表面,胞外聚合层中的多糖开始参与矿物的氧化反应、逐渐消耗,含量因此降低。
4) 衰亡期的维持作用。矿物氧化结束,细菌缺少可利用的营养物质,开始死亡时,细菌胞外聚合层可产生大量的多糖,保护菌体生存的微环境,以便延缓自身的衰亡。
3 结论
1) 在无矿体系中,细菌没有营养物质可利用,处于自然衰亡状态,数量不断减少;细菌通过维持单位菌液胞外聚合层中多糖含量的恒定来适应不利的生存环境。
2) 在含砷金精矿的细菌氧化过程中,胞外聚合层中的多糖具有保护、积累、氧化和稳定的作用;当电压由500 mV攀升到650 mV、As(Ⅲ)向As(Ⅴ)快速转化时,单个细菌可通过消耗胞外聚合层中的多糖来适应pH、电压等外界环境的变化,抵御砷离子的毒害;当电压稳定在650 mV、砷离子价态转化减缓时,细菌胞外聚合层分泌的多糖可参与矿物的氧化反应。
3) 在含砷金精矿的细菌氧化过程中,矿浆浓度越高,砷离子价态转化速率越快,单个菌体胞外聚合层中的多糖含量越少;即细菌可通过改变胞外聚合层中多糖的含量来实现自身的应激反应和解毒功能。
REFERENCES
[1] 佟琳琳, 姜茂发, 杨洪英, 殷书岩. 湖南某高砷难处理金精矿的细菌氧化−氰化提金实验研究[J]. 贵金属, 2008, 29(1):15−18.TONG Lin-lin, JIANG Mao-fa, YANG Hong-ying, YIN Shu-yan.Experimental investigation on gold extraction from high-As concentrate in Hunan province through bio-oxidation/cyanadation[J]. Precious Metals, 2008, 29(1): 15−18.
[2] 张立明, 周凌锋, 孙德四. 难浸金矿石细菌氧化浸出的研究现状及发展方向[J]. 黄金, 2005, 26(6): 40−43.ZHANG Li-ming, ZHOU Ling-feng, SUN De-si. A review of refractory gold ores pretreated by bio-oxidation[J]. Gold, 2005,26(6): 40−43.
[3] 刘 军. 难浸硫化金矿的微生物氧化预处理[J]. 化工矿产地质, 2005, 27(4): 245−247.LIU Jun. The microbial oxidization pre-treatment for unleachable sulfured gold mine[J]. Geology of Chemical Minerals, 2005, 27(4): 245−247.
[4] EHRLICH H L. Past presentand future of biohydrometallurgy[J].Hydrometallurgy, 2001, 59(2/3): 127−134.
[5] AKCIL A. Potential bioleaching developments towards commercial reality: Turkish metal mining’s future[J]. Minerals Engineering, 2004, 17(3): 477−480.
[6] CABRAL T, IGNATIADIS I. Mechanistic study of the pyrite solution interface during the oxidative bacterial dissolution of pyrite (FeS2) by using electrochemical techniques[J].International Journal of Mineral Processing, 2001, 62(1/4):41−64.
[7] TPIRE D R, DAVE S R. Bioleaching process for Cu-Pb-Zn bulk concentrate at high pulp density[J]. Hydrometallurgy, 2004, (75):37−43.
[8] WATLING H R. The bioleaching of sulphide minerals with emphasis on copper sulphides—A review[J]. Hydrometallurgy,2006, 84(1/2): 81−108.
[9] 訾建威, 杨洪英, 巩恩普, 杨 立, 赵玉山, 范有静. 细菌氧化预处理含砷难处理金矿的研究进展[J]. 贵金属,2005, 26(1):66−70.ZI Jian-wei, YANG Hong-ying, GONG En-pu, YANG Li, ZHAO Yu-shan, FAN You-jing. A review on biooxidation pretreatment of arsenic-bearing refractory gold ores[J]. Precious Metals, 2005,26(1): 66−70.
[10] ARREDONDO R, GARCIA A, JEREZ C A. Partial removal of lipopolysaccharide from Thiobacillus ferrooxidans affects its adhesion to solids[J]. Appl Environ Microbiol, 1994, 60(8):2846−2851.
[11] SAND W, GEHRKE T, JOZSA P G, SCHIPPERS A.(Bio)chemistry of bacterial leaching-direct vs. indirect bioleaching[J]. Hydrometallurgy, 2001, 59(2): 159−175.
[12] 孙淑媛, 孙龄高, 殷齐西, 符 斌. 矿石及有色金属分析手册[M]. 北京: 冶金工业出版社, 1990: 112−113.SUN Shu-yuan, SUN Ling-gao, YIN Qi-xi, FU Bin. The mineral and nonferrous metals analysis manual[M]. Beijing: Metallurgy Industry Publishing Company, 1990: 112−113.
[13] 郭金龙, 陈有君, 孙国琴, 郭九峰, 王蕴华, 朱晓清, 聂奇森.苯酚-硫酸法测定杏鲍菇多糖方法的研究[J]. 食品科学, 2008,29(12): 555−558.GUO Jin-long, CHEN You-jun, SUN Guo-qin, GUO Jiu-feng,WANG Yun-hua, ZHU Xiao-qing, NIE Qi-sen. Study on phenol-sulfuric acid method for determination of polysaccharide content in Pleurotus eryngii[J]. Food Science, 2008, 29(12):555−558.
[14] WILLSKY G R, MALAMY M H. Effect of arsenate on inorganic phosphate transport in Escherichia coli[J]. J Bacteriol,1980, 144(1): 366−374.
[15] KAUR P, ROSEN B P. Plasmid-encoded resistance to arsenic and antimony[J]. Plasmid, 1992, 27(1): 29−40.
Role of extracellular polymers of bacteria during arsenic-bearing gold concentrate biooxidation process
FU Yao, YANG Hong-ying, CUI Ri-cheng, FAN You-jing, WANG Cheng
(School of Materials Science and Metallurgy, Northeastern University, Shenyang 110004, China)
The change of the physicochemical indexes was researched to explore the role of the extracellular polymers in the biooxidation process of arsenic-bearing gold concentrate. The pH value, potential of hydrogen,arsenic ion concentration, bacterial count, polysaccharide content and chemical bond in the extra cellular polymers(EPS) were tested. The results show that the bacterium exhausts its polysaccharide to resist the toxicity of arsenic ion when the potential increases from 500 mV to 650 mV and As(Ⅲ) transfers to As(Ⅴ) rapidly, and the bacteria oxidizes the concentrate by its polysaccharide when the potential remains 650 mV and the conversion of the arsenic ion retards. Under the stress of arsenic ion, the polysaccharide content of extracellular polymers decreases by more than 20%, and the bacterium changes its polysaccharide content to prevent the toxic ions.
arsenic-bearing gold concentrate; bacteria metallurgy; extracellular polymers; polysaccharide
TF80
A
1004-0609(2010)10-2057-06
国家高技术研究发展计划资助项目(2006AA06Z127);国家自然科学基金资助项目(50674029;50874030);高等学校博士学科点专项科研基金资助项目(20060145015);中央高校基本科研业务费专项资金资助项目(N090602010)
2009-12-31;
2010-05-20
杨洪英,教授,博士;电话:024-83680373;E-mail:yanghy@smm.neu.edu.cn
(编辑 龙怀中)

