肿块型慢性胰腺炎11例的临床及影像学特征
徐桂芳 邹晓平 张伟杰 樊祥山 诸葛宇征 张丽莉
·论著·
肿块型慢性胰腺炎11例的临床及影像学特征
徐桂芳 邹晓平 张伟杰 樊祥山 诸葛宇征 张丽莉
目的分析肿块型慢性胰腺炎的临床和影像学特点,并与胰腺肿瘤相鉴别。方法回顾性分析11例肿块型慢性胰腺炎的临床、影像学、实验室和病理特征。结果肿块型慢性胰腺炎多见于老年人、男性患者,临床主要表现为梗阻性黄疸和腹部不适。血清CA19-9水平可轻度升高,通常<100 U/ml,较胰腺癌低。B超对肿块型CP诊断的准确率仅18.2%,只能作为初筛手段;CT的诊断准确率为45.5%,表现为主胰管及其分支呈球样扩张,可见胰腺假性囊肿和钙化;MRCP和EUS均可见胆总管、胰管不规则扩张,表现与胰腺癌相似;ERCP可清楚显示胰胆管的病变部位、梗阻性质、胰胆管的狭窄及扩张情况等,与CT检查结合,对鉴别肿块型CP与胰头癌有重要意义。根据组织病理检查,少部分肿块型慢性胰腺炎属于自身免疫性胰腺炎。结论肿块型慢性胰腺炎临床和影像学特征与胰腺癌相似,需结合病史、临床表现、实验室及影像学检查、组织病理综合判断。
胰腺炎,慢性; 胰腺肿瘤; 诊断,鉴别; 回顾性研究
肿块型慢性胰腺炎在临床表现和影像学特点上与胰腺癌相似,术前难以鉴别,容易混淆,因此了解其临床特点,对提高术前诊断及指导正确治疗具有重要价值[1-2]。本文总结了近年来我院诊治的11例肿块型慢性胰腺炎的临床特点及影像学特征,以提高对该疾病的认识。
材料和方法
一、研究对象
2002年1月至2010年1月南京大学医学院附属鼓楼医院临床诊断为胰腺癌但手术及术后病理证实为肿块型慢性胰腺炎患者11例。
二、研究方法
回顾性分析11例患者的临床、影像学、实验室和病理特征。11例患者均被高度怀疑为胰腺癌,行手术治疗。术前均进行肝功能、肿瘤标志物和血糖等实验室检查;均行腹部超声和CT检查,7例行MRCP检查,5例行内镜超声(EUS)检查,6例行内镜下逆行胰胆管造影(ERCP)检查,2例行胆管内镜超声(IDUS)。慢性胰腺炎(CP)的诊断根据术后病理证实。5例患者术后病理组织行IgG4免疫组化检测。自身免疫性胰腺炎诊断参考日本胰腺病学会自身免疫性胰腺炎诊断标准[3],排除自身免疫性疾病的胰腺累及患者和酒精性、胆源性慢性胰腺炎患者。
三、统计学处理
结 果
一、主要临床表现和实验室检查
本组资料男10 例,女1例,年龄43~76岁,平均59岁。病程15 d~2年,平均6.2个月。以上腹痛为主要表现者4例(36.4%),皮肤巩膜黄染3例(27.3%),上腹痛伴皮肤巩膜黄染者3例(27.3%),进行性消瘦、乏力、腹胀1例(9.1%)。症状持续时间20 d~2年。1例患者因胰管结石曾行胰管、空肠吻合术;1例2型糖尿病、高血压病史者因有胆囊结石曾行胆囊切除;1例有饮酒史;1例有2型糖尿病病史,并曾患“霍奇金淋巴瘤”,经化疗及放射治疗后未再复发。3例(27.3%)患者出现上腹部压痛,6例(45.5%)出现皮肤巩膜轻、中度黄染,3例(27.3%)患者体检无阳性体征。实验室检查:4例患者CA19-9升高,分别为51.97 U/ml、82.86 U/ml、113.9 U/ml和136.8 U/ml,平均为(98.38±36.95)U/ml。2例CA50升高,分别为25.43 U/ml 和124.56 U/ml。CA125、AFP、CA724均为阴性。肝功能异常6例(54.6%)。血清淀粉酶升高3例(27.3%),分别为45.5 U/L、96 U/L、151 U/L。空腹血糖水平升高5例(45.5%),分别为6.71 mmol/L、6.91 mmol/L、6.85 mmol/L、7.7 mmol/L、7.8 mmol/L。血三酰甘油水平升高5例(45.5%)。血CRP水平升高1例(9.1%)。甲状腺功能低下伴角膜荧光双(+)1例(9.1%)。
二、影像学检查
1.B超表现: 9例发现胰腺占位,胰腺形态不规则,边缘不光整;8例肿块位于胰头部伴肝内外胆管扩张,其中6例表现为胰头部低回声包块,2例为胰头部囊实性包块;1例肿块位于胰腺体尾部,表现为囊实性占位,内见多发无回声区。2例诊断为CP,表现为胰腺形态欠规则,饱满不光整,胰管串珠状改变,胰管多发结石,胰管扩张,胆总管上段轻度扩张。B超诊断的准确率为18.2%。
2.CT表现:6例诊断为胰腺占位,表现为胰头部低密度影,5例伴肝内外胆管扩张,2例伴胆囊增大,1例淋巴结肿大。5例诊断为CP,1例见胰管扩张、胰管多发结石、假性囊肿形成,1例见胰尾部假性囊肿,1例胰头部假性囊肿伴钙化,1例见胰腺钩突增大、肝总管及肝内胆管扩张、胆囊增大,1例胆总管下段扩张伴多发结石、胰头部胆总管扩张,伴多发结石影、胰管扩张。CT术前诊断的准确率为45.5%,高于B超,但无统计学差别(χ2=1.838,P=0.360)。
3.MRCP表现:行MRCP检查的7例中,5例诊断为胰腺占位,其中2例胰头实质性占位伴肝内外胆管扩张;1例胰腺体尾部增粗明显,T1W1及T2W1信号不均匀减低,占位可能;1例胰头可见两个类圆形长T1长T2信号影,境界清晰,未见明显强化,胰管扩张,胰头多发囊性占位伴胰管扩张;1例胰头钩突处占位伴肝内外胆管扩张,胆总管下段狭窄,胆总管下段癌,胆囊增大。另外2例表现:1例胆总管下段占位,伴肝内外胆管扩张;1例胆总管增粗,直径约1.0 cm,胰管亦见增粗,最宽处0.9 cm,边缘不光整,胰管内长T1长T2信号,胆总管及胰管扩张。
4.EUS表现:5例患者行EUS检查,3例表现为胰头部低回声包块,内部回声不均,边界不清晰,近端胰管扩张,其中1例见胆囊壁增厚,呈双边影,1例见胆总管扩张,1例见胆总管及左右肝管扩张。1例胰头部见囊实性包块(图1a),内部回声不均匀,周围无肿大淋巴结,近端胰管(图1b)、胆总管扩张,病变侵犯十二指肠壶腹部。1例胰体尾部见低回声包块(图1c),内部回声不均匀,有液性暗区,边界不清晰,近端胰管无扩张,脾静脉受侵犯,胆总管及肝内胆管无扩张,周围有肿大淋巴结(图1d)。
5.ERCP表现:6例行ERCP检查,1例近端胰管显影,胰腺头、体不规则形,远端胰管不显影,胰管内多发结石。4例胆总管下段狭窄,1例仅见胆总管下段狭窄;3例伴近端肝内胆管扩张,其中1例行IDUS示胆总管下段均匀性狭窄,另2例见近端胆总管扩张。1例胰管显影不全,胰头部胰管轻度扩张,胆总管下段狭窄,近段胆管轻度扩张(图2),将UM-G20-29R小探头经导丝插至胆管下段,可见胆管狭窄,胆管壁可见不规则低回声(图3)。

图1EUS检查:a:胰头部囊实性包块,b:胰管扩张,c:胰体尾部见低回声包块,d:淋巴结肿大
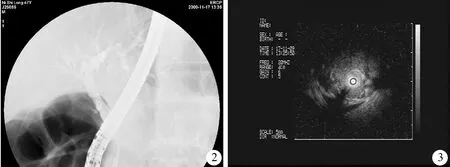
图2ERCP检查:X线片见胆总管下段狭窄,伴肝内胆管扩张图3IDUS示胆总管下段狭窄
三、手术方式
3例胰体尾部肿块分别行胰体尾+脾脏+结肠脾曲切除术、胆总管+空肠Ronx-en-Y吻合术;1例整个胰腺呈冰冻样,无法手术,仅取病理活检;1例全胰腺质硬,胰腺多发肿块型占位,仅切取部分组织活检;6例肿块位于胰头部,行胰十二指肠切除术。
四、病理检查
11例患者胰腺组织标本镜下可见胰腺内腺泡减少或消失,纤维组织显著增生伴慢性炎症细胞浸润,7例见大量淋巴细胞及浆细胞浸润,局部形成淋巴滤泡,5例行IgG4染色,检测到IgG4阳性浆细胞。1例诊断为自身免疫性胰腺炎。4例伴有胰周、腹腔淋巴结肿大者,病理结果提示反应性增生。6例伴慢性胆囊炎,5例伴慢性胆管炎,3例伴慢性小肠炎,3例伴慢性胃炎,3例伴慢性十二指肠炎。
五、术后随访结果
术后11例患者均接受随访,随访时间为2~75个月。1例患者术后50 d出现胃肠吻合口出血,再次行残胃大部切除+胃空肠Roux-en-Y吻合术,术后患者消化不良。其他患者术后恢复较好,有些术后有轻微腹泻症状,口服得每通后症状缓解。
讨 论
肿块型CP由胰腺慢性炎症明显增生形成,多发生于胰头部。因其临床特点、影像学检查与胰腺癌相似,术前难以区分,但两者预后差别很大。因此,术前明确鉴别诊断,选择正确、有效的治疗方法,对患者的生存及预后具有重要意义。
肿块型CP和胰腺癌通常均以梗阻性黄疸、胰腺肿块和腹痛为主要表现,均可表现为腹痛、厌食、恶心呕吐及体重减轻等症状。本组11例患者中6例次患者出现梗阻性黄疸,但黄疸多表现为轻、中度,与胰头癌的进行性加重有所不同。此外,肿块型CP多伴有胆道结石、胆系感染、急性胰腺炎、长期大量饮酒史、胰腺外伤史、长期CP、糖尿病等病史,而胰腺癌可以不伴有这些病史。本组1例伴胆囊结石、糖尿病,1例有饮酒史,1例患有2型糖尿病,这些在鉴别诊断中具有一定价值。
胰腺癌患者血CA19-9和碱性磷酸酶(AKP)水平显著升高[4],而肿块型CP患者的血CA19-9升高通常<100 U/ml。本组4例患者CA19-9轻度升高,在100 U/ml左右。因此,CA19-9可以作为两者的鉴别点之一。
影像学表现不典型是导致术前难以诊断的主要原因。B超对肿块型CP诊断的特异性较差,本组仅2例患者B超诊断为CP,只能作为初筛手段。肿块型CP的CT表现为肿块密度较均匀,边界清楚,增强后呈等密度或略低密度,肿块内部可伴有囊状低密度、主胰管及其分支呈串珠样扩张、胰腺钙化等征像。本组5例CT诊断为CP,在几种影像学方法中诊断的准确率最高,对区别良恶性疾病具有重要价值。肿块型CP的MRCP表现为胰管呈粗细不均的不规则扩张、合并有胰管结石、胆总管在病灶区逐渐变细或同时有胆总管结石等,而胰腺癌表现为胰管光滑的连续性扩张,并在肿块处截断。本组7例行MRCP检查,5例提示胰腺占位,1例提示胆总管占位,1例仅表现为胆总管和胰管扩张,对鉴别胰腺癌和肿块型CP较为困难。Fattahi等[5]认为,胰腺弥散加权成像在鉴别胰腺癌和肿块型胰腺炎中具有一定价值,因胰腺癌表观弥散系数显著低于肿块型CP。Kuroki等[6]认为,MRI时间-信号强度曲线(time-signal intensity curve,TIC)对鉴别肿块型CP和胰腺癌具有一定价值。注射造影剂后,肿块信号缓慢升高,后又缓慢下降,提示肿块为胰腺纤维化,而非肿瘤。EUS对鉴别胰腺癌和肿块型CP具有一定价值,而且可以在EUS引导下进行细针穿刺活检。ERCP检查可清楚显示胰胆管的病变部位、梗阻性质、胰胆管的狭窄及扩张情况、结石等。ERCP还可刷取胰管壁细胞、抽取胰液行细胞学检查及K-ras突变基因检测。我们的经验认为,ERCP 结合CT 检查,对鉴别肿块型CP与胰头癌有重要意义。
此外,还应注意肿块型CP与自身免疫性胰腺炎(AIP)的鉴别。两者均为CP特殊类型,当后者以肿块型为主要表现时难以鉴别。AIP很少发生胰腺假性囊肿和胰腺钙化,只有极少部分患者在疾病晚期出现[7]。检测IgG4浆细胞对诊断AIP有一定意义,但并非AIP特异性指标[8]。本组11例患者中5例检测IgG4浆细胞,4例阳性,但只有1例最终诊断为AIP,激素治疗有效。近来学者采用壶腹部IgG4/IgG浆细胞比值来鉴别AIP和胰腺其他肿块型病变,AIP的IgG4/IgG比值较其他类型高,诊断的敏感性和特异性分别为86%和95%[9]。如果CT表现为门脉期胰腺均匀强化、无近端胰腺萎缩、胰管扩张<5 mm,则倾向于AIP,需要进行病理学检查以明确,从而避免手术治疗[10]。
总之,肿块型CP在临床特点和影像学表现方面与胰腺癌极为相似,为降低误诊率,需要结合患者既往史、临床表现、实验室检查、影像学检查综合考虑。CA19-9是鉴别两者重要的指标,CT检查的鉴别诊断价值较高,EUS引导下穿刺活检可获得组织病理诊断。由于肿块型CP有癌变倾向,当与胰腺癌鉴别困难时,应尽早剖腹探查。
[1] Kim T,Murakami T,Takamura M,et al.Pancreatic mass due to chronic pancreatitis:correlation of CT and MR imaging features with pathologic findings.AJR Am J Roentgenol,2001,177:367-371.
[2] Gabata T,Sanada J,Kobayashi S,et al.Tumor-associated focal chronic pancreatitis from invasion of the pancreatic duct by common bile duct carcinoma:radiologic-pathologic correlation.Abdom Imaging,2003,28:378-380.
[3] Kamisawa T,Okazaki K,Kawa S.Diagnostic criteria for autoimmune pancreatitis in Japan.World J Gastroenterol,2008,14:4992-4994.
[4] Lee H,Lee JK,Kang SS,et al.Is there any clinical or radiologic feature as a preoperative marker for differentiating mass-forming pancreatitis from early-stage pancreatic adenocarcinoma? Hepatogastroenterology,2007,54:2134-2140.
[5] Fattahi R,Balci NC,Perman WH,et al.Pancreatic diffusion-weighted imaging (DWI):comparison between mass-forming focal pancreatitis (FP),pancreatic cancer (PC),and normal pancreas.J Magn Reson Imaging,2009,29:350-356.
[6] Kuroki T,Tajima Y,Tsuneoka N,et al.Utility of preoperative dynamic magnetic resonance imaging of the pancreas in diagnosing tumor-forming pancreatitis that mimics pancreatic cancer:report of a case.Surg Today,2010,40:76-78.
[7] Takayama M,Hamano H,Kawa S,et al.Recurrent attacks of autoimmune pancreatitis result in pancreatic stone formation.Pancreatology,2004,4:297.
[8] Kojima M,Sipos B,Klapper W,et al.Autoimmune pancreatitis:frequency, IgG4 expression and clonality of T and B cells.Am J Surg Pathol,2007,31:521-528.
[9] Sepehr A,Mino-Kenudson M,Ogawa F,et al.IgG4+to IgG+plasma cells ratio of ampulla can help differentiate autoimmune pancreatitis from other "mass forming" pancreatic lesions.Am J Surg Pathol,2008,32:1770-1779.
[10] Chang WI,Kim BJ,Lee JK,et al.The clinical and radiological characteristics of focal mass-forming autoimmune pancreatitis:comparison with chronic pancreatitis and pancreatic cancer.Pancreas,2009,38:401-408.
2010-03-17)
(本文编辑:屠振兴)
Clinicalandimagingfeaturesofmassformingchronicpancreatitis
XUGui-fang,ZOUXiao-ping,ZHANGWei-jie,FANXiang-shan,ZHUGEYu-zheng,ZHANGLi-li.
DepartmentofGastroenterology,DrumTowerHospital,MedicalSchool,NanjingUniversity,Nanjing210008,China
ZOUXiao-ping,Email:zouxiaoping795@hotmail.com
ObjectivesTo investigate the clinical and imaging features discriminating mass forming chronic pancreatitis (CP) from pancreatic carcinoma.MethodsThe clinical, radiologic, laboratory and pathologic profiles of eleven patients with mass forming CP were reviewed retrospectively.ResultsThe patients with mass forming CP were predominantly older, male, and presented with obstructive jaundice or abdominal symptoms. Serum level of CA19-9 was slightly elevated, generally below 100 U/ml, which was lower than that of pancreatic carcinoma. The diagnostic accuracy of B-ultrasound for mass forming CP was only 18.2% and it could only be the screening method; the diagnostic accuracy of CT was 45.5%, and the main CT features included dilation of main pancreatic duct and the branches, as well as pancreatic pseudocysts or calcification. The findings of MRCP and EUS were irregular dilation of main pancreatic duct and common bile duct, which were similar to pancreatic carcinoma. ERCP could provide imaging characteristics of biliary and pancreatic duct, and the nature of obstruction, the stricture and dilation of biliary and pancreatic duct. When combined with CT scan, ERCP was useful for differentiation from pancreatic head cancer. According to histopathology, a few mass forming CP was autoimmune pancreatitis.ConclusionsMass forming CP is associated with clinical and radiologic features that are similar to those of pancreatic carcinoma. It is necessary to carefully evaluating clinical and imaging findings, laboratory findings and histopathological examinations.
Pancreatitis, chronic; Pancreatic neoplasms; Diagnosis,differential; Retrospective studies
10.3760/cma.j.issn.1674-1935.2010.04.006
210008 江苏南京,南京大学医学院附属鼓楼医院消化科(徐桂芳、邹晓平、诸葛宇征、张丽莉),病理科(樊祥山);
解放军第101医院普外科(张伟杰)
邹晓平,Email:zouxiaoping795@hotmail.com

