口蹄疫病毒突破宿主细胞天然免疫应答的机制
张克山,尚佑军,郑海学,靳 野,何继军,刘艳红,刘湘涛
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室农业部畜禽病毒学重点开放实验室 国家口蹄疫参考实验室,甘肃兰州 730046)
天然免疫又称为非特异性免疫、固有免疫是机体与生俱来的抵抗体外病原体侵袭、清除体内抗原性异物的第一道屏障[1]。细胞天然免疫是机体天然免疫的关键组成部分,随着人们对巨噬细胞、NK细胞及树突状细胞(DCs)等天然免疫细胞的深入研究,加上天然免疫具有即时性且缺乏记忆性的特点,天然免疫得到越来越广泛的重视和深入的研究。病毒成功侵入机体必须抑制甚至破获宿主的天然免疫应答以争取获得足够的时间去复制并传播到其他易感细胞、宿主或者逃避宿主的免疫监视进入潜伏感染状态[2]。在此过程中,病毒往往采取以下措施来抵御机体的细胞免疫:减少CD8+细胞毒性T淋巴细胞的数量、阻止病毒的抗原多肽递呈于1型主要组织相容性复合物(MHC-1)等[3]。在某些急性感染过程病毒通过编码同源性细胞因子或受体来抑制了补体介导的杀伤感染细胞或目标效应分子[4]。
FMDV作为一种急性、烈性、高度接触性的人畜共患传染病受到广泛关注。疫苗免疫能够激发机体产生特异性免疫应答,在预防和控制口蹄疫过程中扮演着十分重要的角色而且有数百年的研究历史[5]。口蹄疫特异性免疫具有针对性和记忆性,被认为是机体抗FMDV的主要免疫效应机制受到普遍关注。口蹄疫灭活疫苗免疫后4~7天可以检测到抗FMDV IgM,第14天能检测到抗口蹄疫病的IgG且持续数月之久[6],这对于传染性极强的FMDV而言足以引起大规模的暴发和流行。相对于特异性的免疫应答,天然免疫对抵抗FMDV感染研究相对较少,而非特异性免疫应答在抵御FMDV感染过程中发挥着重要的作用。相对于传染性极强的FMDV而言,初次感染FMDV的动物机体根本来不及产生特异性的体液免疫和细胞免疫,只能依赖天然免疫应答的即时性和非特异性来抗衡FMDV的入侵。FMDV突破细胞天然免疫屏障成功感染机体的机制至今不十分清楚。深层次的认识FMDV突破细胞天然免疫应答的机制,有助于人们开发快速的生物治疗药物应对口蹄疫的暴发和流行。本文将从以下4个方面对FMDV突破宿主宿主细胞天然免疫屏障的机制作以综述。
1 FMDV抑制宿主细胞转录和翻译系统
FMDV要在被感染动物体“嗜好”部位快速的复制以达到生存和致病的目的必须抵抗宿主细胞天然免疫系统[2]。与小核糖核酸病毒科的其他病毒一样,FMDV侵入机体细胞后关闭了宿主细胞的转录系统和“帽子”依赖的翻译系统,使得病毒在组织细胞中能够快速有效的复制和传播。FMDV编码的4个结构蛋白,10个非结构蛋白以及这些蛋白在水解过程中产生的前体蛋白都对抵抗宿主细胞天然免疫应答起着一定作用[7]。
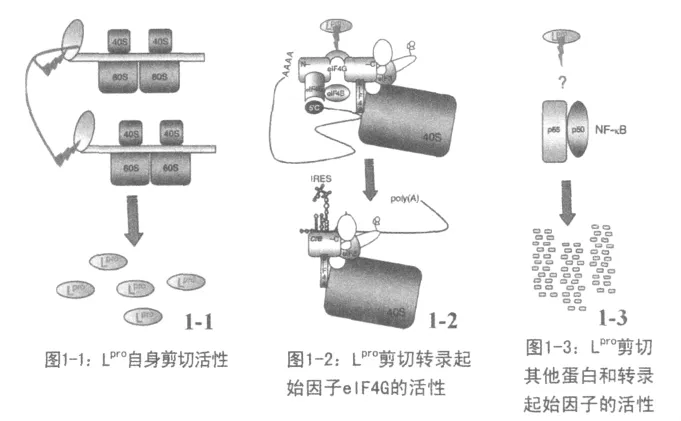
1.1 FMDV Lpro抑制宿主细胞的转录和翻译
Lpro具有木瓜蛋白酶活性[8],能够把自己编码的蛋白从FMDV整个ORF编码区剪切下来[9](图1-1);同时能够切割宿主翻译起始因子eIF4G而关闭宿主细胞“帽子”依赖的mRNA翻译机制[10]。就宿主cap-mRNA翻译系统而言,起始因子eIF4G作为一个桥梁,将mRNA和核糖体小亚基连接起来,对mRNA的翻译起到桥梁作用[11]。FMDV感染后,由于Lpro的存在导致cap-mRNA和核糖体小亚基连接的桥梁eIF4G被切割,从而宿主细胞翻译系统被关闭(图1-2);由于FMDV自身存在IRES结构,是一种非“帽子”依赖的mRNA翻译机制自身翻译不受eIF4G的影响[12]。研究表明在FMDV感染的细胞中PABP、PTB以及转录起始因子的亚单位 NF-kB、eIF3a、eIF3b都被 Lpro蛋白不同成都的水解[13](图1-3),eIF3a和 eIF3b是组成转录起始因子复合物的必须成分,这一现象的发现进一步佐证了Lpro的蛋白水解作用能够抑制宿主细胞的转录系统[6]。
1.2 FMDV 3Cpro对宿主细胞转录和翻译的负调控机制
FMDV 3C蛋白酶主要负责FMDV多聚蛋白的加工,同时能够从氨基端切割组蛋白H3[14]和转录起始因子eIF4A和eIF4GI等[15]。H3是染色体的成分之一与宿主细胞转录有关,组蛋白H3的降解使得宿主细胞染色体的转录受阻进而负调控了下游蛋白的表达[16]。因此FMDV 3Cpro的一定程度上抑制了宿主细胞的转录和翻译。
2 FMDV干扰宿主细胞分泌通路和MHC-I类分子的递呈
在FMDV感染的细胞中,病毒抗原肽和MHC-I形成的复合物递呈在细胞表面对于感染细胞的识别和清除起关键作用,大多数MHC-I能够在细胞内翻译和组装[17]并和内源性抗原肽形成复合物,这些复合物在内质网通过分泌途径展示在细胞表面[18]。递呈在细胞表面的病毒肽MHC-I复合物诱导了CTL活性,感染的细胞被清除,这一过程是宿主细胞抵抗FMDV入侵的有效手段[19]。研究证实FMDV病毒感染上皮细胞30min后能够检测到MHC-I分子的减少,感染后6小时和正常细胞相比约减少50%[20],同时宿主细胞中IL-6和 IL-8的表达量也有不同程度的下降[21]。根据内源性抗原加工和递呈的机制,由于MHC-I的减少导致FMDV抗原多肽递呈到效应细胞的数量明显减少,不能够诱导较强的CD8+T细胞反应,感染的细胞不能被及时清除或清楚的数量明显减少。研究表明I型干扰素具有广谱抗病毒作用是病毒感染机体后诱导产生的抑制病毒复制的主要物质之一,然而由于FMDV的感染,宿主细胞转录和翻译被大幅度抑制,I型干扰素的表达和分泌不同程度的降低使得FMDV得以在短期内大量复制。因此,FMDV感染后宿主MHC-I、I型干扰素及其细胞因子的减少是FMDV突破宿主细胞天然免疫的机制之一。
3 FMDV破坏天然免疫细胞功能和I型干扰素的产生
3.1 FMDV破环树突状细胞(DCs)
树突状细胞(DCs)是哺乳动物的一类专职抗原递呈细胞,在机体细胞免疫中扮演重要角色,在病毒感染的早期DCs除了能够递呈抗原外还能够产生大量的IFN-α和细胞因子以抑制病毒的增值[22]。研究表明DCs在FMDV感染后,其分泌I型干扰素和细胞因子的效率大大降低[23],但机理尚不清楚。
3.2 FMDV诱导淋巴细胞的减少和凋亡
在FMDV感染后,机体外周血淋巴细胞绝对数量出现了急性短暂性的减少[24],而且外周血淋巴细胞减少程度和FMDV致病力强度成正相关。在出现病毒血症时所有的T细胞和B细胞亚群都受到破坏[25],FMDV感染早期T细胞受到更为严重的破坏,被破坏的T淋巴细胞因不能分泌IFN-γ而成为功能缺陷性细胞且持续到感染后的第10天左右[26]。这种淋巴细胞的减少和破坏随着病毒血症的降低在感染后4~7天即可恢复到原来的水平。这一现象为FMDV在体内的复制和传播提供了绝佳的机会和临时性环境。FMDV感染能够诱发宿主细胞程序性死亡(细胞凋亡),这一现象已经在BHK-21[27]和猪体内[28]得到证实。BEI灭活的FMDV能够诱导未成熟的小鼠树突状细胞发生凋亡[29],同时被FMDV感染的细胞有自溶标记[30]。因此诱导宿主淋巴细胞减少和凋亡是FMDV抵抗天然免疫应答的又一手段。
3.3 FMDV破坏NK的功能
NK细胞是一种不需要抗原特异性刺激就能够发挥作用的天然杀伤细胞,它通过细胞应激信号识别被FMDV感染的细胞,从而自主发挥细胞毒活性。NK细胞是病毒突破宿主细胞天然免疫所破坏的目标细胞,研究表明FMDV感染早期能导致宿主NK细胞的功能异常[31]。猪感染FMDV的第2天NK细胞反应活性开始下降而且这种状态持续2~3天,感染动物血清中病毒滴度的升高和NK细胞杀伤活性的下降程度成正相关。
4 FMDV感染的免疫病理作用
由于FMDV前导蛋白L的存在,抑制了宿主细胞的转录与翻译。病毒感染细胞中MHC-I的表达受到严重抑制,根据内源性抗原加工和递呈的机理感染的细胞不能被及时清除。由于 I型干扰素 IFN-α、IFN-β 的表达受到抑制,干扰素介导的抗病毒活性受到抑制[32]。Lpro的存在下调了炎症基因的转录降解了NF-KB从而部分抑制了宿主细胞天然免疫[33]。FMDV 3C蛋白质酶的存在产生了和Lpro相类似的抑制效应,因此Lpro、3Cpro和其他蛋白的存在抑制了感染细胞炎性细胞因子表达和分泌[34],炎性细胞因子表达量的减少对树突状细胞(DCs)、巨噬细胞、NK细胞和T细胞活性提供了抑制信号。
总之,FMDV感染宿主细胞的初期必须通过各种手段来抵抗甚至破坏宿主细胞的天然免疫应答为病毒的侵入、复制和传播争取足够的时间和十分有利的条件。这些手段包括:(1)减少外周血中淋巴细胞的数量;(2)破坏天然免疫细胞的活性;(3)干扰细胞因子的分泌;(4)抑制宿主细胞的转录和翻译;(5)干扰FMDV抗原肽的递呈;(6)抑制I型干扰素的翻译和分泌。但是以下问题仍然需要认真思考和深入研究比如:病毒感染初期有哪些细胞参与了抗FMDV天然免疫应答?这些细胞在抗FMDV天然免疫应答中有何生活学特性?不同种属动物之间抗FMDV天然免疫应答机制有何区别?FMDV抵抗甚至破坏机体天然免疫应答对预防和控制口蹄疫有何启发?以上问题的回答和深入研究有助于人们开发快速的生物靶向治疗药物和新型疫苗以应对口蹄疫的暴发和流行。
[1] Freudenberg M A,Esser PR,Jakob T,et al.Innate and adaptive immune responses in contact dermatitis:analogy with infections[J].G Ital Dermatol Venereol,2009,144(2):173-185.
[2]Golde WT,Nfon CK,Toka FN.Immune evasion during foot-and-mouth disease virus infection of swine[J].Immunol Rev,2008,225:85-95.
[3] Takeuchi O,Akira S.Innate immunity to virus infection[J].Immunol Rev,2009,227(1):75-86.
[4]Vossen M T,Westerhout EM,Soderberg-Naucler C,et al.Viral immune evasion:a masterpiece of evolution[J].Immunogenetics,2002,54(8):527-542.
[5]Doel T R.FMD vaccines[J].Virus Res,2003,91(1):81-99.
[6]Grubman M J,Moraes M P,Diaz-San Segundo F,et al.Evading the host immune response:how foot-and-mouth disease virus has become an effective pathogen[J].FEMS Immunol Med Microbiol,2008,53(1):8-17.
[7]Mason P W,Grubman M J,Baxt B.Molecular basis of pathogenesis of FMDV[J].Virus Res,2003,91(1):9-32.
[8]Kleina L G,Grubman M J.Antiviral effects of a thiol protease inhibitor on foot-and-mouth disease virus[J].J Virol,1992,66(12):7168-7175.
[9] Strebel K,Beck E.A second protease of foot-and-mouth disease virus[J].J Virol,1986,58(3):893-899.
[10]Devaney M A,Vakharia V N,Lloyd R E,et al.Leader protein of foot-and-mouth disease virus is required for cleavage of the p220 component of the cap-binding protein complex [J].J Virol,1988,62(11):4407-4409.
[11]Hentze M W.eIF4G:a multipurpose ribosome adapter[J].Science,1997,275(5299):500-501.
[12]Kuhn R,Luz N,Beck E.Functional analysis of the internal translation initiation site of foot-and-mouth disease virus[J].J Virol,1990,64(10):4625-4631.
[13]Rodriguez Pulido M,Serrano P,Saiz M,et al.Foot-and-mouth disease virus infection induces proteolytic cleavage of PTB, eIF3a,b, and PABP RNA-binding proteins [J]. Virology,2007,364(2):466-474.
[14]Grigera P R,Tisminetzky S G.Histone H3 modification in BHK cells infected with foot-and-mouth disease virus[J].Virology,1984,136(1):10-19.
[15] Belsham G J,McInerney G M,Ross-Smith N.Foot-and-mouth disease virus3Cproteaseinducescleavage of translation initiation factors eIF4A and eIF4G within infected cells[J].JVirol,2000,74(1):272-280.
[16]Falk M M,Grigera PR,Bergmann I E,et al.Foot-and-mouth disease virus protease 3C induces specific proteolytic cleavage of host cell histone H3[J].J Virol,1990,64(2):748-756.
[17]Rock K L,York I A,Goldberg A L.Post-proteasomal antigen processing for major histocompatibility complex class I presentation[J].Nat Immunol,2004,5(7):670-677.
[18]Jensen PE.Recent advances in anti-gen processing and presentation[J].Nat Immunol,2007,8(10):1041-1048.
[19]Katz D R.Antigen presentation,antigen-presenting cells and antigen processing[J].Curr Opin Immunol,1988,1(2):213-219.
[20]Sanz-Parra A,Sobrino F,Ley V.Infection with foot-and-mouth disease virus results in a rapid reduction of MHC class I surface expression[J].JGen Virol,1998,79(3):433-436.
[21]Dodd D A,Giddings T H,Kirkegaard K.Poliovirus3A protein limitsinterleukin-6(IL-6),IL-8,and beta interferon secretion during viral infection[J].J Virol,2001,75(17):8158-8165.
[22]Colonna M,Krug A,Cella M.Interferon-producing cells:on the front line in immune responses against pathogens [J]. Curr Opin Immunol,2002,14(3):373-379.
[23]Guzylack-Piriou L,Bergamin F,Gerber M,et al.Plasmacytoid dendritic cell activation by foot-and-mouth disease virus requires immune complexes[J].Eur J Immunol,2006,36(7):1674-1683.
[24]Bautista E M,Ferman G S,Gregg D,et al.Constitutive expression of alpha interferon by skin dendritic cells confers resistance to infection by foot-and-mouth disease virus [J].J Virol,2005,79(8):4838-4847.
[25]Diaz-San Segundo F,Salguero FJ,de Avila A,et al.Selective lymphocyte depletion during the early stage of the immune response to foot-and-mouth disease virus infection in swine[J].JVirol,2006,80(5):2369-2379.
[26]Bautista EM,Ferman G S,Golde W T.Induction of lymphopenia and inhibition of T cell function during acute infection of swine with foot and mouth disease virus(FMDV)[J].Vet Immunol Immunopathol,2003,92(1-2):61-73.
[27]Peng J M,Liang S M,Liang C M.VP1 of foot-and-mouth disease virus induces apoptosis via the Akt signaling pathway[J].J Biol Chem,2004,279(50):52168-52174.
[28]Ku B K,Kim SB,Moon O K,et al.Role of apoptosis in the pathogenesis of Asian and South American foot-and-mouth disease viruses in swine[J].JVet Med Sci,2005,67(11):1081-1088.
[29]Jin H,Xiao C,Zhao G,et al.Induction of immature dendritic cell apoptosis by foot and mouth disease virus is an integrin receptor mediated event before viral infection[J].J Cell Biochem,2007,102(4):980-991.
[30] Donnell D M,Strand M R.Caste-based differences in gene expression in the polyembryonic wasp Copidosoma floridanum[J].Insect Biochem Mol Biol,2006,36(2):141-153.
[31]Finlay B B,McFadden G.Anti-immunology:evasion of the host immune system by bacterial and viral pathogens[J].Cell,2006,124(4):767-782.
[32]Chinsangaram J,Piccone M E,Grubman M J.Ability of foot-and-mouth disease virus to form plaques in cell culture is associated with suppression of alpha/beta interferon[J].JVirol,1999,73(12):9891-9898.
[33]de Los Santos T,Diaz-San Segundo F,Grubman M J.Degradation of nuclear factor kappa B during foot-and-mouth diseasevirusinfection[J].JVirol,2007,81(23):12803-12815.
[34]Moffat K,Howell G,Knox C,et al.Effects of foot-and-mouth disease virus nonstructural proteins on the structure and function of the early secretory pathway:2BC but not 3A blocks endoplasmic reticulum-to-Golgi transport[J].J Virol,2005,79(7):4382-4395.

