兔骨髓基质干细胞的分离培养及鉴定①
陈宣维 林文平 林建华
(福建医科大学附属第一医院骨科 福建 福州 350005)
骨髓基质干细胞(Marrow stromal cells,MSC) 是在骨髓中存在的一类具有多向分化潜能的细胞总称,可以向成骨系细胞、成软骨系细胞、成纤维系细胞、网状细胞、脂肪细胞和内皮细胞等转化[1],因其取材方便、损伤小、体外繁殖能力强的特点,已成为组织工程种子细胞的首选[2]。本实验目的在于建立兔MSC的体外培养体系,观察MSC的形态和生长情况,检测其表面标志,为以MSC为基础的骨组织工程提供实验基础。
1 材料与方法
1.1 材料及仪器
新西兰大白兔(福建医科大学大学动物中心);DMEM培养基(Gibco 公司);胎牛血清(Hyclon公司);0.25%胰酶加EDTA(Gibco公司);Percoll分离液(Sigma 公司);超净工作台(DCM-1300,苏州);自动台式离心机(LD25-2,北京);CO2孵箱(Thermo forma 311,美国);倒置显微镜(Olympus);透射电镜(HU-12A,日立公司);细胞培养板、培养瓶(Sigma 公司);荧光标记CD34-PE、CD45-FITC、CD29-FITC、CD90-FITC单克隆抗体(美国PharMingen 公司);流式细胞仪(Beckman counter Epics XL,美国BD公司)。
1.2 方法
1.2.1 兔MSC的原代培养 新西兰大白兔(福建医科大学动物实验中心提供),6周龄,体重约1.5kg,雌雄不限。3%戊巴比妥钠静脉麻醉,于无菌条件下在双侧坐骨棘处用18号骨髓穿刺针接5mL注射器,内含肝素钠0.2mL(100U/mL),各抽吸骨髓液2mL,抽吸完毕迅速将注射器内液体均匀混合,注入培养皿,用1mL注射器反复吹打培养皿中的骨髓液约5min,置入离心管,1000r/min离心10min,弃去脂肪和上清,用PBS重悬制成细胞悬液,小心加入至2倍体积1.073g/mL的Percoll分离液上层,室温下以2000r/min离心25min。收集中间乳白色的有核细胞层,再用PBS洗涤2次,加入适量的含双抗的20%胎牛血清DMEM 培养液吹打制成细胞悬液,置于离心管中,1000 r/min 离心15min。弃上清液,加入3mL含双抗的20%胎牛血清DMEM 培养液,反复吹打,稀释成细胞悬液,以1.0×104/cm2接种于50cm2培养瓶中。于37℃、体积分数为0.05的CO2、饱和湿度的培养箱中培养,3d后首次半量换液,将未贴壁的细胞全部弃掉,以后每2~3d全量换液1次。
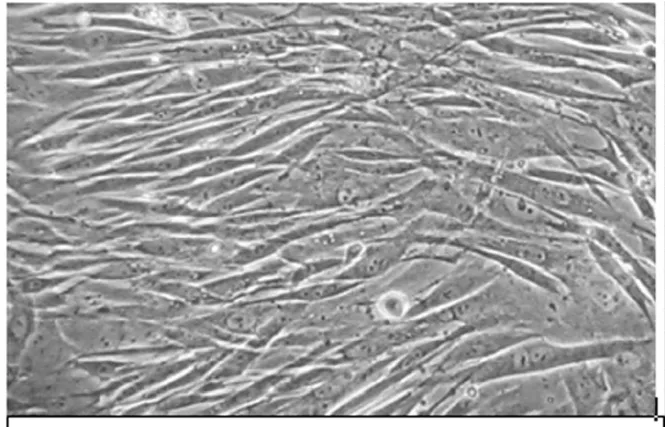
图1 家兔MSC原代培养9天(X100)

图2 家兔MSC透射电镜观察(X10000)
1.2.2 兔MSC的传代 在原代培养的细胞接近铺满培养瓶底时,用0.25%胰蛋白酶消化,倒置显微镜观察,待50%细胞变为圆形时,将胰酶倒掉,加入含20%胎牛血清的DMEM培养液中止消化,再以1×104/cm2传代培养。
1.2.3 细胞形态观察 每天在倒置相差显微镜下观察MSC原代和传代细胞的生长情况及形态特征,并适时拍照。
1.2.4 细胞超微结构观察 细胞在培养皿中增殖满单层后,0.25% 胰蛋白酶消化,移入离心管,1000r/min离心5min,洗涤细胞2次,末次离心后弃上清,取样行透射电镜观察。
1.2.5 流式细胞仪检测兔MSC的表面标志 取第3代MSC用PBS 重新悬浮后,调整细胞浓度1×106/cm2,取100μL细胞悬液与CD34-PE、CD45-FITC、CD29-FITC、CD90-FITC单抗室温避光孵育30min后,用流式细胞仪检测。
2 结果
2.1 MSC的生长情况及形态学特点
骨髓细胞经密度梯度离心后,接种于50cm2的培养瓶,倒置显微镜下观察培养液中存在大量大小不一的圆形细胞;24h后可见多数贴壁的圆形细胞中散在有少数多角形或短梭形细胞,有数个突起类似成纤维细胞;3~4d后梭形细胞和多角形细胞显著增多;5~6d后形成细胞集落方式生长,数量明显增多,呈现长梭形、纺锤形,细胞轮廓清晰,排列较紧密;7~9d后,细胞的生长明显加速,逐步形成大小不一、分散的细胞集落,呈放射状向四周扩展,细胞呈漩涡状或平行排列(图1);第10~12天,贴壁单层生长的细胞铺满整个培养瓶底,放射状或漩涡状生长方式更趋明显,非贴壁细胞通过换液己逐渐被清除,基本完成原代单层生长。传代细胞的细胞贴壁时间和增殖速度比原代培养要快,大约2h开始贴壁,培养约8~11d互相接触形成单层。传代细胞分裂相多见,胞体大,细胞边界不清楚,胞浆内颗粒多,显示细胞功能活跃,处于活跃的基质合成状态。传代至第10代后,细胞增殖速度减慢,细胞形态出现多样性,逐渐呈老化现象。

图3 流式细胞仪检测第3代MSC的细胞表面标记
2.2 MSC透射电镜观察
透射电镜示:细胞胞体较大,表面有微绒毛,核大而不规则,核内以常染色质为主,核仁可见,部分细胞内有多个核仁。胞浆内见中等量线粒体,其体积较小,密度较高,可见中等量粗面内质网、部分粗面内质网束状扩张,可见少量高尔基复合体,有些细胞内可见较多次级溶酶体,细胞间未见连接(图2)。
2.3 MSC的表面抗原鉴定
经流式细胞仪检测第3代细胞样本(图3),CD34、CD45、CD29、CD90分别为0.79%、0.18%、96.8%、84.2%。CD34、CD45基本不表达,证实这些细胞是非造血干细胞;CD29、CD90表达阳性,表明分离的细胞具有MSC的特征。
(1)CD34检测为阴性;(2)CD45检测为阴性;(3)CD29检测为阳性;(4)CD90检测为阳性。
3 讨论
MSC是一种存在于骨髓的非造血干细胞,骨髓中绝大多数是造血干细胞,MSC的数量较少,一般认为MSC只占骨髓有核细胞的1/104~1/105[3~4],为了得到组织工程学需要的单一细胞,人们尝试用各种方法分离、纯化MSC。目前用于分离MSC 的方法主要有贴壁筛选法和密度梯度离心法[5]。贴壁筛选法是根据MSC贴壁生长,而造血系细胞等因无法贴壁,则随培养液的更换而被清除[6]。但是,由此获得的MSC纯度不高,混合有较多的杂细胞,比如成纤维细胞、脂肪前体细胞等,所以体外培养特性不稳定[7]。密度梯度离心法是利用MSC与骨髓中其他细胞的密度不同,用特定密度的淋巴细胞分离液将MSC分离出来。这种方法应用梯度离心分离细胞,骨髓中的细胞按密度差别得以分离,所以可快速获得大量的高纯度细胞[8]。本实验用密度梯度离心法来分离培养MSC取得较好的效果。
目前尚没有十分理想的方法来鉴定MSC,主要通过细胞形态学特征如呈纺锤形、贴壁、成集落生长以及作为干细胞多分化潜能的确定(在不同的条件下,向成骨细胞、软骨细胞、脂肪细胞等分化的特性)来证明其干细胞的属性。我们分离培养的MSC从显微镜下观察,90%以上为梭形或呈纺锤形的细胞;电镜观察,细胞表面有微绒毛结构,细胞核大,核浆比例较正常细胞大,胞浆内细胞器以线粒体、内质网、溶酶体为主,说明细胞蛋白合成和分泌能力旺盛,能够大量摄取营养物质,功能活跃,显示了干细胞的幼稚特性,与成纤维细胞和血细胞等明显不同,这和文献相一致[9]。Pittenger等[10]认为,MSC细胞体积小,核浆比大,不表达分化相关标志如I、II、III型胶原、碱性磷酸酶和osteopontin;在细胞贴壁附着后则细胞均一致地表达SH2,SH3CD29,CD44,CD71,CD90,CD106,CD120a,CD124等多种表面蛋白。MSC缺乏造血干细胞标记,不表达造血细胞抗原,如造血前提细胞标志抗原CD34,白细胞标志抗原CD45,淋巴细胞表面抗原CD11a,单核巨噬细胞表面抗原CD14,同时不表达分化抗原HLA-DR[10~11]。我们采用1.073g/mLPercoll密度梯度分离法,从兔骨髓中分离出单个核细胞,3d后首次半量换液,经多次换液,去除大量为贴壁的杂细胞,7~9d后细胞呈长梭形,漩涡状生长。经传代细胞逐渐纯化,至3代时采用流式细胞仪检测分离培养的细胞只表达CD29和CD90,而CD34、CD45均呈阴性表达,这表明我们分离培养的细胞是成分较为单一的MSC,而不是造血干细胞和成纤维细胞。
总之,实验结果表明利用本实验方法提取、纯化和扩增的MSC,MSC增殖能力较强,纯度高,可以作为组织工程的种子细胞,为组织工程骨的构建提供依据。
[1]Bianco P,Riminucci M,Gronthos S,Robey PG.Bone marrow stromal stem cells:nature,biology,and potential applications[J].Stem Cells,2001,19:180~192.
[2]Caplan AI. Review: mesenchymal stem cells: cell-based reconstructive therapy in orthopedics[J].Tissue Eng 2005,11(7~8):1198~1211.
[3]Friedenstein AJ,Chailakhyan RK,Gerasimov UV. Bone marrow osteogenic stem cells: in vitro cultivation and transplantation in diffusion chambers[J].Cell Tissue Kinet 1987,20(3):263~272.
[4]Prockop DJ.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71~74.
[5]Liechty KW ,Mackenzie TC,Shaaban AF,et al. Human mesenchyreal stem cells engraft and demonstrate site-specific differentiation after in utcro transplantation in sheep[J].Nat Med ,2000 ,6:1282~1286.
[6]Rickard D J,M Kassem,T E Hefferan,et al. Isolation and characterization of osteoblast precursor cells from human bone marrow[J].J Bone Min Res 1996,11:312~324.
[7]Phinney D G,Kopen,G,Isaacson,R L,et al. Plastic adherent stromal cells from the bone marrow of commonly used strains of inbred mice: variations in yield,growth, and differentiation[J].Journal of Cellular Biochemistry,1999,72:570~585.
[8]Uu HS,Jan MS,Chou CK,et al,1Is green fluorescent protein toxic to the living cells[J].Biochem B Res Cornum,2006,260(3):712~714.
[9]苏立,陈运贞.骨髓问充质干细胞的生物学特性[J].医学综述,2004,10(5):306~309.
[10]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal[J]. stem cells. Science,1999,284(5411):143~147.
[11]Conget PA,Minguell JJ.Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells[J].J Cell Physiol,1999,181(1):67~73.

