黄芩苷-PVPK30固体分散体的研制
王玉秀,王玉璧,胡海洋,陈大为,秦雪梅 (山西生物应用职业技术学院生物制药工程系,太原000;沈阳药科大学药学院;山西大学中医药现代研究中心)
固体分散体是指药物以分子、胶态、无定型、微晶等状态均匀分散在某一固态载体物质中所形成的分散体系。以水溶性载体制备的固体分散体的主要特点是难溶性药物利用水溶性载体将其制成固体分散体,达到增加药物溶解度和溶出速率、提高药物生物利用度的目的[1]。
黄芩苷(C21H18O11)是唇形科黄芩属植物黄芩中所含的黄酮类有效成分,具有抗菌、抗炎、抗氧化、抑制醛糖还原酶,防治糖尿病慢性并发症及对心血管和脑损伤的保护作用等多种药理作用[2]。处方前研究发现黄芩苷的水溶性差,溶出速率慢,生物利用度低[3]。本文以 PVPK30为水溶性载体,PVPK30(聚维酮K30)是一种无定形高分子聚合物,无毒,易溶于水和多种有机溶剂,对许多药物有较强的抑晶作用,因PVPK30熔点高,故采用溶剂挥发法制备黄芩苷固体分散体,并考察载体用量对黄芩苷溶解性能的影响,对黄芩苷在固体分散体中存在的状态进行鉴别,得到了比较满意的结果。
1 材料
黄芩苷标准品(中国药品生物制品检定所);黄芩苷原料药 (由山西省药物研究所提供,含量为82.44%);PVPK30(国药集团化学试剂有限公司);其他试剂均为分析纯。
TU-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);IR-408红外光谱仪(日本岛津公司);RC-8型溶出仪(天津市国铭医药设备有限责任公司 );DSC60差示扫描量热仪(Japan Shimadzu Co.);恒温磁力搅拌器(JB-2型)(上海雷磁新径仪器厂)
2 方法
2.1 含量测定 采用紫外分光光度法,黄芩苷50%乙醇溶液在278 nm处有最大吸收,而载体PVPK30在此几乎无吸收,故278 nm为黄芩苷含量测定的最佳波长。
精密称取黄芩苷标准品10.0 mg,置于50 ml容量瓶中,加50%的乙醇溶液溶解并稀释至刻度,摇匀,作为标准品溶液。分别精密吸取上述溶液1 ml,1.5 ml,2 ml,2.5 ml,3 ml,3.5 ml置于 50 ml容量瓶中,用50%的乙醇定容,摇匀,在波长278 nm处测定吸光度值,结果以黄芩苷质量浓度为横坐标,以吸光度值为纵坐标绘制标准曲线,计算回归方程为Y=0.056X+0.039 6,r=0.999 9,表明黄芩苷标准品在浓度4-14 μg/ml范围内线性关系良好。方法回收率为98.50%-102.3%,RSD=1.97%(n=6)。
2.2 固体分散体的制备及工艺优化
2.2.1 固体分散体的制备 称取黄芩苷、载体PVPK30分别粉碎,过 60 目筛,按照药载比 1∶3,1∶5,1∶7,1∶9比例置于蒸发皿中,加入适量乙醇溶解,65℃水浴加热挥发去溶剂,得到干燥固体,即为溶剂法制备的固体分散体。将此固体分散体置于室温干燥器中干燥备用。按同样比例称取载体和药物,混合研磨,将此混合物置于室温干燥器中干燥备用,即得物理混合物。
2.2.2 固体分散体的工艺优化 为了获得最佳的固体分散体处方,以黄芩苷溶解度和体外溶出度为指标,考察了不同药物-载体PVPK30比例对药物的溶解度和溶出速率的影响。
2.3 固体分散体的物相鉴别 分别采用红外光谱法(IR)、差示扫描量热法(DSC)和X-射线衍射分析(XRD)法对黄芩苷原料药、载体、物理混合物和固体分散体进行了鉴别。
红外光谱分析条件:以溴化钾压片法在400-4 000/cm范围内测定红外光谱。
DSC测试条件:参比物Al2O3;气氛N2;升温程序:初温30.0℃,终温200℃;升温速率10.0℃/min。
XRD测试条件:CuKa靶,石墨单色器衍射单色化,管电压50 kV,管电流200 mA。
2.4 黄芩苷溶解度测定方法 称取黄芩苷及黄芩苷不同药载比固体分散体(相当于黄芩苷200 mg)适量,分别置于50 ml磨口三角瓶中,再加入水,盖好后,放入20℃恒温磁力搅拌器中,转速100 r/min,搅拌8 h,饱和液静置24 h,过滤,吸取4 ml滤液,置于50 ml容量瓶中,加50%乙醇稀释,同法平行做3份,用紫外分光光度计测定吸收度,由标准曲线计算黄芩苷在水中的溶解度[4]。
2.5 固体分散体溶出度测定方法 参照2005版药典第二法—浆法,将2.2.1所制备的不同药载比的黄芩苷固体分散体(相当于黄芩苷200 mg),分别均匀分散于(37±0.5)℃的900 ml pH=1.2的人工胃液(溶出介质)中,转速 50 r/min,分别在 5,15,30,45,60 min,通过玻璃管过滤器(0.45 μm 微孔滤膜)定位定时吸取滤液5 ml,同时补充同温度的人工胃液5 ml,置于50 ml容量瓶中,放至室温,用50%乙醇稀释至刻度,测定吸光度,计算累积溶出百分率,并对时间作图[5]。
3 结果
3.1 PVPK30用量对黄芩苷溶解度的影响 精密称取黄芩苷和PVPK30适量,采用溶剂挥发法制备药物与载体的比例分别为 1∶3,1∶5,1∶7,1∶9 的固体分散体,按照固体分散体溶解度的测定方法,测定溶解度,结果见表1。

表1 PVPK30用量对黄芩苷溶解度的影响 (n=3)Tab 1 Influence of PVPK30 dosage on dissolution of baicalin (n=3)
由表1可知,黄芩苷-PVPK30固体分散体的溶解度会随载体比例的增加而不断增加,但当原料药和载体的比例超过1∶5时,其溶解度的增加会越来越慢,采用方差分析的结果也表明黄芩苷-PVPK30各比例固体分散体溶解度均与黄芩苷本身溶解度差异有统计学意义(P<0.05),黄芩苷∶PVPK301∶3固体分散体溶解度与黄芩苷∶PVPK301∶5、1∶7 和1∶9 的固体分散体溶解度也有统计学差异(P<0.05);而黄芩苷∶PVPK301∶5,1∶7 和1∶9 固体分散体的溶解度之间并没有统计学差异。实验表明进一步增加载体量并不能显著提高黄芩苷的溶解度,为减少辅料用量,选择1∶5为原料药与载体的最佳比例。
3.2 PVPK30用量对固体分散体溶出度的影响 精密称取黄芩苷和PVPK30适量,采用溶剂挥发法制备药物与载体的比例分别为1∶3,1∶5,1∶7,1∶9 的固体分散体,按照固体分散体溶出度的测定方法,考察固体分散体和黄芩苷在pH=1.2人工胃液中的溶出效果,结果见图1。

图1 黄芩苷及其固体分散体在pH=1.2人工胃液中溶出曲线Fig 1 The dissolution curve of baicalin and baicalin-PVPK30in artificial gastric juice at pH=1.2
由图1可见,在pH=1.2人工胃液的介质中,黄芩苷-PVPK30固体分散体的溶出速率随着载体比例的增加而增大,当黄芩苷-PVPK30比例大于1∶5后,60 min内释放行为无显著性差异。黄芩苷-PVPK30固体分散体的溶出速率均大于黄芩苷原料药,而且黄芩苷PVPK30固体分散体在60 min内溶出大于70%,而黄芩苷原料药只溶出了25%。
3.3 固体分散体的鉴别
3.3.1 红外光谱鉴别 由红外光谱的比较结果可见,黄芩苷-PVPK30物理混合物和PVPK30的红外光谱较接近(见图2),由于PVP的比例较大,所以有可能PVP的各峰位将黄芩苷的峰位掩盖了,使得PVP和物理混合物的红外光谱的峰位非常相似。固体分散体与物理混合物的红外光谱相比也并无统计学差异,但从黄芩苷和PVPK30的分子结构上看,二者有形成氢键的基础,所以推测黄芩苷与PVPK30之间可能存在氢键缔合。
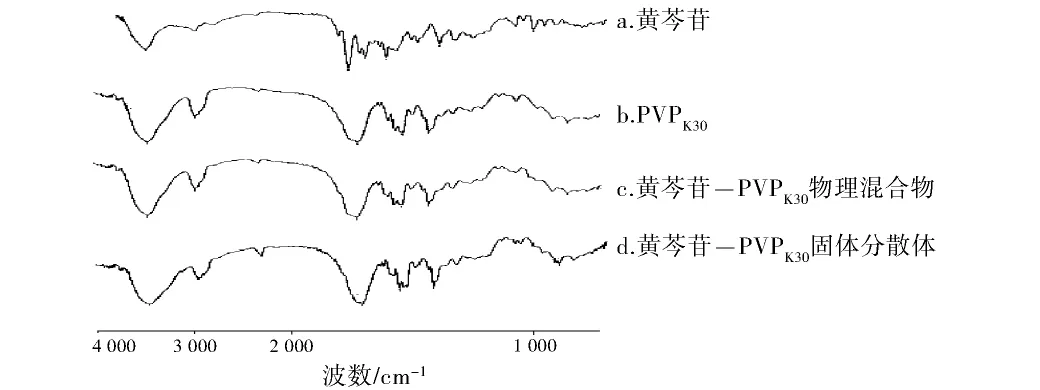
图2 黄芩苷固体分散体红外图谱Fig 2 The infrared spectrum of baicalin-PVPK30solid dispersion
3.3.2 差热分析 由图3可见,黄芩苷原料药的吸热特征峰为205.98℃。黄芩苷-PVPK30的物理混合物的吸热特征峰有3个,但其中的黄芩苷的吸收峰峰值升高(220.19℃)。而黄芩苷-PVPK30固体分散体的DSC扫描图谱中只有一个峰,此峰恰位于PVPK30的吸热特征峰处,黄芩苷峰消失,说明PVPK30-黄芩苷形成固体分散体。

图3 黄芩苷固体分散体DSC分析曲线Fig 3 differential scanning calorimetry curve of baicalin.-PVPK30solid dispersion
3.3.3 X-射线衍射 由图 4可见,黄芩苷-PVPK30固体分散体晶型发生改变,黄芩苷的结晶峰消失,以无定形形式存在于黄芩苷-PVPK30固体分散体中,进一步证实PVPK30和黄芩苷之间发生了作用。
4 结论
以PVPK30为载体,采用溶剂挥发法制备的黄芩苷固体分散体,可以显著提高黄芩苷的溶解性能,而且随着水溶性载体比例的增加,固体分散体的溶解度及溶出速率也随之增加。PVPK30在制备前后均以无定形存在,药物与PVPK30间的相互作用(如氢健)能抑制药物的结晶,IR、DSC和XRD实验表明药物以无定型态分散于固体分散体中,药物由多晶态转变为无定形态,从而明显改善了药物的溶解度和溶出速度,黄芩苷从固体分散体中的溶解度和溶出速度较黄芩苷原料药显著提高。
试验中也曾尝试用PEG类作为载体采用熔融法制备固体分散体,但发现黄芩苷熔点高(223℃),熔融温度要求严格控制,温度一旦太高就会严重影响黄芩苷的稳定性,通过紫外-可见图谱发现,其最大吸收波长发生了改变,意味着黄芩苷变质,故最终选择了PVPK30,选择溶剂法制备固体分散体。
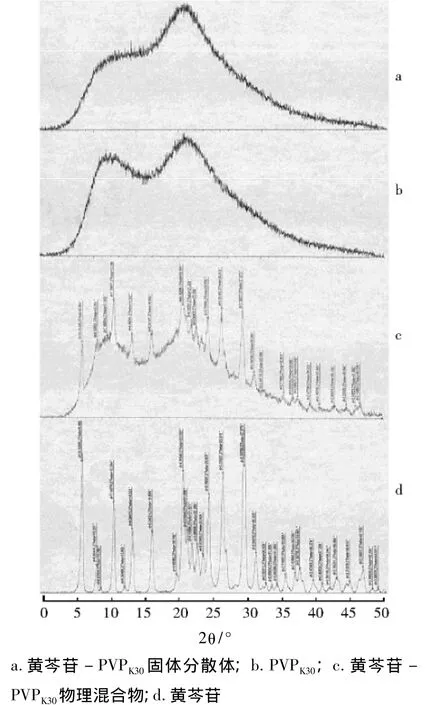
图4 黄芩苷固体分散体X-射线衍射图(图中θ为衍射角)Fig 4 X-ray diffraction analysis of baicalin-PVPK30solid dispersion
[1] Leuner C,Dressman J.Improving drug solubility for oral delivery using solid dispersions[J].Eur J Pharm Biopharm,2000,50(1):47-60.
[2] 冯友根,邹晓华.国内黄芩苷药理作用研究与临床应用概述[J].中国医药情报,2004,10(2):35-43.
[3] 欧水平,王森,张海燕,等.黄芩苷溶解性能的测定与表征[J].现代生物医学进展,2009,9(20):3954-3957.
[4] 王弘,陈济民,张清民.黄芩苷的物理化学常数测定[J].沈阳药科大学学报,2000,17(2):105-106.
[5] 王健,刘汉清,李振国,等.黄芩苷固体分散体的制备及体外溶出度研究[J].中国实验方剂学杂志,2010,16(12):23-24.
