嗜肺军团菌环介导等温扩增检测法的建立
吕沁风,郑 伟,罗 鹏,吴忠华,李 禾,沈建根
(1.浙江大学医学院,浙江杭州 310058;2.浙江国际旅行卫生保健中心,浙江杭州 310003)
嗜肺军团菌环介导等温扩增检测法的建立
吕沁风1,2,郑 伟2,罗 鹏2,吴忠华2,李 禾2,沈建根1
(1.浙江大学医学院,浙江杭州 310058;2.浙江国际旅行卫生保健中心,浙江杭州 310003)
目的:建立一种快速简便的嗜肺军团菌分子检测方法。方法:运用环介导等温扩增技术(loop-mediated isother mal amplification,LAMP),设计一套引物特异性识别嗜肺军团菌毒力基因——mip基因的 6个特殊区域,在恒温条件下,对 8株嗜肺军团菌和 5株其它细菌进行检测,并与普通 PCR方法进行比对,验证该方法的特异性和灵敏度。结果:所有嗜肺军团菌扩增产物均产生肉眼可见的白色沉淀,而其它不同菌株均不产生沉淀;加入荧光染料 smart green后,嗜肺军团菌扩增产物均产生强绿色荧光,其它菌株呈弱荧光。与普通 PCR(检出限约为 57.6 pg,)比,LAMP扩增反应的灵敏度大 100倍左右,基因组 DNA检出限为 576 fg,阳性水样检出限为 8 cfu/ml。结论:LAMP技术可在简易的实验环境中快速、特异、灵敏地检测嗜肺军团菌。
军团病杆菌,嗜肺;军团杆菌病 /诊断;基因扩增;聚合酶链反应 /方法;增强子元件(遗传学)
[J ZhejiangUniv(Medical Sci),2010,39(3):305-310.]
嗜肺军团菌 (Legionella pneumophila)于1976年首次在美国被发现[1],是一种革兰氏阴性条件致病菌,主要通过污染建筑物中的水系传播,易大规模爆发和流行。该菌感染后发病进程快、死亡率高,在西欧国家,每年军团菌的发病人数接近 10万[2-3]。随着经济发展,中央空调的普遍使用,军团菌爆发的危险性日益增加,已有多个国家将军团菌肺炎列为法定传染病。我国卫生部 2003年颁布了《集中式空调通风系统卫生规范》,目的就是为了切断军团菌的传染源和传播途径。由于军团菌生长较慢,普通培养检测周期较长,而且血清免疫学方法灵敏度和特异性不高,因此对其检测存在一定的局限性[4-5]。环介导等温扩增技术 (loop-mediated isother mal amplification,LAMP)是 Notomi等在 2000年开发的一种新型的体外扩增特异核酸片段的分子生物学技术[6-7],可在等温条件下 1 h左右得到 109拷贝的扩增产物,具有高特异性、快速灵敏、操作简便、成本低等特点。本研究运用LAMP技术原理,针对嗜肺军团菌的 mip基因设计特异性引物,建立简便、高效的嗜肺军团菌检测方法,并验证该方法的特异性和灵敏度。
1 材料和方法
1.1 材料
1.1.1 主要设备和试剂 CO2孵箱购自日本三洋公司,Takara TP600型梯度 PCR仪购自日本 Takara公司,干浴模块购自上海位点生物技术有限公司,台式高速离心机购自 Beckman公司;电泳仪和凝胶成像系统购自 Bio-RAD公司。T IANGEN细菌基因组 DNA抽提试剂盒购自上海位点生物技术有限公司,BCYE培养基及 GVPC选择性培养基购自英国 OXO ID公司,U-LAMP通用型试剂盒、2×PCR TaqMix、20×s martgreen及核酸电泳分子量标准 DL2000购于北京美莱博医学科技有限公司,20×Eva green购自美国 Biotium公司,琼脂糖购自西班牙 Biowest公司,8U BstDNA聚合酶和引物购自上海生工生物工程有限公司。
1.1.2 菌株 3株嗜肺军团菌标准株(ATCC33152、ATCC33154、ATCC33155)购自上海宝录生物科技有限公司,其余 5株嗜肺军团菌为本室分离保存菌种。另外,金黄色葡萄球菌、志贺氏菌、伤寒沙门氏菌、鼠伤寒沙门氏菌和大肠杆菌各 1株为浙江省质量技术监督检测研究院提供。
1.2 方法
1.2.1 引物设计 根据 GenBank公布的嗜肺军团菌 mip基因序列 (NC_002942),用 Primer Ex plorer IV软件分析设计一套引物,分别是前外引物 B3、后外引物 F3、前内引物 FIP和后内引物 B IP,其中 FIP是由 F1C的互补序列和 F2序列组成,B IP是由 B1C序列和 B2的互补序列组成,见图 1和表 1。
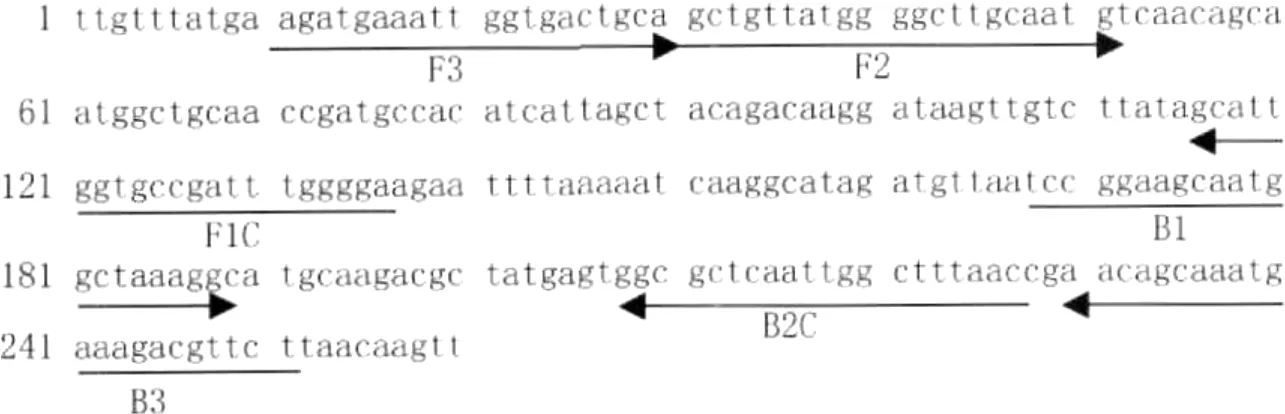
图1 嗜肺军团菌mip基因的引物设计Fig.1 The primers design for the mip gene ofLegionella pneum ophila

表1 LAMP引物Table 1 LAMP pr imers
1.2.2 菌株培养 将嗜肺军团菌接种于BCYE培养基或者 GVPC选择性培养基,在 5%CO2孵箱中培养 2-3 d,挑取单个菌落制备模板。其它菌接种于普通营养肉汤中,培养 1 d后吸取 1 ml菌液制备模板。
1.2.3 DNA模板制备 采用 T IANGEN细菌基因组DNA提取试剂盒,按说明书操作。
1.2.4 LAMP扩增反应 LAMP反应体系为20μl,组分包括 2 ×U-LAMPMix 10μl,引物混合物 1μl(体系中引物终浓度分别为:F3、B3各0.2μmol/L,FIP、B IP各 0.75μmol/L),模板DNA 1μl,8U BstDNA聚合酶 0.8μl,ddH2O 7.2μl。反应条件:混匀后将其放入干浴模块60℃ 60 min;80℃ 10 min。
1.2.5 特异性试验 提取嗜肺军团菌及其它细菌的 DNA,用 LAMP方法检测,以灭菌双蒸水作为空白对照,验证方法的特异性。
1.2.6 灵敏度试验 ①基因组 DNA灵敏度试验:取嗜肺军团菌标准株 ATCC33152的 DNA抽提原液,10倍倍比稀释至 10-1-10-8,分别取 2μl进行 LAMP反应,观察沉淀反应和荧光反应。②普通 PCR反应灵敏度试验:为了比较LAMP与普通 PCR的灵敏度,将嗜肺军团菌ATCC33152的 DNA抽提原液,10倍倍比稀释至 10-5,用引物 F3、B3进行扩增。PCR扩增体系如下:反应体系为 20μl,其中 2×PCR TaqMix 10μl,引物混合物 1μl,模板 DNA 1μl,ddH2O 8μl。反应条件:95℃变性 30 s,55℃退火 30 s,72℃延伸 30 s,30个循环;72℃延伸 5 min,4℃停止。取 10μl普通 PCR产物观察琼脂糖电泳结果。
1.2.7 水样中的检测应用 在灭菌双蒸水中加入已知浓度的嗜肺军团菌标准株菌液混匀作为检测原液,用灭菌双蒸水 10倍倍比稀释至10-8,各取每个稀释度的菌液 1ml用试剂盒提取 DNA进行 LAMP扩增。
2 结 果
2.1 LAMP检测方法的建立 本研究针对嗜肺军团菌mip基因设计的一套特异性引物对现有菌株基因组进行 LAMP检测,反应后 12 000 r/min离心 1 min观察结果,所有嗜肺军团菌样本均出现白色沉淀 (图 2)。将 LAMP反应的产物经琼脂糖电泳后观察,嗜肺军团菌标本出现LAMP特有的阶梯状分布的扩增条带 (图 3)。LAMP反应结束后,向管内加入 1μl的 20×s mart green,在紫外下观察,嗜肺军团菌标本出现强烈的绿色荧光 (图 4)。上述结果表明,该反应体系能有效地扩增嗜肺军团菌的 mip基因。

图2 LAMP沉淀反应Fig.2 LAMP precipitation reaction

图3 LAMP产物电泳图Fig.3 The electrophoresis results of LAMP products

图4 LAMP产物荧光检测Fig.4 The LAMP products with fluorescence detection
2.2 LAMP特异性试验 如图 2-图 4所示,嗜肺军团菌均能扩增出阳性结果,其它非嗜肺军团菌和空白对照无白色沉淀,琼脂糖电泳无条带,加入荧光染料后显色很弱。由此可见,本实验所设计的嗜肺军团菌 LAMP检测方法具有良好的特异性。
2.3 灵敏度试验
2.3.1 LAMP灵敏度实验 测定嗜肺军团菌ATCC33152DNA抽提原液浓度为 576 ng/μl,10倍倍比稀释,进行 LAMP反应,如图 5可见,在第 6管即稀释到 106倍,仍可扩增产生白色沉淀,第 7管未见白色沉淀。由此可确定基因组DNA检测限约为 576 fg/μl。当 LAMP反应结束后,加入 20×smart green,在紫外灯下观察 (图 6),同沉淀反应,DNA抽提原液稀释至 106倍,还可观察到强烈的绿色荧光反应;但是,阴性反应也有荧光干扰。

图5 嗜肺军团菌 LAMP检测灵敏度沉淀法检测结果Fig.5 The sensitivity ofLAMP-precipitation testforLegionella pneum ophila
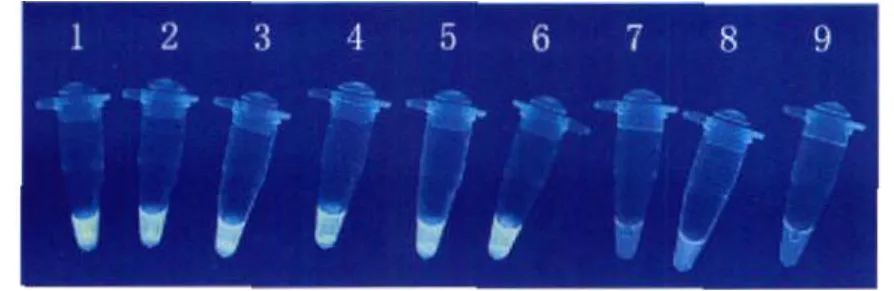
图6 嗜肺军团菌 LAMP检测灵敏度试验荧光检测结果Fig.6 The sensitivity of LAMP fluorescencedetection forLegionella pneum ophila
2.3.2 普通 PCR灵敏度试验 取各稀释度的普通 PCR扩增产物各 10μl,marker DL2000分子量标准 5μl/泳道。1%琼脂糖凝胶在 120 V电压下电泳 25 min,用凝胶紫外分析仪观察(图 7),结果 PCR扩增片段大小为 241 bp,与理论值相符;在泳道 5可见较弱的扩增产物,在泳道 6已不可见扩增产物。由此可见,普通PCR扩增的检出限约为 57.6 pg/μl,LAMP扩增反应的灵敏度比普通 PCR大 100倍左右。

图7 嗜肺军团菌普通 PCR灵敏度试验Fig.7 The sensitivity of conventional PCR for the detection ofLegionella pneum ophila
2.4 水样中的检测应用 经平板计数,嗜肺军团菌原菌液浓度为 8×107cfu/ml,10倍倍比稀释至 107倍,试剂盒提取 DNA,LAMP检测后,仍产生肉眼可见的白色沉淀;稀释度为 10-8没有沉淀生成,说明阳性水样的检出限在 8 cfu/ml左右。
3 讨 论
嗜肺军团菌一般人群普遍易感,因此有必要研究高效快速嗜肺军团菌检测技术。但常规培养要求苛刻,细菌生长缓慢,一般从水样收集到培养鉴定需要 7~10 d[4-5];再者,培养结果受标本采集质量、操作技术的影响,阳性率不一。LAMP技术是一种新兴的分子检测技术,不需特殊的分子生物学仪器设备和严格的实验条件,在简易环境中就可实现快速检测。由于嗜肺军团菌mip蛋白是嗜肺军团菌的主要毒力因子[8-9],因此本研究选择mip基因序列设计一套特异性引物,建立嗜肺军团菌LAMP检测方法。
LAMP是对靶基因的 6个特征区域设计 4种引物,利用具有链置换活性的 Bst DNA聚合酶在恒温条件下催化新链合成,从而使靶基因高效扩增。它的产物是由多重复靶序列的茎-环状 DNA和花椰菜状 DNA所组成的混合物,在琼脂糖凝胶电泳上会呈现出 LAMP所特有的阶梯状条带[10-11]。LAMP反应过程将产生大量的焦磷酸根离子,与镁离子结合生成白色的焦磷酸镁沉淀,可根据快速离心或者浊度变化,直观观察检测结果,在基层或者落后地区技术人员只需简单培训就可完成实验操作。本研究根据沉淀反应、产物电泳以及荧光检测结果,证实 LAMP技术检测嗜肺军团菌具有良好的特异性;嗜肺军团菌的扩增结果均为阳性,其它不同细菌均为阴性。通过比对发现,LAMP方法对基因组 DNA扩增灵敏度相比普通 PCR高出 2个数量级左右。而许多研究也已表明,LAMP技术可检测到 10个拷贝数甚至更低的靶标,在检测灵敏度上具有巨大的优势[12-14]。本方法从 DNA抽提开始约 1.5 h即可完成实验,大大缩短了检测时间。同时其扩增反应在恒温条件下即可完成,不需要特殊的仪器设备。本研究采用两种方法直接观察实验结果,反应后直接加入荧光染料在紫外灯下检测时,由于阴性样品中有 DNA和引物存在,故而也有微弱荧光信号,且离心管本身存在一定的荧光信号,对扩增结果观察有一定干扰。因此,建议使用沉淀法观察结果更为简便易行。
LAMP区别于此前经典的 PCR技术,LAMP具有不需要特殊的精密昂贵的仪器设备和严格的实验条件,操作简便,成本低廉,省略了传统 PCR方法变性、退火、延伸的过程,大大节约了反应时间,特别适用于现场检测,为基层小型实验室、出入境口岸等机构提供了一种新型的核酸检测技术,在病原体检测中有较好的应用前景。
[1] FRASERD W,TSA I T R,ORENSTE IN W,et al Legionnaires′disease,description of an epidemic of pneumonia[J].N Engl J M ed,1977,27(22):1189-1197.
[2] LU Feng,J IN Yin-long,CHENG Yi-bin(路 凤 ,金银龙,程义斌).Prevalence of Legionella disease[J].Foreign M edicalSciences:Section of Hygiene(国外医学卫生学分册),2008,35(2):78-83.(in Chinese)
[3] WHO.Legionella and the Prevention ofL egionellosis[M].India:WHO Press,2007.
[4] HOGE C W,BRE IMAN R F.Advances in the epidemiology and control of Legionella infections[J].Am J Epidem iol,1991,13(Suppl L):329-340.
[5] ZHANG Li-xia,L IU Fan(张丽霞,刘 凡 ).Overview of the detections for legionella[J].ForeignM edical Sciences:Section of Hygiene(国外医学卫生学分册),2008,35(6):377-382.(in Chinese)
[6] NOTOM T,OKAYAMA H,MASUBUCH I H,et al.Loop-mediated isother mal amplification of DNA[J].Nucleic Acid Research,2000,28(12):63.
[7] NAGAM INE K,HASET,NOTOM I T,et al.Accelerated reaction by loop-mediated isothermal amplication using loop primers[J].M olecular and Cellular Probes,2002,15:223-229.
[8] TEMPLETON K E,SCHELT INGA S A,S ILLKENS P,et al.Development and clinical evaluation of an internally controlled,singletube multiplex real-time PCR assay for detection ofLegionella pneum ophila and otherLegionella species [J]. Clin ical M icrobiology,2003,40(9):4016-4021.
[9] DEBORAH A,W ILSON,BEL INDA YENL IEBERMAN,etal.Detection ofLegionella pneum ophilaby real-time PCR for the mip gene[J].Clinical m icrobiology,2003,41(7):3327-3330.
[10] KUANG Yan-yun,L I Si-guang,LUO Yu-ping(匡燕云,李思光,罗玉萍).Loop-mediated isother mal amplification method for detection of nucleic acids and its Application [J].M icrobiology(微生物学 ),2007,34(3):557-560.(in Chinese)
[11] XU Qian,SUN Xiao-hong,ZHAO Yong,et al(徐芊 ,孙晓红 ,赵 勇 ,等 ).Development of loopmediated isothermal amplification (LAMP)method for detection of vibrio para haemolyticus[J].China Biotechnology(中国生物工程杂志 ),2007,27(12):66-72.(in Chinese)
[12] MOR I Y,M KITAO,N TOM ITA,et al.Real-t ime turbid imetry of LAMP reaction for quantifying template DNA[J].Journal of Biochem icaf and BiophysicalM ethods,2004,59(2):145-157.
[13] SUZUKI R,T YOSH IKAWA,M I H IRA,et al.Developmentof the loop-mediated isothermal amplification method for rapid detection of cytomegalovimsDNA[J].Journal of Virological M ethods,2006,132:216-221.
[14] HU Lian-xia,ZHANGWei,ZHANG Xian-zhou,et al(胡连霞,张 伟 ,张先舟 ,等 ).Development of a loop-mediated isothermal amplification assay for rapid detection ofEnterobacter sakazakii in powdered infant formula [J]. Acta M icrobiologica Sin ica(微生物学报),2009,49(3):378-382.(in Chinese)
[责任编辑 黄晓花 ]
Establishment ofloop-mediated isothermal amplification method for detection ofLegionella pneum ophila
LU Qin-feng1,2,ZHENG Wei2,LUO Peng2,WU Zhong-hua2,L I He2,SHEN Jian-gen1(1.College of M edicine,Zhejiang University,Hangzhou310058,China; 2.Zhejiang International Travel Healthcare Center,Hangzhou310003,China)
Objective:To establish a simple and rapid molecular detection forLegionella pneumophila.M ethods:The loop-mediated isother mal amplification(LAMP)was applied for detection ofLegionella pneum ophila.A set of primers were designed to identify six special areas in mip gene ofLegionella pneum ophila.Genomic DNAs from 13 bacterial strains,including 8Legionella pneum ophilastrains and 5 other bacterial strainswere amplified by LAMP and general PCR method to evaluate the specificity and sensibility ofLAMP.Results:All positive tubes produced visible white precipitation,and no precipitation was observed in others.By adding smart green fluorescent dye,allLegionella pneum ophilapositive tubes presented a strong green fluorescence,while others showed weak fluorescence.The detection rate ofLAMP was higher than that of general PCR.The detection limits were 576fg with genomic DNA ofLegionella pneum ophila,and 8 cfu/mL with positive water samples.Conclusion:LAMP detection ofLegionella pneum ophilais an effective and low-costmethod with high specificity and sensitivity requiring no special equipment.
Legionella pneum ophila;Legionellosis/diag;Gene amplification;Polymerase chain reaction/methods;Enhancerelements(genetics)
R 378.99
A
1008-9292(2010)03-0305-06
2009-10-27
2010-03-20
吕沁风 (1981-),女,硕士生,主管技师,从事传染病检测工作.
沈建根 (1952-),男,副研究员,主要从事分子免疫研究,E-mail:SJG7217143@sina.com
http:∥www.journals.zju.edu.cn/med DO I:10.3785/j.issn.1008-9292.2010.03.015

