兼性厌氧复合菌群H纤维素降解和产乙醇能力及生态组成初探
杜然,李十中,章晓庆,王莉
清华大学核能与新能源技术研究院,北京 100084
兼性厌氧复合菌群H纤维素降解和产乙醇能力及生态组成初探
杜然,李十中,章晓庆,王莉
清华大学核能与新能源技术研究院,北京 100084
通过限制性培养条件和连续继代培养,筛选获得了一组具有高效稳定降解纤维素能力的复合菌群 H。该菌群在传代30代以上仍能保持各项性状稳定,其工作pH为6~9,3 d可以完全降解置于100 mL PCS缓冲液培养基中的滤纸,发酵液中能够检出1.54 g/L乙醇。通过16S rDNA扩增和DGGE的方法,对菌群在不同阶段的微生物组成进行了研究,确定了琥珀酸嗜热梭菌Clostridium thermo succinogene、产气荚膜梭菌Clostridium straminisolvens和紫色板蓝根梭菌Clostridium isatidis等多种可直接实现纤维素到乙醇转化的菌株。菌群通过菌种之间的协同作用,共同维持了体系的稳定及降解能力的稳定。明确菌系的组成,对于进一步研究菌群降解机理、优化菌群和提高乙醇产率意义重大。
纤维素降解,微生物菌群,乙醇生产
Abstract:The recalcitrance of lignocellulosic biomass makes its hydrolysis by cellulases less effective, and the consolidated bioprocessing(CBP)strategy that combines enzyme production, cellulose hydrolysis and fermentation, particularly the synergetic role of different microbes in attacking cellulose component could be a solution.In this article, a facultative anaerobe microbial consortium named H was isolated, which exhibited high stability even after 30 subcultures, with pH ranging from 6 to 9.Within three days, 0.5 g filter paper immerged in 100 mL PCS buffer was completely degraded, and 1.54 g/L ethanol was produced,correspondingly.Further analysis on the component of the microbe consortium was carried out though 16S rDNA and DGGE, andClostridium thermosuccinogene,Clostridium straminisolvensandClostridium isatidisthat can directly convert cellulose to ethanol were identified, indicating thatClostridiumspp.played important role in cellulose degradation through the synergistic coordination of different species, and the characterization of the consortium will benefit the analysis of the underlying mechanisms as well as the optimization of the CBP process for more efficient cellulose degradation and ethanol production.
Keywords:cellulose degradation, microbe consortium, ethanol production
中国是农业大国,秸秆垒木质纤维素类物质的保有量惊人。据统计,每年仅农作物秸秆生产量高达7亿多吨,农作物加工废弃物,如稻壳、玉米芯和甘蔗渣等估计总量在1亿吨以上[1-2]。若能通过生物手段将其转换为可发酵糖类,再进一步发酵生产以纤维素乙醇为代表的第二代生物燃料,对于解决能源危机和环境问题有重大意义。纤维素乙醇目前主流的研究趋势主要分为筛选更高效的纤维素酶,采用菌群的方式进行纤维素和乙醇的同步发酵,以及CBP技术。
目前生产纤维素酶的主要方法是利用单一菌株发酵以提取其中的纤维素酶[3-5]。但是由于单菌发酵生产的纤维素酶系配比不够理想,于是有科学家提出复合菌的思路,如Thierie等[6]提出的采用数株梭菌组合形成的复合菌系,崔宗均等[7]提出的MC1复合菌系等。这些复合菌系是将已知的多种纤维素降解单菌进行简单的组合,没有考虑到不同菌之间的协同互补与抑制关系,因而其降解纤维素效率并不高。采用人工合成的同时具有纤维素糖化和乙醇转化能力的菌群也同样存在上述问题。本课题组以前人原生态分离高效菌群的研究为基础,结合中药理论“君臣佐使”原理进行了具有纤维素降解并生产乙醇能力的天然混合菌群筛选,并采用定向限制性培养的方式进行菌群结构的简化[8]。采用该种方法获得的混合菌群,不同菌在群落中各司其职,相互协作,具有较宽的工作温度和 pH区间,极高的稳定性和抗逆性,同时保持了较强的纤维素降解能力[9]和一定的乙醇转化能力。本文报道了一组兼性厌氧的高效稳定的纤维素分解菌群 H降解纤维素及产乙醇的性能,并对菌种的组成进行了初步的研究,为进一步研究其协同作用机理和优化菌群奠定了基础。
1 材料与方法
1.1 实验材料
样品分别取自天津河东区郊区、河南省郑州市郊区、山东济宁市任城区、内蒙古巴彦淖尔市五原县。
筛选培养基成分[10]:蛋白胨5 g,酵母粉1 g,NaCl 5 g,CaCO32 g,滤纸 5 g,微量元素液(ZnSO4·7H2O,MnSO4·4H2O,CuSO4·5H2O,CoSO4·7H2O,Na2B4O7·10H2O,NaMoO4·2H2O,FeSO4)0.5 mL,蒸馏水 1 000 mL,pH 8.0。
1.2 实验方法
1.2.1 菌群筛选方法
取5 g土壤样品接种于100 mL的液体培养基中,当其中滤纸完全崩解后,再按10%的接种量进行传代,如此进行继代培养50代以后进行研究。
1.2.2 纤维素分解活性的测定[11]
CMC 糖化力法:取 1%的羧甲基纤维素钠(CMC-Na)溶液 3.8 mL作为底物(用 pH 8.0的Tris-HCl缓冲液配制),加入经适当稀释的酶液0.2 mL,在50℃反应30 min,加入1 mL DNS,1 mL 2 mol/L NaOH,沸水浴10 min,于540 nm测定还原糖量。以1 mL粗酶液反应1 min释放1 μmol葡萄糖所需酶量定义为1个酶活力单位(IU)。
葡聚糖外切酶活力单位的测定:0.2 mL酶液与1.8 mL 1 mg/mL pNPC(对硝基苯纤维二糖苷)溶液(用 pH 8.0的 Tris-HCl缓冲液配制)在 50℃反应30 min。加入2 mL 10%的NaCO3终止反应。然后在420 nm处测定消光值。
1.2.3 失重率的测定[11]
将0.5 g的滤纸(或其他纤维素物质)作为唯一碳源制作100 mL PCS,接种5 mL H菌液,50℃静止培养,5 000 r/min 离心,用盐酸和硝酸的混合液多次清洗沉淀以消除菌体[6],然后 105℃烘干后称重,计算失重量和失重率。
1.2.4 菌群生长过程中pH变化监测
采用德国MERCK 1.09543.0001精密pH试纸进行测定。
1.2.5 菌群DNA提取、16S rDNA PCR扩增及序列分析
菌群DNA提取采用Bio-red土壤基因组提取试剂盒提取菌群总DNA。
16S rDNA PCR扩增采用文献[12]所述方法。
DGGE分析使用 DcodeTM Universal Mutation Detector System(BIO-RAD Laboratories,Hercu les,CA,USA)。操作步骤在Muyzer 等[13]的基础上改良,见文献[14]。引物 357F-GC-clamp:5′-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCCC TACGGGAGGCAGCAG-3′和 518R:5′-ATTACCGCG GCTGCTGG-3′进行16S rDNA的V3可变区扩增。优化后的PCR程序为95℃预变性4 min;95℃变性50 s,52℃退火45 s,72℃延伸45 s,25个循环;之后72℃延伸10 min。切胶回收纯化后,电泳检测,之后通过DGGE电泳进行条带分离,分离后切胶回收,再采用引物:357F:5′-CCTACGGGAGGCAGC AG-3′和 518R:5′-ATTACCGCGGCTGCTGG-3′扩增出的16S rDNA PCR产物连接T载体转入大肠杆菌,进行克隆验证后,挑选单菌落送上海生工北京测序部测序,将测序结果在NCBI中比对。
1.2.6 滤纸降解液组成分析
采用岛津GC/MS-QP2010气质联用色谱仪,数据库为Nist database。气相色谱柱采用Varian色谱柱CP-Wax 57 CB。检测样品为菌群发酵第3天的发酵液,采用高速离心的方法除去细胞、蛋白等碎片,取上清液进行TIC全谱检测。气相升温程序为50℃初温,以10℃每分钟的速度升温至160℃,保持7 min。质谱离子源温度200℃,接口温度200℃,载气为氦气。
2 结果与分析
2.1 H菌群发酵动力学研究
图1表明了菌群降解滤纸过程中内切酶、外切酶、pH和失重率的变化趋势。pH首先出现一个短暂的下降阶段,在16 h时达到最低7,之后逐渐上升到7.5,至24 h时再次下降,直至60 h时到达最低点6.8,之后呈现持续增高趋势;失重率呈现快速升高趋势,至60 h左右保持稳定,失重率达到90%以上。经历了最初接种带来的波动后,内外切酶酶活变化大致呈正态分布曲线,在60 h达到最高值,并维持较高酶活至90 h,在此阶段2种酶均保持了较高的酶活,此后酶活均开始呈下降趋势。通过对pH和酶活变化的分析,可以一定程度上反映不同菌之间的相互协调关系[15]。
研究表明,在0~18 h之间pH呈下降趋势至最低点 6.8,酶活开始上升,失重率也随之升高,在12 h后,随着葡聚糖内切酶、外切酶酶活的快速升高,失重率呈现加速升高的趋势。但pH在24 h到达最高点 7.5后出现了快速下降的趋势,并在酶活最高点附近达到最低点,原因可能是纤维素降解菌株在菌群中占据了主导地位,伴随菌体的大量生长和产酶高峰的到来,纤维素快速转化为发酵糖类并在发酵过程中产生了乙酸等代谢产物,从而导致pH值出现明显的下降。在2种酶酶活达到最高点时,滤纸逐步耗尽,失重率不再变化[16-17]。之后pH稳定上升,酶活开始下降。分析其原因应当是随着纤维素的耗尽,培养基中碳源匮乏导致菌体生长变缓进入衰退期,进而产酶下降,随着菌体的大量死亡裂解,造成pH值出现升高的趋势,即菌群中菌生长状态的变化和代谢产物的变化共同作用导致了菌群特有的pH变化趋势。另一方面,未经过任何改造或者培养条件优化的情况下,该菌群的内切酶活性最高可达1.93 IU,外切酶可以达到3.6 IU,充分说明了该菌群在降解纤维素中的高效性及其进一步研究的价值。
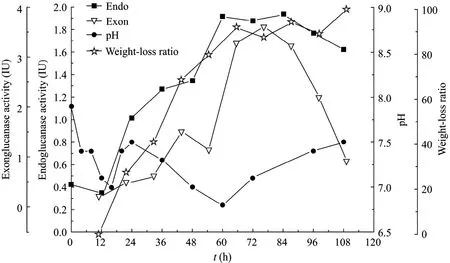
图1 菌群H在生长过程中内切酶、外切酶酶活、pH和失重率的动力学曲线Fig.1 The kinetic curves of the endoglucanase, exonglucanase, pH, cell concentration and the degradation ratio of cellulose in the growing period of the microbial consortium H.
2.2 滤纸降解液组分分析
通过气质联用检测,获得了如图2所示的色谱图。
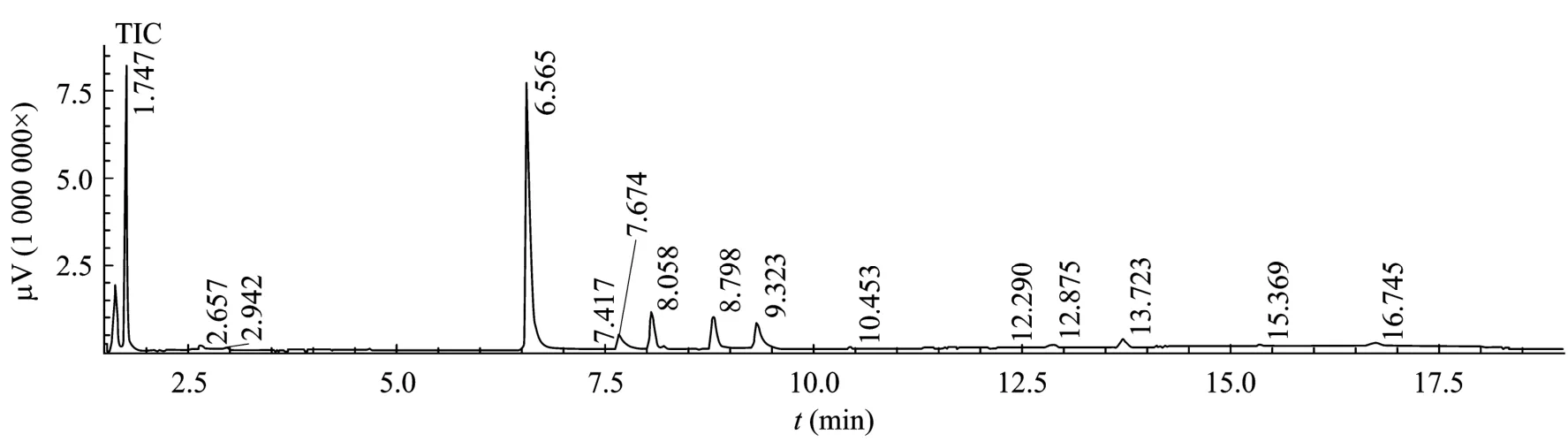
图2 第3天发酵液气质检测色谱图Fig.2 GCMS chromatogram of the fermentation broth at the 3rd day.
经过质谱图的比对,保留时间1.747 min处的峰为乙醇峰,乙醇含量约为 1.54 g/L,保留时间6.565 min、8.058 min、8.798 min和9.323 min处峰分别为乙酸、丙酸、丁酸和异戊酸。该检测结果证明了菌群在具有高效纤维素降解能力的同时,部分菌株可以利用纤维素降解产生的可发酵糖或者纤维素降解的部分中间产物生产乙醇,即具有一步法生产纤维素乙醇的能力。同时,乙酸等其他有机酸的积累解释了在酶活不断升高过程中 pH持续下降的现象。若能通过优化菌群的结构提高可以利用纤维素生产乙醇的菌株比例,降低纤维素向乙酸等有机酸的转化量,并通过驯化、人工合成等方式提高菌群的纤维素降解能力,则有望可以利用菌群进行纤维素乙醇的一步法生产。
2.3 菌群组成研究
通过DGGE电泳分离,获得了如图3所示的电泳条带。

图3 H全基因组16S rDNA的V3可变区DGGE电泳图(左条带所示为菌群培养36 h时16S rDNA的V3可变区电泳图谱;右条带为菌群培养72 h时16S rDNA的V3可变区电泳图谱。限于切胶仪器分辨率,分别选取了其中的8条和10条条带切胶进行测序分析)Fig.3 Electrophoretogram of the 16S rDNA V3 variable region of the genome of the microbial consortium H.The left and right bands were results of the samples collecting at the fermentation time 36 h and 72 h, respectively, and the bands numerated were selected for further analysis.

表1 菌群培养36 h和72 h时16S rDNA的V3可变区DGGE条带序列比对后相似性结果Table 1 Alignment sequencing results of the DGGE bands of 16S rDNA V3 regions obtained at 36 h and 72 h
通过选择,我们分别在A和B上切取较清晰并已经充分分离的8条和10条条带,进行处理获得序列信息后在 NCBI中比对,将获得的结果中相似性最高的菌种信息列表如表 1所示,通过比对可以发现,在菌群可检出的菌株中,以梭菌为优势菌群,由于梭菌多为厌氧和兼性厌氧类型,整个菌群也具有了兼性厌氧的特性。梭菌在纤维素降解方面的研究开展的十分广泛,已有众多文献报道了梭菌在降解纤维素方面的优势,这就解释了菌群具有较强的纤维素降解能力[18-24]。从组成上可以看出,除了具有纤维素降解能力的梭菌存在外,菌群中又辅以其他的或具有纤维素降解活性或不具有该活性的菌株,推测是由于这些菌株的存在,使菌群中的诸多菌相辅相成,共同作用成为了一个相对稳定的体系,进而使整个菌群具有了较强的抗逆性和环境适应性。同时,据相关文献报道,诸如Clostridium thermosuccinogene、Clostridium straminisolvens、Clostridium isatidis[19,21-22]在降解纤维素的同时都会伴有代谢产物乙醇的生成,再结合对发酵液组分分析获得的乙醇相关数据,进一步验证了菌群利用纤维素一步法生产乙醇的可能性。另外部分菌株在生长过程中产生的表面活性剂类代谢产物也会一定程度上促进纤维素的降解[25-26]。
另一方面,通过对比表中不同时间的组成情况可以看出,即使对于一个稳定的菌群,其在不同阶段的菌种组成也是不尽相同的,在不同的阶段,随着培养基中成分的变化,菌群中的组成也随之变化,依据之前的酶活曲线,当达到降解最高峰,即酶活达到最高时,菌群中的优势菌群为梭菌,由此可以推测,在菌群中起到主要的纤维素降解作用的菌应当是梭菌。由于梭菌主要进行的是厌氧发酵,因而其糖代谢主要产物为乙醇或者乙酸,随着发酵的进行,乙醇和乙酸等会在体系中大量积累,正如气质检测所示,在发酵液中检出的主要组分为乙醇和乙酸。
3 结论
本课题组利用传统中药“君臣佐使”原理,采用限制性继代培养方法,构建并优化得到传代稳定、纤维素降解能力强的兼性厌氧菌群 H,滤纸经其降解72 h后失重率高达90%,内切酶活性达1.93 IU,外切酶活性达3.6 IU。在发酵过程中,不同阶段占据优势的菌种是变化的,当具有高效纤维素降解能力的梭菌成为优势菌后,达到了最高的纤维素酶酶活。同时,兼性厌氧菌群H具有一定的乙醇生产能力,经测定,在发酵第3天,发酵液中乙醇的积累量达到 1.54 g/L的浓度,显示了其在一步法 CBP(Consolidate bioprocessing)发酵产乙醇方面的应用前景。
在之后的研究中还需要利用蛋白组学分析获得的关于纤维素降解相关酶类信息更一步的解释菌群降解纤维素的优势,与基因组学获得的菌群组成信息进行交互验证,从而可以更有效地探索菌群优化和简化的途径,实现利用菌群进行一步法生产纤维素乙醇。
REFERENCES
[1]Shi L, Zhao YC, Chai XL.Comprehensive utilization techniques progress of crop straws in China.China Biogas, 2005, 23(2): 11−19.石磊, 赵由才, 柴晓利.我国农作物秸秆的综合利用技术进展.中国沼气, 2005, 23(2): 11−19.
[2]Wang XA.Research on conversion and use of biomass energy.Sci Technol Chem Ind, 2009, 17(1): 51−55.王香爱.生物质能的转化和利用研究.化工科技, 2009,17(1): 51−55.
[3]Li YH, Ding M, Wang J,et al.A novel thermoacidophilic endoglucanase, Ba-EGA, from a new cellulose-degrading bacterium,Bacillussp.AC-1.Appl Microbiol Biotechnol,2006, 70: 430−436.
[4]Gao JM, Weng HB, Xi Y.Isolation and identif ication ona thermoacidophilic fungus of high-producing cellulase and the characteristics of its enzyme.Microbiol China,2007, 34(4): 715−718.高建民, 翁海波, 席宇, 等.一株嗜热嗜酸纤维素酶高产霉菌分离鉴定及其酶学性质研究.微生物学通报,2007, 34(4): 715−718.
[5]Shen JL, Mao AJ, Wang YL.Production and application of cellulase from trichoderma reesei 813A for conversion of lignocellulose into ethanol.Acta Microbiol Sin, 2004,44: 507−510.沈金龙, 毛爱军, 王远亮.纤维素酶在木质纤维素生物质转化中的应用研究.微生物学报, 2004, 44: 507−510.
[6]Thierie J, Penninckx MJ.Modeling of competitive mutualistic relationships.Application to cellulose degradation byStreptomycessp.strains.Curr Microbiol,2007, 55: 507−511.
[7]Cui ZJ, Li MD, Piao Z,et al.Selection of a composite microbial system MC1 with efficient and stability cellulose degradation bacteria and its function.Environ Sci, 2002, 23(3): 36−39.崔宗均, 李美丹, 朴哲, 等.一组高效稳定纤维素分解菌复合系 MC1的筛选及功能.环境科学, 2002, 23(3):36−39.
[8]Song AD, Wang L, Li SZ.Isolation and enzymatic characteristics of cellulase producing microbial community.Chin J Eco-Agri, 2010, 18(2): 356−359.宋安东, 王磊, 李十中.产纤维素酶菌群的筛选及其酶学特性研究.中国生态农业学报, 2010, 18(2): 356−359.
[9]Sun BK, Wang DW.Selection of a microbial community with capacity of degrading cellulose effectively and its characteristics.Environ Sci Manag, 2008, 33: 116−119.孙宝魁, 王东伟.高效稳定纤维素分解混合菌群的筛选及分解特性研究.环境科学与管理, 2008, 33: 116−119.
[10]Feu HY, Chang ZZ, Wang SM,et al.Screening and characteristics of cellulose degrading microbial flora under a constant temperature.J Ecol Rural Environ, 2007,23(3): 60−64.费辉盈, 常志州, 王世梅, 等.常温纤维素降解菌群的筛选及其特性初探.生态与农村环境学报, 2007, 23(3):60−64.
[11]Updegraff DM.Semimicro determination of cellulose in biological materials.Anal Biochem, 1969, 32: 420−424.
[12]Wang XF, Gao LJ, Yang HY,et al.Effect of inoculating lactic bacteria community Al2 and microbial shifts during alfalfa ensiling process.Transactions of the CSAE, 2007,23(1): 217−222.王小芬, 高丽娟, 杨洪岩, 等.苜蓿青贮过程中乳酸菌复合系 A12的接种效果及菌群的追踪.农业工程学报,2006, 23(1): 217−222.
[13]Muyzer G, Waal ECD, Uitterlinden AG.Profiling of complex microbial population by denaturing gradient gel electrophoresis analysis of polymerase chain react ion-amplified genes coding for 16S rRNA.Appl Environ Microbiol, 1993, 59(3): 695−700.
[14]Yang HY, Gao LJ, Wang XF,et al.Effects of cultivation conditions on microbial diversity of rice straw converted into fodder.J Environ Sci, 2007, 19(1): 67−73.
[15]Kato S, Haruta S, Cui ZJ,et al.Stable coexistence of five bacterial strains as a cellulose-degrading community.Appl Environ Microbiol, 2005, 71(11): 7099−7106.
[16]Murashima K, Kosugi A, Doi RH.Synergistic effects on crystalline cellulose degradation between cellulosomal cellulases fromClostridium cellulovorans.J Bacteriol,2002, 184: 5088−5095.
[17]Turon X, Rojas OJ, Deinhammer RS.Enzymatic kinetics of cellulose hydrolysis a QCM-D study.Langmuir, 2008,24: 3880−3887.
[18]Mickael D, Emmanuel G, Henri P.Cellulose catabolism byClostridium cellulolyticumgrowing in batch culture on defined medium.Appl Environ Microbiol, 2000, 66(6):2461−2470.
[19]Sridhar J, Eiteman MA, Wiegel JW.Elucidation of enzymes in fermentation pathways used byClostridium thermosuccinogenesgrowing on inulin.Appl Environ Microbiol, 2000, 66: 246−251.
[20]Chen MY, Tsay SS, Chen KY.Pseudoxanthomonas taiwanensissp.nov., a novel thermophilic, N(2)O-producing species isolated from hot springs.Int J Syst Evol Microbiol, 2002, 52: 2155−2161.
[21]Kato S, Haruta S, Cui ZJ.Clostridium straminisolvenssp.nov., a moderately thermophilic, aerotolerant and cellulolytic bacterium isolated from a cellulose-degrading bacterial community.Int J Syst Evol Microbiol, 2004, 54:2043−2047.
[22]Padden AN, Dillon VM, Edmonds J,et al.An indigo-reducing moderate thermophile from a woad vat,Clostridium isatidis sp.nov..Int J Syst Bacteriol, 1999,49: 1025−1031.
[23]Shiratori H, Ohiwa H, Ikeno H,et al.Lutispora thermophila gen.nov., sp.nov., a thermophilic,spore-forming bacterium isolated from a thermophilic methanogenic bioreactor digesting municipal solid wastes.Int J Syst Evol Microbiol, 2008, 58: 964−969.
[24]Ronald MT, Peter JW.Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen.Appl Environ Microbiol, 1982, 43: 777−780.
[25]Zeng J, Ye Y, Gong DC,et al.Effects of the use of surface active agents on the hydrolysis of cellulase.Liquor-Making Sci Tech, 2008, 12: 38−43.曾晶, 叶媛, 龚大春, 等.表面活性剂对纤维素酶水解过程的影响.酿酒科技, 2008, 12: 38−43.
[26]Jan BK, Johan B, Maria HB,et al.Use of surface active additives in enzymatic hydrolysis of wheat straw lignocelluloses.Enzyme Microb Tech, 2006, 7(14): 1−8.
Cellulose hydrolysis and ethanol production by a facultative anaerobe bacteria consortium H and its identification
Ran Du, Shizhong Li, Xiaoqing Zhang, and Li Wang
Institute of Nuclear and New Energy Technology, Tsinghua University, Beijing 100084, China
Received:May 24, 2010;Accepted:June 18, 2010
Supported by:Key Projects in the National Science and Technology Pillar Program during the Eleventh Five-Year Plan Period(No.2006BAD07A01).
Corresponding author:Shizhong Li.Tel: +86-10-62772123; Fax: +86-10-80194050; E-mail: szli@tsinghua.edu.cn“十一五”国家科技支撑计划(No.2006BAD07A01)资助。

