细菌发酵产黄姜薯蓣皂苷元的分离纯化
王 亚 南, 富 瑶 瑶, 王 颖, 鱼 红 闪, 金 凤 燮
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
黄姜又名盾叶薯蓣[1],主要活性物质为薯蓣皂苷,其学名为3-O-α-L-鼠李糖-(1→4)-[α-L-鼠李糖-(1→2)]-β-D-吡喃葡萄糖基-薯蓣皂苷元[2],是生产甾体激素类药物原料,常用于治疗风湿关节炎、心脑血管疾病等[3-4]。由于薯蓣皂素的需求量非常大,现有的传统加工工艺采用黄姜全料酸解,使用的盐(硫)酸量大,造成污水量大,COD浓度高,并且酸降解的有机物质多,对环境造成重大污染,因而使用生物法酵解皂苷生产皂素已成为发展趋势。刘冰[5]、王元好[6]等分别用真菌sp.D00b、sp.D38b来源的薯蓣皂苷酶在植物体外水解穿山龙薯蓣皂苷,并对酶解产物进行了分离纯化,得到3-O-(β-D-吡喃葡萄糖基)-薯蓣皂苷元。作者采用细菌Rhodopseudomonassp.No.18直接对黄姜生药进行发酵,转化黄姜中的薯蓣皂苷得到薯蓣皂素和低糖基薯蓣皂苷,并对发酵产物进行分离、纯化和鉴定。
1 材料与方法
1.1 材 料
黄姜薯蓣皂苷发酵产物,实验室自制;薯蓣皂苷及薯蓣皂苷元标准品,产地陕西;细菌Rhodopseudomonassp.No.18,韩国KAIST大学提供;薄层层析板;硅胶。
1.2 方 法
1.2.1 黄姜薯蓣皂苷发酵产物的制备
将黄姜与水按1∶1比例均匀混合,灭菌后接入Rhodopseudomonassp.No.18菌,在30 ℃下进行发酵培养4 d。发酵结束后用3倍体积的石油醚对发酵培养基进行脱脂,滤掉石油醚;待培养基中残留石油醚挥发完全后,向培养基中加入4倍体积的水饱和正丁醇,24 h后过滤,收集滤液。水饱和正丁醇反复提取3次,滤液浓缩干燥即获得黄姜薯蓣皂苷发酵产物。
1.2.2 硅胶柱层析法分离黄姜薯蓣皂苷发酵产物
样品胶的制备:将黄姜薯蓣皂苷发酵产物溶于甲醇,待完全溶解后,缓慢加入适量的80~100目硅胶,不断搅拌,使发酵产物与硅胶结合,置于60 ℃水浴加热,待溶剂完全挥发后即得样品胶。
装柱:取适量300~400目硅胶作为分离胶。将分离胶缓慢装入玻璃柱中,真空吸实,使其铺放均匀。在分离胶上层均匀装入制备好的样品胶,样品胶表面覆盖脱脂棉。装柱过程中要注意保持柱子垂直,以及各层硅胶面的水平。
梯度洗脱:装好的硅胶柱首先通入氯仿通柱,直至色素至分离胶底部,然后依次按照V(氯仿)∶V(甲醇)=9.5∶0.5、9∶1进行梯度洗脱。分别收集洗脱液,即可得到薯蓣皂苷单体,TLC检测分离结果。洗脱液经减压浓缩,蒸干即得到固态单体。
1.2.3 薄层层析法检测黄姜薯蓣皂苷
在薄层层析板上,用微量点样器吸取标准品,点样于薄层层析板上。每次点样依照样品浓度确定点样量,每次点样后需风干。将点好样品的硅胶板放入层析缸的展开剂中,浸入展开剂的深度为距薄层板底边0.5~1.0 cm(切勿将样点浸入展开剂中),密封盖,待展开至规定距离(一般为4.5 cm)后,取出,吹干溶剂,喷10%H2SO4水溶液后,加热显色。展开剂:V(氯仿)∶V(甲醇)∶V(水)=7∶3∶0.5(均相);点样量:2~5 μL。
1.2.4 HPLC方法测定黄姜酶解产物单体的纯度
仪器:高效液相色谱分析仪(Waters Water 490 Programmable UV Detector、Waters 740 Data Module);色谱柱:Hypersil(R) ODS2反相柱;柱规格:φ4.6 mm,200 mm;填料:C18,5 μm ;进样量:10 μL;流动相,V(乙腈)∶V(水)=7∶3;均为色谱纯。将所需流动相按要求比例配比,即取乙腈350 mL,超滤水150 mL(超滤膜、真空泵抽滤),混合均匀,用超声波超20 min除去气泡;检测波长:209 nm;体积流量:1.0 mL/min;柱温:25 ℃。样品预处理:取样品1 mg,溶于1 mL甲醇中。
2 结果与讨论
2.1 黄姜薯蓣皂苷发酵产物的制备
根据“1.2.1”的方法,将黄姜500 g发酵培养4 d。发酵后的培养基经1 500 mL石油醚脱脂后,用2 000 mL水饱和正丁醇反复3次提取发酵产物,收集滤液,浓缩干燥得黄姜薯蓣皂苷发酵产物15.2 g。
2.2 硅胶柱层析法分离黄姜薯蓣皂苷发酵产物
称取黄姜薯蓣皂苷发酵产物10 g放入瓷碗中,倒入适量甲醇,搅拌使固体粉末充分溶解后,与20 g 80~100目的硅胶均匀混合,使黄姜薯蓣皂苷发酵产物被硅胶吸附,置于60 ℃水浴加热,待溶剂挥发尽后即制得样品胶。称取300~400目分离胶200 g,装柱,保持上表面水平,抽真空使之细密均匀,再装入干燥好的样品胶。首先用约500 mL的纯氯仿通柱,然后用V(氯仿)∶V(甲醇)=9.5∶0.5的氯仿-甲醇流动相每次200 mL洗脱皂苷,分别收集,TLC法检测。从第3瓶开始皂苷被洗下,至第21瓶时目的产物薯蓣皂苷元几乎全被洗下,此时换用极性稍大的V(氯仿)∶V(甲醇)=9∶1的流动相继续洗脱,至43瓶时产物Ⅱ几乎完全被洗下。最后用甲醇将残余的皂苷完全洗下,TLC 检测结果如图1所示。
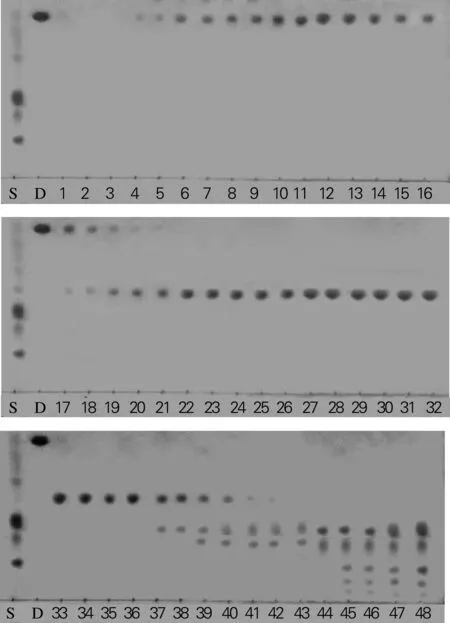
S,黄姜薯蓣总皂苷;D,薯蓣皂素;1~48,分离后收集产品的瓶号图1 发酵产物分离纯化检测结果Fig.1 Separation and purification of fermented product on TLC
由图1可以看到,当洗脱液为V(氯仿)∶V(甲醇)=9.5∶0.5时,从第3至第17瓶为目的产物薯蓣皂苷元,到21瓶时薯蓣皂苷元已经完全洗脱。此时增加洗脱液极性,当洗脱液为V(氯仿)∶V(甲醇)= 9∶1时,第22瓶开始出现产物Ⅱ,至42瓶时洗脱完全。
收集产物Ⅰ洗脱液(1~17瓶) 浓缩干燥得到晶状粉末2 g,得率为20%,收集产物Ⅱ洗脱液(23~36 瓶),浓缩干燥后得粉末4.2 g,得率为42%。产物Ⅰ为发酵产物薯蓣皂苷元;产物Ⅱ为分离得到的发酵副产物皂苷单体,其各洗脱液成分、得率见表1。
2.3 高效液相色谱法测定黄姜薯蓣皂苷发酵产物的纯度
取产物Ⅰ1 mg,溶于1 mL色谱甲醇中,采用HPLC法检测产物Ⅰ纯度,结果如图2所示。由图2可知,样品Ⅰ的保留时间为23.097 min,峰面积为6 456 675 μV·s,质量分数为96.9%。由此可知,黄姜薯蓣皂苷元的纯度约为96.9%。
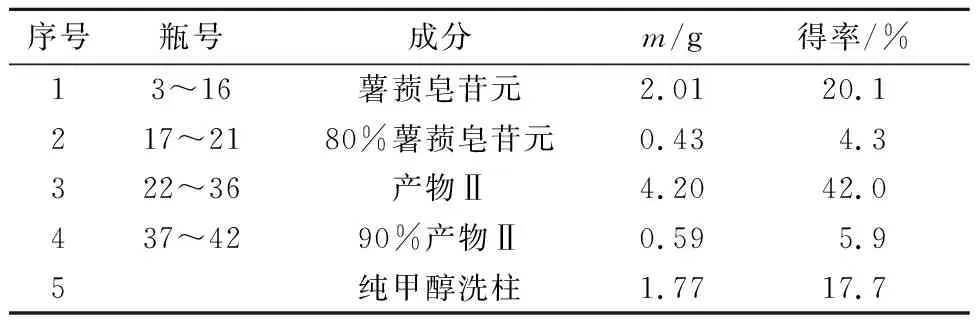
表1 黄姜酵解产物洗脱收集表Tab.1 Prepare for the separation of the product
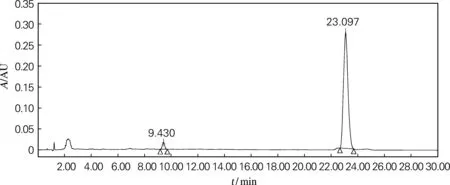
图2 薯蓣皂苷元的HPLC检测图谱Fig.2 The diosgenin on HPLC
3 结 论
黄姜经细菌直接发酵法制得粗产物15.2 g。黄姜发酵产物10 g经硅胶柱梯度洗脱分离提纯后,得到两种产物。产物Ⅰ为目的产物黄姜薯蓣皂苷元,收集到硅胶柱分离的单点2 g,得率为20%;利用高效液相色谱对其进行纯度测定,层析得到的薯蓣皂苷元纯度为96.9%。产物Ⅱ为反应副产物,收集得4.2 g,得率为42%,其结构、性质及理化作用有待进一步的研究。综上可知,经细菌直接发酵黄姜产薯蓣皂苷元的方法,产物得率不高,其经硅胶柱分离纯化后,各组分分离较完全,所得单体纯度较高。
[1] 杨如同,唐世蓉,潘福生,等. 药源植物盾叶薯蓣甾体皂苷及皂苷元的研究进展[J]. 中国野生植物资源, 2007, 26(4):1-5.
[2] YU Hong-shan, GONG Jin-mei, ZHANG Chun-zhi, et al. Purification and characterization of ginsenoside-α-L-rhamnosidase[J]. Chemical Pharmaceutical Bulletin, 2002, 50(2):175-178.
[3] 赵玉婷,徐增莱,戴传超,等. 薯蓣皂苷水解酶的发酵及粗酶的性质研究[J]. 食品科学, 2007, 28(8):269-272.
[4] 张裕卿,王东青. 利用生物技术协同提取薯蓣皂素[J]. 精细与专用化学品, 2005, 13(1):7-10.
[5] 刘冰,王元好,朱宏丽,等. 穿山龙薯蓣皂苷酶解产物的分离纯化[J]. 大连轻工业学院学报, 2006, 25(3):161-163.
(LIU Bing, WANG Yuan-hao, ZHU Hong-li, et al. Separation and purification of dioscin hydrolysate[J]. Journal of Dalian Institute of Light Industry, 2006, 25(3):161-163.)
[6] 王元好,刘冰,鱼红闪,等. 穿山龙薯蓣皂苷酶解产物的分离纯化[J]. 大连轻工业学院学报, 2005, 24(1):1-3.
(WANG Yuan-hao, LIU Bing, YU Hong-shan, et al. Separation and purification of dioscin products from enzyme reaction[J]. Journal of Dalian Institute of Light Industry, 2005, 24(1):1-3.)

