过氧化苯甲酰在空气中的热分解动力学研究
张 帆,谢传欣,顾 静
(化学品安全控制国家重点实验室,山东 青岛266071)
继续教育
过氧化苯甲酰在空气中的热分解动力学研究
张 帆,谢传欣,顾 静
(化学品安全控制国家重点实验室,山东 青岛266071)
利用热分析技术对过氧化苯甲酰在空气中的热分解进行了实验研究,考察了升温速率分别为0.1、0.2、0.5、1K·min-1时过氧化苯甲酰的放热情况。分别用传统的计算方法和等转化率法得到了反应的动力学参数,在不同升温速率条件下,传统计算方法得到的活化能为9.16、22.17、36.86、64.71kJ·mol-1;用等转化率方法得到的活化能范围为90~230kJ·mol-1。相对于传统方法,等转化率方法计算得到的表观活化能与实际反应的契合度更高。
过氧化苯甲酰;动力学;热分析;等转化率;活化能
Abstract:According to thermal analysis technology,the thermal decomposition of benzoyl peroxide(BPO)in air was studied.The exothermic situation of BPO were investigated at the heating rate of 0.1,0.2,0.5,1K·min-1.The kinetic parameters of reactions were obtained by traditional computationalmethod and isoconversionalmethod respectively.At different heating rate,the active energies gained by traditional computationalmethod were 9.16,22.17,36.86,64.71kJ·mol-1.The active energies obtained by isoconversionalmethod were in the range of 90~230kJ·mol-1.Compared to traditional computationalmethod,the apparent active energies gotten by isoconversional method weremuch closer to actual reaction.
Key words:benzoyl peroxide;kinetics;thermal analysis;isoconversionalmethod;active energy
过氧化苯甲酰(BPO)是一种应用十分广泛的精细化工产品。在常温下比较稳定,但干燥状态下易燃,受热、撞击或摩擦时均有发生爆炸的危险。国内外均发生过由过氧化苯甲酰爆炸引发的事故[1,2]。为了确保过氧化苯甲酰在运输、储存及使用等过程中的安全性,必须对其潜在的热危险性进行科学的评价。其中,热分析动力学在研究过氧化苯甲酰热分解特性过程中发挥了重要的作用。
热分析是在程序控制温度下,测量物质的物理性质与温度关系的一种技术。由于它具有独特的优点如快速、试样用量少、不需要分析反应物和产物等,近几十年来,热分析动力学在各个方面都有很大的发展,被广泛应用于各个研究领域。热分析动力学是应用热分析技术研究物质的物理性质和化学反应速率及机理的一种方法,可以获得反应的动力学参数和机理函数[3,4]。热分析的程序控温可分为等温条件和非等温条件,由于后者比前者具有独特的优点,已逐渐成为热分析动力学的核心,通过此方法可为物质的热分解、热老化等热性能提供有用的参考数据,可以作为工业生产中最佳工艺条件评定的重要指标。
本文通过使用高感度的C80量热仪分析过氧化苯甲酰受热分解时的反应和放热特性,获取其动力学参数如活化能、指前因子等。
1 实验部分
1.1 样品及仪器
过氧化苯甲酰(工业品 山东邹平恒泰化工有限公司)。
C80量热仪(法国SETARAM公司)。其结构简图见图1。C80量热仪测定原理与差示扫描量热仪(DSC)基本一致,即在程序温度控制下,测量处于同一温度区域的样品和参比物之间单位时间的能量差(或功率差)随温度的变化规律。C80量热仪可以通过设置不同的试验程序,测量各类化学以及物理过程的热效应,同时还可以测定诸如比热容、热传导系数等热物性参数。通过解析测定得到的实验结果,可以求得各类化学物质化学反应过程的动力学参数和热力学参数(活化能、指前因子、反应热等),从而求解其化学反应动力学机理。
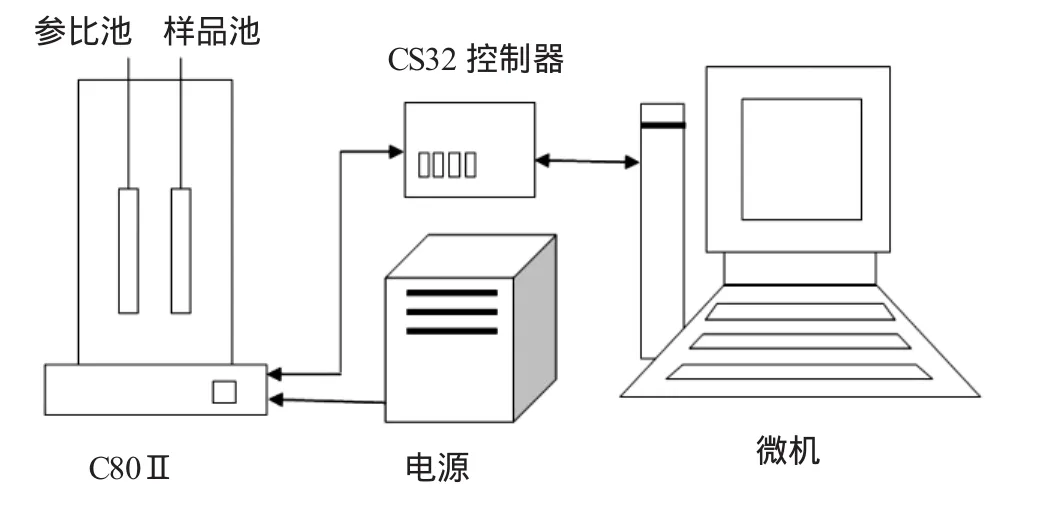
图1 C80量热仪示意图Fig.1 Layoutof C80 Calorimeter
1.2 实验方法
称取适量的过氧化苯甲酰添加到样品池内,参比池内放同等质量的惰性物质(Al2O3),然后将参比池和样品池装入C80量热仪内。根据过氧化苯甲酰的性质,30~200℃升温速率分别设定为0.1、0.2、0.5、1.0K·min-1,实验气氛为空气。用C80控制软件实时观察实际反应进程,直到实验结束。
2 结果与讨论
2.1 过氧化苯甲酰反应的热效应
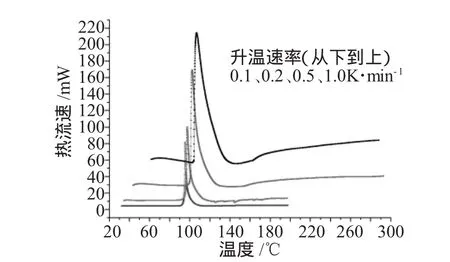
图2 不同升温速率下过氧化苯甲酰热流速曲线Fig.2 Heat flow of BPO in different heating rates
图2为实验测得的过氧化苯甲酰在不同升温速率下的热流速曲线。热流速随温度的变化规律基本相似。热流速曲线中都只有一个放热峰,初始放热温度也基本接近,从下到上依次为92、93、99、102℃。唯一不同是随着升温速率的提高,相同温度下的热流速值增大,且热流速的峰值增大,即过氧化苯甲酰分解反应的激烈程度增加。
通过将不同升温速率下过氧化苯甲酰的热流速曲线在其反应区间内积分,得到该物质的反应放热量,即反应热,结果见表1。

表1 不同升温速率下过氧化苯甲酰的反应热Tab.1 Reaction heatof BPO in differentheating rates
这一热量是导致反应系统温度升高,反应速率增大,引起气体膨胀和压力升高的根本原因。通常反应热越大,系统的温升越高,反应物可能越不稳定。由表1的结果发现,不同升温速率下,过氧化苯甲酰热分解反应的放热量基本相同。如果只单纯地比较反应热,不同升温速率下,过氧化苯甲酰反应造成的热危险程度比较接近。但是,反应热给出的是整个反应过程中放热量的积分值,不能描述在反应过程中放热随温度变化的情况,因此,不能将反应热做为评价过氧化苯甲酰热危险性的唯一指标。
2.2 传统方法计算动力学参数
根据化学反应理论和阿伦尼乌斯定律,在反应初期,反应速率较低,反应消耗的物料量少,近似地认为样品质量不变。对化学反应速率公式进行推导简化后,可以得到用以描述化学反应放热速率的关系式[5]:




同理,可得其它升温速率下过氧化苯甲酰的活化能和指前因子,结果见表2。
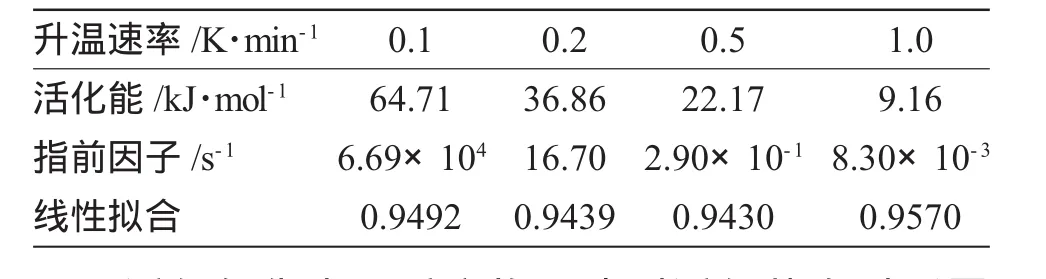
表2 不同升温速率下过氧化苯甲酰活化能、指前因子Tab.2 Activation energy and pre-exponential factors of BPO in different heating rates
活化能代表了反应物要达到活化状态时所需的能量,该能量越小,反应越易进行。由表2结果可知,不同升温速率下,过氧化苯甲酰活化能、指前因子的计算值不同。随着升温速率的提高,计算得到的活化能、指前因子逐渐变小。也就是说,随着升温速率的提高,过氧化苯甲酰的活化能变小,发生分解反应的激烈程度增加,反应较易进行。
3.3 等转换率法动力学参数计算
多重扫描速率的不定温法是目前比较先进的热分析方法,其原理是利用不同加热速率下测得的多条热分析曲线进行动力学分析。由于其中的一些方法常用到在多条曲线上同一转化率下的数据,所以也称为“等转化率法”(iso-conversionalmethod)。这种方法能在不涉及动力学模式函数的情况下获得较为可靠的反应活化能值,因此,也叫做“无模式函数法”(model-freemethod)[6]。等转化率法可以用来对单个扫描速率法的结果进行验证,而且还可以通过比较不同转化率下的活化能核实反应机理在整个过程中的一致性;此外,当出现几种彼此独立的竞争反应时,其反应本质可以用提高或降低升温速率的方法来揭示。
等转化率方法的计算有多种,基本上可以分为积分和微分两个大类。典型方法包括Flynn-Wall-Ozawa(FWO)法、Kissinger-Akahira-Sunose(KAS)法、Coats-Redfern 法、Friedman 法等[7-10]。积分法对热分析结果要求简单,但是计算中会涉及一个无法精确求解的方程,微分法在使用过程中不涉及假定与近似,数据结果更接近真实。
Friedman法是典型的微分法,具体方法为:
设非定温状态的升温速率为β,则T=To+βt,可以得到方程:

由ln[βd a/d t]对1/T作图,用最小二乘法拟合数据,由斜率可得活化能。
从Friedman法的表达式可以发现,该式不涉及任何假定与近似,这样其计算结果比较准确,接近真实情况。
应用此方法分析处理BPO的放热曲线见图4。
图中4条曲线分别是升温速率为0.1、0.2、0.5、1K·min-1情况下ln[d a/d t]对1000/T的关系,将不同升温速率条件下,同一转化率的点相连接,可以得到无数直线,这些直线各自的斜率就是在此转化率下的活化能。
分析得到的活化能与转化率的关系曲线如图5所示。
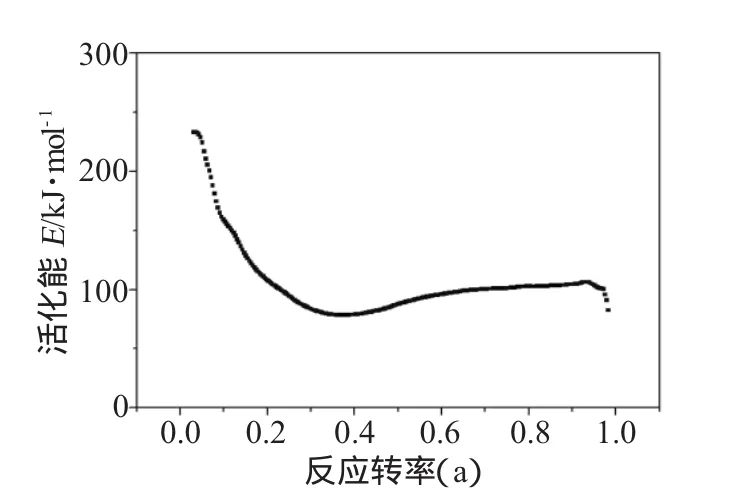
图5 不同转化率下过氧化苯甲酰的反应活化能Fig.5 Activation energy of BPO in different conversions
反应开始时和结束时出现了离散的数据,这是由于反应两端在不同转化率条件下的差距变化比较大。总体来看,活化能基本按照一定的规律进行变化,形成了一条较为平滑的曲线。反应在初始时的活化能最高,随着反应开始迅速降低,当达到一定程度后,趋于稳定并伴有轻微上升,快到终点时又快速下降。
BPO在分解过程中,活化能并不是一个恒定的值,从总趋势来看,随转化率的增加,活化能减小。在非等温的热分析方法中,热分解是在一定加热速率的热场中进行的,这样,样品自身的热传导造成样品内外以及样品与周围气氛之间存在着温度差,因而可以认为样品自始至终处于一种非热平衡状态,在此基础上得到的反应机理以及反应动力学参数显然与热平衡下的理论情况会存在一定的偏差;同时,随着分解反应的进行,未分解的样品份额越来越少,而温度越来越高,因此,反应速率也不断加快。
另外,从数学处理过程来看,活化能随反应进度而变化这一现象似乎与Arrhenius方程的一个假定相冲突,即活化能E为一定值,因为只有在这一前提下,各种相关数学方法的推导才是正确的。Arrhenius方程是基于均相定温反应体系提出的,活化能的概念也完全是针对基元反应而言的,因此,对于复杂的非均相不定温体系,Arrhenius方程在这里已经失去了本来所蕴含的物理意义,而只是一个数学计算公式,这也意味着通过非定温热分析实验以及相应的数学处理得到的并不是反应的本征活化能,而只能是表观活化能。
4 结论
(1)在不同升温速率下,用传统方法计算得到的BPO反应活化能从小到大依次为9.16、22.17、36.86、64.71kJ·mol-1。
(2)用等转化率方法计算得到了活化能随转化率变化的曲线,计算得到的BPO分解反应活化能范围为 90~230kJ·mol-1。
(3)BPO在分解过程中,其反应活化能并不是恒定值,随着转化率的增加,活化能减少,反应机理随反应过程而变,等转化率方法更符合反应的实际进程。
(4)非定温实验与相应数学分析得到的反应活化能不是反应的本征活化能,而是表观活化能,准确合理的表观活化能数据对于判断反应的动力学进程具有重要的意义。
[1]Yih-ShingDuh,XiaoHuiwu,and Chen-Shan Kao.Hazard Ratings for Organic Peroxides[J].Process Safety Progress,2008,27(2):89-99.
[2]孙金华,丁辉.化学物质热危险性评价[M].北京:科学出版社,2005.
[3]任宁,张建军.热分析动力学数据处理方法的研究进展[J].化学进展,2006,18(4):410-416.
[4]沈玉芳,陈栋华,胡小安.热分析动力学处理方法现状及进展[J].中南民族大学学报,2002,21(3):11-15.
[5]孙金华,陆守香,孙占辉.自反应性化学物质的热危险性评价方法[J].中国安全科学学报,2003,13(4):44-47.
[6]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001.24.
[7]B Roduit,Ch.Borgeat,B Berger,et al.The prediction of thermal stability ofself-reactive chemicals[J].Journalof Thermal Analysis and Calorimetry,2005,80:91-102.
[8]OZAWA T.Thermalanalysis review and prospect[J].Themochim Acta,2000,355:35-42.
[9] Opfermann J.Kinetic analysis using multivariate non-linear regression Ibasic concepts[J].Them.Anal.Cal.,2000,60:641-658.
[10]Brown M E,Maciej EwskiM,V Yazov Kin S,etal.Computational aspect s of kinetic analysis.Part A:The ICTAC kinetics Project-data,methods and results[J].Themochim Acta,2000,355:125-143.
Study on thermokinetics of dcomposition of benzoyl peroxide in air
ZHANG Fan,XIEChuan-xin,GU Jing
(Chemicals Safety Control National Key Laboratory,Qingdao 266071,China)
X937
A
1002-1124(2010)01-0023-04
2009-11-05
张 帆(1981-),男,工程师,2007年毕业于青岛科技大学,硕士研究生,研究方向:化学品安全;曾参与国家“十一五”科技攻关计划课题“典型危险化学品反应危险性评价与防范技术研究”的研究。
——氧弹量热仪综述

