黄磷废水中碘的还原吸收实验研究
冯鹤,梁佰战,韩涛,唐晓宁,佘顺利
(贵州大学材料与冶金学院,贵州贵阳550003)
试验研究
黄磷废水中碘的还原吸收实验研究
冯鹤,梁佰战,韩涛,唐晓宁,佘顺利
(贵州大学材料与冶金学院,贵州贵阳550003)
黄磷废水中回收碘的实验整体可分为氧化、还原吸收及再氧化三个阶段。本文着重对实验中的还原吸收工艺进行了研究。主要分析了SO2用量、吸收液pH值、吸收温度、液气比、吸收时间等因素对吸收率的影响。得出最佳吸收工艺条件为:SO2用量5~8 m L/L,pH值7,液气比L/G 14~8,温度30~40℃,吸收时间8min。
黄磷废水;碘;还原吸收;吸收率
碘与人的生长发育和新陈代谢关系十分密切,是维持生命活动必不可少的一种微量营养元素[1]。与此同时,碘作为一种重要的化工原料,广泛地应用于工业、农业、医药卫生、国防等各个行业。我国碘年需求量500 t,而碘的年产量仅180 t,主要以海洋藻类及海水为主要原料[2],其提取能耗大,成本高,并且从数量上远远满足不了市场的需求,因而人们不断寻找新的含碘资源。
我国是世界第二大磷矿资源国,磷矿资源非常丰富[3]。碘是磷矿中一种重要伴生资源,虽然磷矿中的碘含量低,但是碘的储量大[4],仅贵州地区已探明储量为27亿t,远景储量上百亿吨。在磷化工生产过程中,磷矿中伴生的碘有一部分转化到磷化工废水中。黄磷废水作为一种磷化工中的含碘废水逐渐成为一种新的提碘资源。
目前,我国有黄磷生产企业100多家,生产能力达到100多万t,按照每生产1 t黄磷要产生40m3~80m3废水计算,每年可产生废水4000万m3至8000万m3,以碘浓度为80mg/L计,其中碘含量的约为3 200 t~6 400 t。因此结合以前有关碘的回收的研究[5-7],经济有效的回收含碘废水中的碘资源,尽量减少其中有害物质的排放,可以变废为宝,补充我国对碘的需求,同时减少废水排放对环境的影响。
黄磷废水中回收碘的实验整体可分为氧化、还原吸收及再氧化三个阶段。本文在实验的基础上,系统分析了影响碘还原吸收过程中碘吸收率的各个因素,对碘的工业化回收利用具有现实意义。
1 实验部分
实验所用黄磷废水来自贵州某黄磷厂,其主要化学成分见表1。

表1 黄磷废水的主要化学成分
1.2 实验原理及方法
实验利用碘量法中碘测二氧化硫的原理,以二氧化硫作为吸收剂来还原吸收空气吹出的碘单质。用硫酸调节黄磷废水的pH值,在不同酸度条件下,向黄磷废水中加入适量的氧化剂,用强氧化剂将碘离子氧化成碘分子,使碘离子从黄磷废水中游离出来,发生的重要反应为:

接着向黄磷废水吹入热空气,使游离碘分子进入气相。最后用二氧化硫溶液吸收含有碘分子的吹出气,此时,碘单质与二氧化硫溶液发生氧化还原反应,碘分子又被还原为碘离子,发生的主要反应为:

实验在自制装置中完成。整个还原吸收过程在恒温水槽中进行,用磁力搅拌器保持反应均匀,反应所需要时间用秒表记录。反应后吸收液中主要含有H2SO4、H2SO3、HI、I3-,I-浓度用硝酸银滴定,吸收液pH值用酸度计测定。
实验流程如图1所示。
2.1 NAFLD组和对照组一般资料比较 两组间性别、年龄、TBIL、DBIL差异无统计学意义(P>0.05),但NAFLD组体质指数、收缩压、舒张压、血清ALT、AST、FBG、血TG、血UA高于对照组,差异有统计学意义(P<0.05),见表1。

图1 实验流程
2 实验结果与分析
2.1 SO2用量对碘吸收的影响
SO2作为吸收碘的主要反应物其用量对碘的吸收有着直接影响,为了分析SO2用量对碘吸收率的影响程度,进行了以下实验。常温下取1L吸收液,分别控制SO2用量为1、2、3、4、5、6、7、8、9mL,吸收时间为10min,分析在不同SO2用量下的吸收液中的碘离子浓度,即可得出SO2用量与碘的吸收关系,见图2,从而得出最佳的吸收率下的SO2用量。

图2 SO2用量与碘的吸收率的关系
从图2可知,随着SO2用量的增加,吸收液中碘离子的浓度也增大,当用量增加到5mL以上时,碘离子的浓度增长变得缓慢,这是因为:
(1)可溶组分SO2在液相中发生化学反应时,组分的气相分压PSO2仅与液相中处于溶解状态(即未反应掉的)SO2之间建立物理相平衡。溶解态的SO2仅为液相中组分SO2的总浓度的一部分。同时,吸收液中的活性组分I2在界面上溶解并在向液相主体传递的同时与组分SO2发生反应。因此,开始阶段,化学反应的存在,增大了液相中可溶组分的溶解度,反映出碘的吸收速率随SO2用量增加变化很快;2)反应进行一段时间后,吸收液中的碘离子浓度富集到一定程度后,很难再附集更多的碘离子,因此,控制吸收剂的量在5~8mL/L左右。
2.2 吸收液pH值对碘吸收的影响
为了分析吸收液pH值的大小对吸收率的影响,进行以下实验。取2 000mL原液,吸收温度25℃。调节气体流量计使气体流速为0.1m3/min,考察不同的pH值条件对碘吸收率的影响。当pH值为7时,吸收率达到90%以上,随者pH值减小,吸收率随之下降,见图3。这是因为吸收过程中硫酸和氢碘酸的不断生成导致吸收液pH值降低,使SO2在溶液中的溶解度减小,从而影响整个吸收过程,进而在某种程度上限制了吸收反应的进行,同时腐蚀设备。

图3 pH值与碘的吸收率的关系
根据SO2吸收碘的速率在碱性溶液中会更高,吸收更充分,我们应选择碱性溶液,但要考虑到下一环节的碘的氧化,其氧化环境是pH值为1左右的酸性环境,所以吸收液应为弱酸性。综合考虑,控制吸收液pH值在7左右。
2.3 液气比L/G对碘吸收的影响
L/G表示每吸收1m3气体所需要的吸收液的容量。本实验中,取吸收液2 000mL,在温度为25℃,pH=5的情况下,以浓度为5%左右的SO2通入气体,碘吸收率先是随着液气比L/G的减小先恒定后逐渐增大,然后达到稳定,再增大SO2流速,则吸收率下降,见图4。其主要原因有:

图4 液气比与碘的吸收率的关系
(1)吸收反应开始时,吸收液中还没有H2SO3,开始阶段液气比决定SO2气体被吸收液吸收所需要的吸收表面。在其它参数恒定的情况下,提高液气比使气液间的接触面积增大,传质单元数将随之增大,所以开始生成H2SO3的速度很大。但是毕竟量很小,所以开始碘的吸收反应进行的很少,反应出碘的吸收率很低,且保持一段时间。
(2)随SO2流速增大,液气比L/G减小,液相中H2SO3逐渐增多,从而与碘的反应增多,反应出碘的吸收率逐渐升高。
(3)随反应的进行,吸收液的酸度逐渐增大,从而使碘的溶解度降低,SO2的溶解度降低。所以SO2气体流速增大后,反映出碘的吸收速率达到稳定。从图4中曲线的变化可以看出,随液气比值增大,吸收速率变化逐渐变缓。在液气比由16变到14,吸收速率变化最显著。这说明液气比与碘吸收反应速率并不完全成比例,液气比达到8后,吸收率基本保持不变,可以认为最佳的液气比在14~8之间。
2.4 温度对碘吸收的影响
还原吸收过程中吸收温度主要影响吸收速度和吸收效率,温度越高,还原反应速度加快,可以提高吸收率,但高温条件下的SO2的溶解度又会降低,因而以实验为依据得出温度与碘吸收率的关系,见图5。
从图中5可以看出,吸收率对吸收温度非常敏感,随着吸收液温度的升高,碘的吸收率也增大。这是因为温度升高,液体粘度减小,扩散系数增大,且超过平均活化能的分子数也相应增加,还原吸收过程的速率明显加快,温度在30℃~40℃之间,吸收率都达到80%以上,但随着温度进一步升高,其吸收率反而下降。这是因为温度过高时,SO2在吸收液中的溶解度显著降低,从图6中可以看出[8],SO2分压在100 KPa时,10℃和50℃时的溶解度就相差好几倍。另一方面,由于吸收液中还添加有碘化合物,使得碘分子和碘离子形成I3-进入碘吸收液,温度过高时,会造成溶液中I3-反向分解逸出碘蒸气,从而导致吸收率下降。因此,吸收液温度控制在30℃~40℃之间为佳。
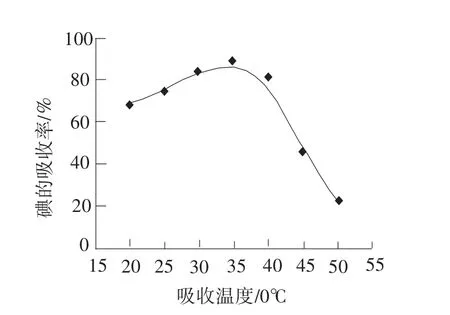
图5 吸收液温度与碘的吸收率的关系

图6 反应时间与碘的吸收率的关系
2.5 吸收时间对碘吸收的影响
在其它因素不变情况下,考虑时间对碘吸收率的影响。当吸收反应时间小于8min时,碘吸收率随着吸收反应时间的增加而增大,而当吸收反应时间高于8min时,吸收率随吸收反应时间的增加而降低,见图7。这是因为反应时间过长,吸收液中的浓H2SO4和HI作用产生了I2[9],见反应3、4。其中碘的挥发损失,造成了吸收率降低。
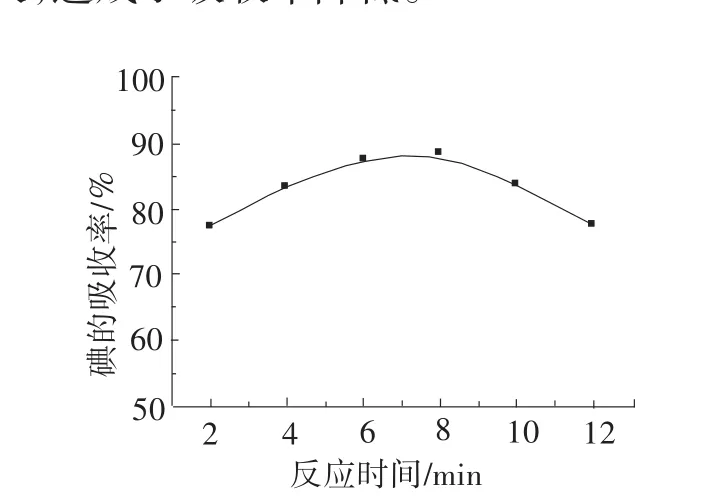
图7 反应时间与碘的吸收率的关系
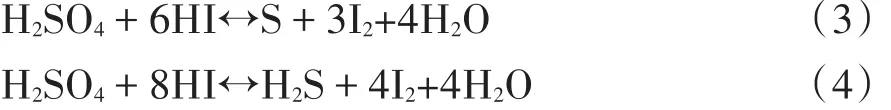
3 结论
(1)吸收剂SO2用量少,会使得碘的吸收不充分,导致碘的吸收率不高;但SO2用量太大,又会使得溶液的pH值降低,腐蚀设备,影响碘的吸收,应该控制二氧化硫吸收剂用量在5~8mL/L,pH在7左右。
(2)液气比主要与吸收剂的用量密切相关,是一个重要的吸收操作参数,要保证通入气体与吸收液能够全面充分接触,液气比在8左右为佳。
(3)碘的还原吸收对吸收液的温度非常敏感,温度对碘的还原吸收的影响具有双重作用。温度过高,二氧化硫在水中的溶解度降低,吸收剂不足,使得碘的吸收率降低;温度过低,影响还原吸收反应的速率,因此,吸收液的温度需要严格的控制,温度控制30℃~40℃为宜。
(4)时间对还原吸收过程的影响不是特别明显。
本实验所取黄磷废水中碘的浓度约为60mg/L~140mg/L,因而本文的研究对回收碘的工业化和资源综合利用具有一定的意义。
[1]钟秀倩,钟俊辉.微量元素与人体健康[J].现代预防医学,2007,34 (1):61-63.
[2]高利伟,史联军,郑江华.回收碘的研究[J].贵州工业大学学报(自然科学版),2005,34(4):13~14.
[3]刘建雄.我国磷矿资源特点及开发利用建议[J].化工矿物与加工, 2009,(3):36-39.
[4]肖先治,古开伦,罗再麟,等.贵州省志·地质矿产志[M].贵州:贵州人民出版社,1992,244-249.
[5]王景刚,冯丽娟等.碘提取方法的研究进展[J].无机盐工业.2008, (11):11-14.
[6]叶志海,游贤贵,肖丹.磷酸生产过程中碘的检测与回收初探[J].四川化工,2006(3):4-6.
[7]Ali A.Ensafi,H.Eskandari.Efficient and selective extraction of io⁃dine through a liquid membrane[J].Microchemical Journal 2001, 69:45-50.
[8]王志魁.化工原理[M].北京:化学工业出版社,1998:175.
[9]G.Caputo,C.Felici,A.Giaconia,M.Lanchi,R.Liberatore,S. Sau,P.Tarquini.Experimental Study of the Bunsen Reaction for the S-I Thermo chemical Cycle[J].Thermodynamic solar project, 2005,12.
Experim entalstudy on reduction and absorption technology of iodine from yellow phosphoruswastewater
FENG He,LIANG Bai-zhan,HAN Tao,TANG Xiao-ning,SHE Shun-li
The experimental technique of recycling Iodine from yellow phosphorus wastewater can be divided in⁃to three stages,including oxidation,reduction and absorption,reoxidation.The main researching for the factors that affect the absorbing ratio are concerned,including the amount of SO2,pH,temperature,the ratio of liquid and gas,absorption time.The best absorption process conditions are obtained by the analysis of the experiment,they are as follows:the amount of SO2:5~8m l/L,pH:7,gas/liquid ratio:14~18,temperature:30~40℃,absorp⁃tion time:8min.
yellow phosphoruswastewater;iodine;reduction and absorption;absorption rate
TQ124.6;TQ126.3
A
1672-6103(2010)05-0067-04
冯鹤(1981—),女,辽宁阜新人,贵州大学材料与冶金学院硕士研究生。
2010-06-04

