不同DO下MBR内微生物群落结构与运行效果关系
高大文,李昕芯,安 瑞,付 源,任南琪
(哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
不同DO下MBR内微生物群落结构与运行效果关系
高大文*,李昕芯,安 瑞,付 源,任南琪
(哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
应用A/O-MBR处理实际生活污水,考察了不同溶解氧(DO)条件下,微生物群落结构与其处理效果的对应关系.结果表明,DO浓度在0.2~4.0mg/L对COD去除效果无明显影响,COD平均去除率均在90%以上.DO浓度变化对NH4+-N去除影响较大,DO浓度下降到0.2mg/L时,NH4+-N平均去除率由99%下降到65%.通过PCR-DGGE分析,较高DO条件下(4.0,2.0mg/L)的总细菌微生物群落多样性高于较低DO条件(0.5,0.2mg/L),但其群落结构变化与与反应器的处理效果对应关系不明显;氨氧化菌的群落结构变化较明显,且在不同的 DO条件下起主要作用的氨氧化菌的菌属不同,其群落变化与反应器的NH4+-N去除效果相对应,DO为2.0,0.5mg/L时氨氧化菌群落结构比较相似,此时反应系统的脱氮效果也比较好.
膜生物反应器;溶解氧;PCR-DGGE;微生物群落结构;氨氧化菌
Abstract:Microbial community structure and nutrient removal performance under different dissolved oxygen were investigated using Anoxic-oxic submerged membrane bioreactor (A/O-MBR) for municipal wastewater treatment. Results showed that the COD removal was not influenced markedly by the variations in DO between 0.2mg/L and 4.0mg/L, and the COD removal was more than 90% during the whole experiment. However, the ammonia nitrogen removal was more sensitive than COD, and the ammonia nitrogen removal dropped from 99% to 65% when DO decreased to 0.2mg/L. The PCR-DGGE analysis showed that the diversity of total bacterial community was abundant when A/O-MBR was run at high DO (4.0mg/L and 2.0mg/L), and the relationships between the total bacterial community structure and the performance of MBR was not very obvious. On the contrary, the ammonia oxidizing bacterial community composition had a more obvious shift with the variation of DO concentration, and the species of ammonia oxidizing bacteria which play major role were different under different DO conditions, which were corresponded to the removal efficiency. The ammonia oxidizing bacterial community composition were similar under the DO concentration of 2.0mg/L and 0.5mg/L, and the nitrogen renmoval was enhanced.
Key words:membrane bioreactor (MBR);dissolved oxygen;PCR-DGGE;microbial community structure;ammonia oxidizing bacteria
膜生物反应器(MBR)与传统工艺相比,具有固液分离效果好、反应器内生物量高、污泥产量低、出水水质好、占地面积小等优点[1],因此在污水的净化与处理领域应用广泛.影响 MBR反应器运行效率的因素有很多,如污泥浓度、水力停留时间(HRT)、污泥龄(SRT)、溶解氧(DO)、污泥负荷等[2-3].其中 DO是极其重要的参数,许多研究[4-8]表明,将 DO控制在合适的范围之内,不仅可以提高整个反应器的效率,而且可以降低能耗.但从实质上看,微生物是生物法污水处理的主体部分,而目前有关MBR中DO的研究大多数只本研究将结合PCR-DGGE技术[9],对不同DO条件下MBR处理效果和微生物群落结构进行研究,分析DO对MBR去除有机物和氨氮效率及其微生物群落结构的影响,探讨 MBR运行特性与微生物群落结构间的相互关系,从而为 MBR的设计及应用提供理论及技术依据.
1 材料与方法
1.1 材料
接种污泥取自哈尔滨市文昌污水处理厂.进水为生活污水,其水质COD为203.9~366.0mg/L, NH4+-N为33.24~61.35mg/L,pH值为7.28~7.83.
1.2 反应器装置和运行条件
本研究采用缺氧/好氧工艺(A/O-MBR),缺氧和好氧反应器的有效体积均为8L.采用日本三菱公司生产的聚乙烯中空纤维膜,膜孔径为0.4μm,膜通量0.27m3/(m2⋅d),膜丝面积为0.11m2.装置如图1所示.

图1 反应器装置示意Fig.1 Diagram of experimental system1.原水箱. 2.蠕动泵, 3.缺氧罐, 4.气泵, 5.空气流量计, 6.好氧MBR, 7.膜组件, 8..真空压力表, 9.时序继电器
反应器采用连续进水、间歇出水的方式运行,膜出水抽吸时间比为3min/1min.实验中HRT控制为8h,回流比为 2.5,温度维持在 20~25℃,SRT为 50 d,反应器初始污泥浓度为 3200mg/L,待污泥浓度稳定在5000mg/L左右时进行排泥.以DO为 4mg/L启动反应器.反应器分别在 DO为4.0,2.0, 0.5和0.2mg/L下运行.
1.3 指标测定
每天取水样,对进水和出水水质指标进行分析,检测项目包括温度、DO、COD、NH4+-N、NO2
--N和NO3--N,均采用标准分析方法[10].
1.4 反应器微生物群落结构分析
1.4.1 基因组 DNA的提取 采用小量细菌基因组提取试剂盒(上海华舜,W6501).
1.4.2 总细菌的 PCR扩增 采用通用引物BSF338-GC和BSR518扩增,其反应体系与扩增条件参考文献[11]中的方法.PCR反应的产物用1%琼脂糖凝胶电泳检测.
1.4.3 氨氧化细菌的PCR扩增 第一轮扩增采用氨氧化细菌特异性引物[12]CTO189f和CTO654r及相应的反应程序.以第一轮PCR扩增产物为模板,采用与总细菌扩增相同的引物进行第二轮PCR扩增,PCR扩增条件与总细菌的条件相同.采用1%琼脂糖凝胶电泳检测两轮PCR产物,均得到清晰的目标条带.
1.4.4 变性梯度凝胶电泳(DGGE) 将 PCR样品5μL和10倍加样缓冲液混合,采用Bio-rad突变检测系统,用 8%的聚丙烯酰胺凝胶,变性剂浓度为30~60%,在200V的电压下,60℃电泳4h.结束后,将凝胶进行银染,获得DGGE指纹图谱.
1.4.5 目的条带的克隆与测序 挑取DGGE图谱中的目的条带溶于30μL的ddH2O中,4℃下静置过夜,以此为模板,以BSF338和BSR518为引物进行PCR扩增,其扩增程序同1.4.2.PCR产物用 1%琼脂糖凝胶电泳检测并切胶回收,应用上海华舜胶回收试剂盒.回收后产物与 PMD19-T载体连接,进行转化克隆,最后测序.
1.5 DGGE图谱及多样性分析
微生物多样性指数采用Shannon指数(H)表示,H=-∑PilgPi,其中条带强度是通过 Quantity One软件分析后得到的波峰面积表示,即Pi=ni/N,其中,ni为峰面积;N为所有峰的总面积.
同时对得到的DGGE图谱进行UPGMA聚类分析,根据不同 DO条件下的条带分布相似度构建系统进化树.
1.6 序列分析
将测序结果进行处理后提交到GenBank数据库,采用 BLAST进行目标序列和基因库中所含序列的相似性分析,得到同源性最近的序列,并应用MEGA软件建立进化树.
2 结果与讨论
2.1 DO对反应器处理效果的影响
2.1.1 DO对COD去除效果的影响 反应器在DO为4.0,2.0,0.5和0.2mg/L下运行,由于采用生活污水,膜出水COD为11.1~47.7mg/L,在4个DO浓度条件下,COD的平均去除率分别为90.42%、90.82%、91.39%和91.76%(图2).
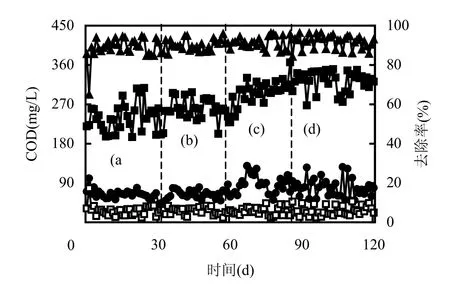
图2 不同DO条件下反应器对COD的去除效果Fig.2 COD removal under different DO concentrationa、b、c、d表示DO浓度分别为4.0,2.0,0.5,0.2mg/L时系统的运行状态
由此可见,当DO浓度降低时,COD去除效果未发生明显变化,说明在MBR中DO的变化对COD的去除影响并不显著.
2.1.2 DO对NH4+-N去除效果的影响 由于进水是生活污水,进水NO3--N和NO2--N含量很低,可忽略不计.在缺氧段, NO2--N和NO3--N积累很少,反应器中的氮素主要为NH4+-N.由图3可见,在DO为4.0,2.0和0.5mg/L条件下的稳定运行期,NH4+-N去除率>99%;当DO继续降低时,NH4+-N去除效果出现了较大波动,DO浓度下降到0.2mg/L时,其平均去除率由99%下降到65%.
在DO为4.0mg/L时,缺氧区的NH4+-N在好氧MBR中都转化为NO3--N;而当DO降低时,缺氧区的NH4+-N浓度比好氧出水的NO3--N浓度高,说明 DO浓度降低使反应系统的反硝化作用增强.DO浓度为4.0,2.0,0.5和0.2mg/L时,总氮的去除率分别为 67.39%、77.00%、80.92%和56.73%,此结果说明DO浓度为2.0,0.5mg/L时反应系统的氮素脱除效果较好.其原因为好氧段DO浓度高(4mg/L)时易造成缺氧段氧化还原电位升高,从而抑制反硝化细菌的反硝化活性,使得总氮去除率降低[13].
比较MBR中有机物和NH4+-N的去除效果可以得出,当DO浓度减少时,有机物仍可得到有效去除,而NH4+-N去除率却明显降低.其原因是反应系统内的主要异养菌受DO影响较小[14],因此 DO的变化对 COD的去除效果影响不明显.而硝化细菌对氧需求较高[15],过低的DO使得硝化细菌受到了抑制,从而使反应器去除 NH4+-N的效率下降.
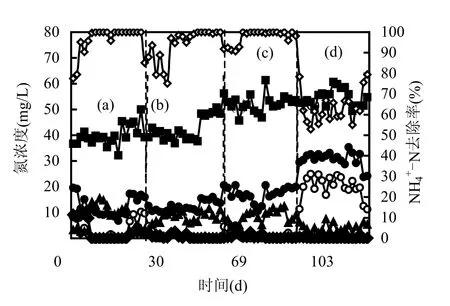
图3 不同DO条件下反应器对氮素的去除效果Fig.3 nitrogen removal under different DO concentrationa、b、c、d表示DO浓度分别为4.0,2.0,0.5,0.2mg/L时系统的运行状态
2.2 DO对反应器内微生物群落结构的影响
2.2.1 不同 DO条件下总细菌群落结构的比较 总细菌的DGGE图谱如图4(a)所示,微生物群落结构随DO浓度的变化有所不同,与原泥相比较,有部分条带随 DO变化逐渐消失或减弱,比较明显的有条带 3,5,6,7,8,12,18,21,26,29.说明这部分条带所代表的细菌对反应系统的环境适应性降低,转变为非优势种群而不在反应器运行过程的图谱中显现出来.在不同条件下,还存在各自独有的或较其他条件明显的种属,如B中的条带1,23;C中的条带9,28;D中的条带31;E中的条带14,24;还有部分在2个或3个条件下共有的条带,如条带2,4,15,16,17,19,22,36等. 但是一些微生物(条带 10,11,13,20,27,33,35)在反应器运行过程始终存在,且其在总细菌群落结构中处于优势地位.
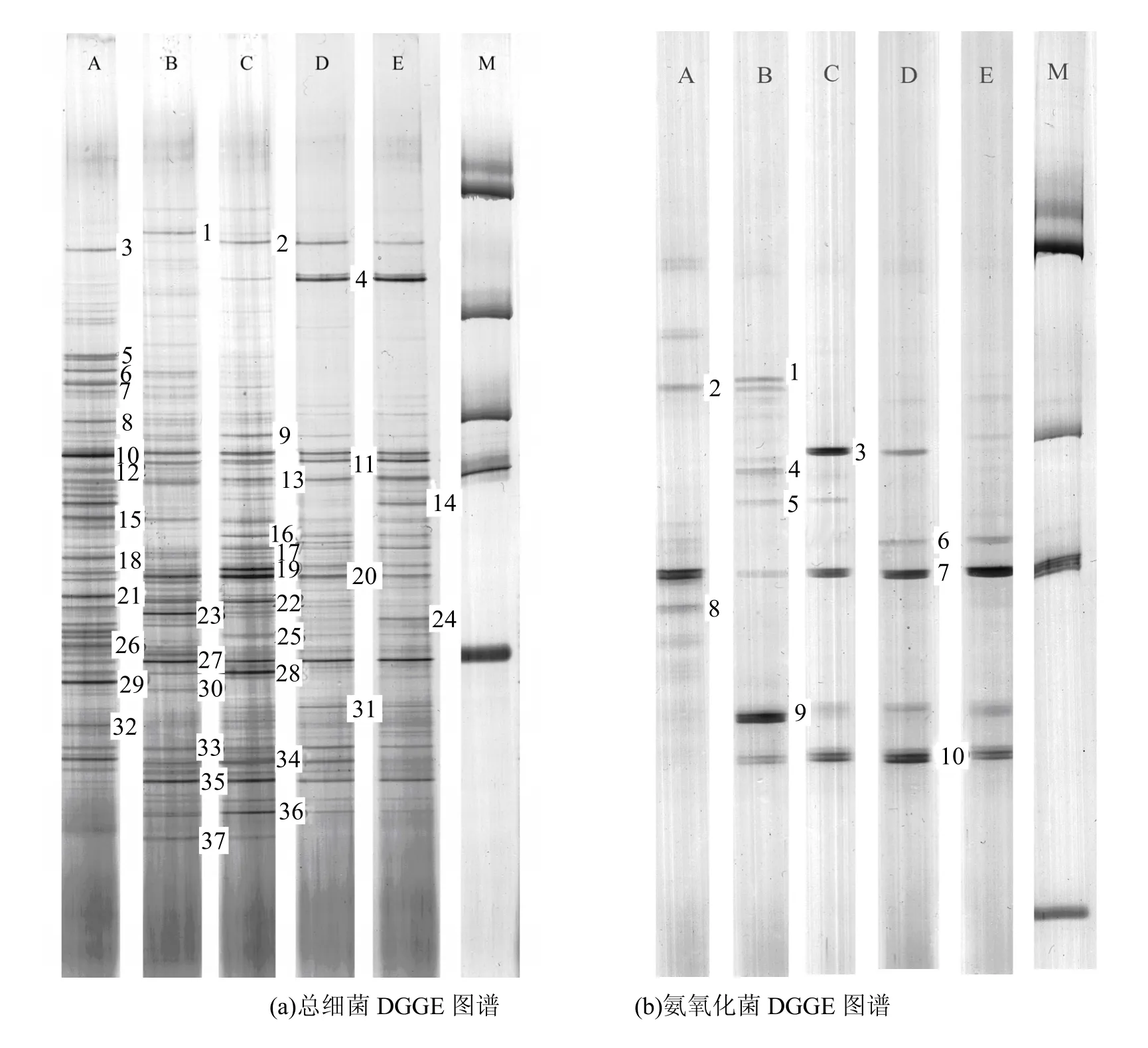
图4 不同DO条件下总细菌和氨氧化细菌DGGE图谱Fig.4 DGGE profile of total and ammonia-oxidizing bacteria under different DO concentrationA原泥 B: 4.0mg/L C: 2.0mg/L D: 0.5mg/L E: 0.2mg/L
将图 4(a)中的主要条带进行克隆测序后,在GenBank中比对,获得各条带的同源性信息,并构建其系统发育树(图5).其结果表明,MBR中微生物群落的主要优势种群分布于不同的纲或属,且进化距离较大.而且实验中分离到的很多菌种为未鉴定及培养菌种,其所属的具体种属和功能还不是很清楚,这也与张斌等[16]的研究结果相符.同时还发现有些在图谱中处于不同位置的条带,其序列比对结果相似,进化距离也较近,这些条带代表的细菌可能属于相同菌属,且有相同功能.在MBR中以变形菌门的细菌种类多一些,包括β变形亚纲和δ变形亚纲,且以β变形亚纲为主,在其他研究[16-18]中也出现过类似结果,说明这些菌群对污染物去除起主要作用.条带19,20,35遗传距
离较近,都属于红环菌科(Rhodocyclaceae),且在4个条件下均存在,在污水处理的生物降解中起主要作用;条带 9,36均为从毛单胞菌科(Comamonadaceae),在DO为4.0和2.0mg/L下较明显;条带 22,33 均为硝化螺旋菌属(Nitrospira)[19],将亚硝酸盐氧化为硝酸盐;条带14,24在低DO为0.2mg/L时较明显,文献中提到其可能与反硝化作用有关[20-21].
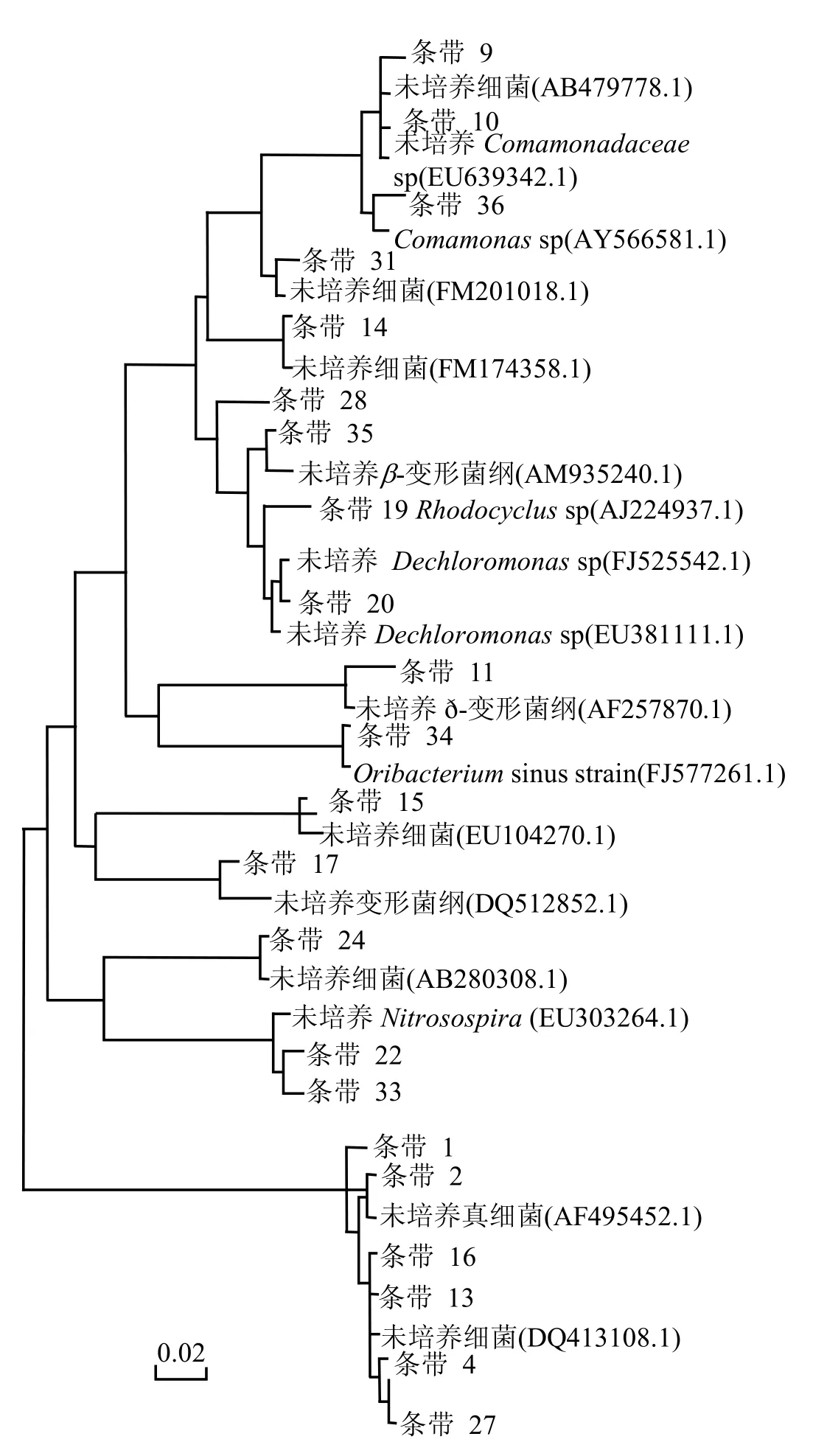
图5 MBR中总细菌系统发育树Fig.5 Phylogenetic tree of total bacteria
2.2.2 不同条件下氨氧化细菌群落结构的比较 硝化作用是废水处理系统中实现 NH4+-N去除的主要过程.氨氧化细菌在硝化作用中负责将氨氧化为亚硝酸盐,实现亚硝化作用,是硝化过程中必不可少的步骤[22].但氨氧化细菌的生长速率低,生物量很少,且 Muyzer[23]的研究表明,只有在整个群落细菌数量约 1%或以上的类群能够通过DGGE检测到,所以应用 16S通用引物扩增的DGGE条带并不能很好的反应其群落变化.而应用特异性引物进行Nested PCR DGGE,可更全面的分析氨氧化细菌的群落结构.
如图4(b)所示,随着DO不断降低,氨氧化菌的群落结构也发生了变化,且在不同DO条件下氨氧化菌群落中的优势菌群不同.将氨氧化细菌的主要条带进行克隆测序,构建其发育树见图6.由图6可知,MBR中存在几种不同种属的氨氧化细菌,除了条带 4,8,10为未鉴定的菌,反应系统中存在的氨氧化细菌主要为 β-变形亚纲中的亚硝化单胞菌属(Nitrosomonas)和亚硝化螺旋菌属(Nitrosospira).并且在不同的DO条件下起主要作用的氨氧化菌属不同,在DO为4.0mg/L条件下主要为Nitrosospira sp.,在 DO为 2.0mg/L和 0.5mg/L时,主要为Nitrosomonas sp.,而在DO为0.2mg/L时其微生物主要为未培养菌属,明显亚硝化菌属的条带减弱.
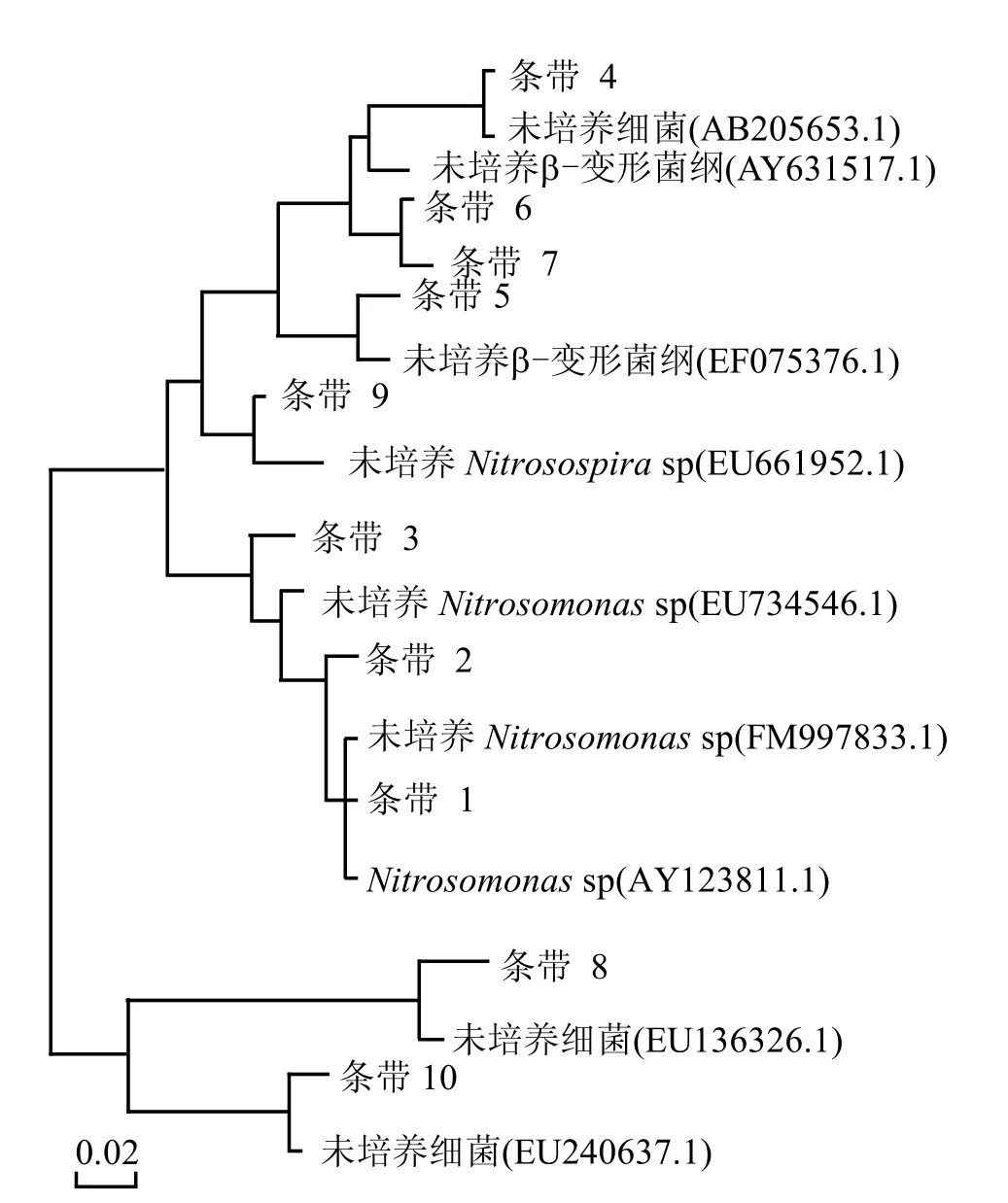
图6 MBR中氨氧化细菌系统发育树Fig.6 Phylogenetic tree of ammonia-oxidizing bacteria
2.3 MBR的微生物群落结构与其处理效果的对应关系
根据总细菌和氨氧化细菌的 DGGE图谱(图4),进行 MBR的微生物群落多样性指数计算和聚类分析.不同条件下的Shannon指数如图7所示.在DO为4.0mg/L和2.0mg/L下,总细菌微生物群落的多样性要略高于DO在0.5和0.2mg/L的两个条件.根据DGGE条带的同源性进行聚类分析[图8(a)],将不同条件下的5个样品分为3个独立的群,DO浓度在 4.0,2.0mg/L时微生物群落结构比较相似,较低DO条件下(0.5,0.2mg/L)微生物群落结构较相似,但与原泥相比较,其微生物群落结构均发生较大变化.这些结果都说明在较高DO的条件下微生物群落的多样性比低DO条件下更加丰富.
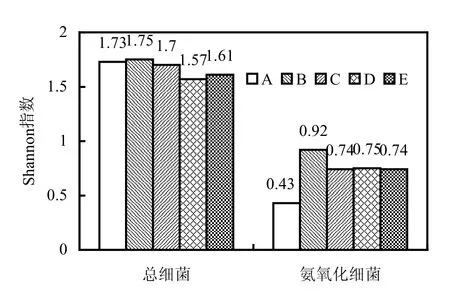
图7 不同条件下MBR中微生物群落Shannon指数Fig.7 Shannon index of microbial population under different DO concentrationA: 原泥 B: 4.0mg/L C: 2.0mg/L D: 0.5mg/L E: 0.2mg/L
在总细菌的群落结构分析中,有部分微生物随DO的降低发生变化,但反应器的COD去除率并未发生明显变化,这表明微生物的群落结构变化与反应器的处理效果对应关系不明显,不同DO下的微生物群落结构变化并未影响系统对有机物的去除.分析其原因可能为大多数微生物属于异养型[24],所以不同DO条件下异养菌均在总细菌群落中占优势地位,DO的变化对COD去除影响较小.
氨氧化菌的多样性分析表明原泥中的氨氧化细菌较少,随着反应器运行,其多样性增加,说明氨氧化细菌适于在 MBR反应系统中生长.另外,在 4.0mg/L DO下氨氧化细菌的群落表现出更丰富的多样性.聚类分析的结果图 8(b)显示DO为2.0,0.5mg/L时氨氧化细菌的群落结构最相似,说明DO在0.5~2.0mg/L变化时对MBR中的氨氧化细菌的菌群分布影响不大,同时反应器在DO为2.0mg/L和0.5mg/L时系统的NH4+-N和总氮脱除率均较高.

图8 DGGE图谱UPGMA聚类分析Fig.8 Cluster analysis of DGGE by UPGMAA:原泥 B: 4.0 mg/L C: 2.0 mg/L D: 0.5mg/L E: 0.2 mg/L
3 结论
3.1 应用A/O-MBR处理实际生活污水,DO浓度在0.2~4.0mg/L变化对COD去除效果影响不大,但是对NH4+-N去除影响较大.当DO下降到0.2mg/L及以下时,NH4+-N平均去除率下降明显;DO浓度在0.5~2.0mg/L时系统对NH4+-N和总氮的脱除效果均较好.
3.2 DGGE及测序结果表明,在4.0,2.0mg/L DO下,微生物群落的多样性要高于0.5,0.2mg/L时的多样性;DO对氨氧化细菌群落变化影响较大,在不同条件下起主要作用的氨氧化菌属不同,但DO在0.5~2.0mg/L变化时MBR中的氨氧化细菌的菌群分布具有较高相似性.
3.3 反应系统中总细菌的微生物群落结构变化与反应器的处理效果对应关系不明显,在不同DO下微生物菌群结构发生的变化对有机物去除影响较小;但对氨氧化细菌的微生物群落结构分析显示,其氨氧化细菌的变化与反应器的NH4+-N去除效果相对应.
[1] Zheng X, Zhu X L, Zhang S Y, et al. Study and application of membrane bioreactor in the water treatment [J]. Techniques and Equipment for Environment Pollution Control, 2000,1(5):12-20.
[2] 张小华,何翠彦,李 璟,等.膜生物反应器处理废水的影响因素[J]. 水处理技术, 2008,34(11):7-13.
[3] Judd S. The status of membrane bioreactor technology [J]. Trends in Biotechnology, 2008,26(2):109-116.
[4] 顾 平,罗 红,杨造燕,等.中空膜生物床处理生活污水的中试研究 [J]. 中国给水排水, 2000,16(3):5-8.
[5] Gander M. Aerobic MBRs for domestic wastewater treatment: a review with cost considerations [J]. Separation and purification Technology, 2000,20(18):119-130.
[6] 刘志华,陈建中.溶解氧对膜生物反应器硝化反硝化的影响 [J].水处理技术, 2007,33(2):21-23.
[7] Yun M A, Yeon K M, Park J S, et al. Characterization of biofilm structure and its effect on membrane permeability in MBR for dye wastewater treatment [J]. Water Research, 2006,40(1):45-52.
[8] Kim H Y, Yeon K M, Lee C H, et al. Biofilm Structure and Extracellular Polymeric Substances in Low and High Dissolved Oxygen Membrane Bioreactors [J]. Separation Science and Technology, 2006,41(7):1213-1230.
[9] Muyzer G, Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gelelectrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA [J]. Appl. Environ. Microbiol., 1993,59:695-700.
[10] 国家环境保护总局水和废水监测分析方法编委会.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 1989.
[11] Ovreas L, Forney L, Daae F L, et al . Distribution of bacterioplankton inmeromictic lake saelevannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA [J]. Appl. Environ. Microbiol., 1997,63(8):3367-3373.
[12] Kowalchuk G A, Bodelier P L E, Heilig G H J, et al. Community analysis of ammonium-oxidizing bacteria, in relation to oxygen availability in soils and root-oxygenated sediments, using PCR, DGGE and oligonucleotide probe hybridization [J]. FEMS Microbiol. Ecol., 1998,24:339-350.
[13] 辛明秀,赵 颖,周 军,等.反硝化细菌在污水脱氮中的作用[J]. 微生物学通报, 2007,34(4):773-776.
[14] 杨宗政,顾 平,张晓霞.MBR的DO分布及其对污染物去除的影响 [J]. 中国给水排水, 2004,20(8):54-57.
[15] 陈欣燕,程晓如,陈忠正.从微生物学探讨生物除磷脱氮原理 [J].中国给水排水, 1996,12(5):32-33.
[16] 张 斌,孙宝盛,季 民,等.MBR中微生物群落结构的演变与分析 [J]. 环境科学学报, 2008,28(11):2192-2199.
[17] 张 斌,孙宝盛,刘慧娜,等.处理不同废水 MBR 系统中微生物群落结构的比较 [J]. 环境科学, 2008,29(10):5491-5496.
[18] Huang L N, Wever H D, Diels L. Diverse and distinct bacterial communities induced biofilm fouling in membrane bioreactors operated under different conditions [J]. Environ. Sci. Technol., 2008,42(22):8360-8366.
[19] Park H D, Noguera D R. Nitrospira community composition in chemostat reactors operated with two different dissolved oxygen levels [J]. Journal of Microbiology and Biotechnology, 2008, 18(8):1470-1474.
[20] Maestre J P, Rovira R, Gamisans X, et al. Characterization of the bacterial community in a biotrickling filter treating high loads of H(2)S by molecular biology tools [J]. Water Sci. Technol., 2009,59(7):1331-1337.
[21] Osaka T, Ebie Y, Tsuneda S, et al. Identification of the bacterial community involved in methane-dependent denitrification in activated sludge using DNA stable-isotope probing [J]. FEMS Microbiol. Ecol., 2008,64(3):494-506.
[22] Limpiyakorn T, Kurisu F, Yagi O. Development and application of real-time PCR for quantification of specific ammoniaoxidizing bacteria in activated sludge of sewage treatment systems [J]. Applied Microbiology and Biotechnology, 2006, 72(5):1004-1013.
[23] Muyzer G. DGGE/TGGE a method for identifying genes from natural ecosystems [J]. Current Opinionin Microbiology, 1999, 2(3):317-322.
[24] 任南琪,马 放,杨基先,等.污染控制微生物学 [M]. 哈尔滨:哈尔滨工业大学出版社, 2002.
Relationships between microbial community structure and the performance of MBR under different dissolved oxygen.
GAO Da-wen*, LI Xin-xin, AN Rui, FU Yuan, REN Nan-qi
(1.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2010,30(2):209~215
X703.1
A
1000-6923(2010)02-0209-07
2009-06-04
教育部全国优秀博士学位论文专项基金(200544);教育部新世纪优秀人才资助计划项目(NCET-05-0330);国家自然科学基金资助项目(50638020)
* 责任作者, 教授, gaodw@hit.edu.cn
高大文(1967-),男,黑龙江佳木斯市人,教授,博士,主要从事环境微生物技术和水污染控制研究.发表论文70余篇.

