小鼠白细胞介素17A的克隆、表达及活性鉴定①
张 薇 高红梅 叶贤龙 于艺雪 刘铭瑶 王文飞 任桂萍 李德山
(东北农业大学生命科学学院生物制药教研室,哈尔滨150030)
小鼠白细胞介素17A的克隆、表达及活性鉴定①
张 薇 高红梅 叶贤龙 于艺雪 刘铭瑶 王文飞 任桂萍 李德山
(东北农业大学生命科学学院生物制药教研室,哈尔滨150030)
目的:克隆小鼠白细胞介素17A(mIL-17A)基因,构建mIL-17A原核表达质粒在E.coilRosetta(DE3)PlysS表达,得到有活性的mIL-17A蛋白。方法:提取人IL-1β免疫的小鼠胸腺总RNA,反转录成cDNA,以此为模板,根据GenBank报道的mIL-17A序列设计引物,进行巢式PCR,得到成熟mIL-17A的编码序列并构建到pMD18-T载体中,再亚克隆至原核表达载体pHisSUMO Express中,经DNA测序鉴定后转化Rosetta感受态细胞,IPTG诱导表达,Western blot鉴定。纯化后的蛋白处理3T3-L1前体脂肪细胞,real time PCR鉴定白细胞介素6(IL-6)的表达变化。结果:DNA测序证明所克隆基因序列与GenBank报道的完全一致。成功构建了pHisSUMO Express-mIL-17A原核表达质粒以包涵体形式表达了重组mIL-17A蛋白,且Western blot证实为目的蛋白。所得蛋白上调3T3-L1细胞表达IL-6。结论:获得具有生物活性的mIL-17A蛋白,为进一步研究其蛋白特性及其生物活性奠定基础。
小鼠白细胞介素17;克隆;表达;包涵体;活性鉴定
白介素17(Interleukin-17,即IL-17A)又叫细胞毒T淋巴细胞抗原-8,是新发现的一种前炎性细胞因子,主要由CD4+记忆T淋巴细胞、单核细胞等分泌,有强大的招募中性粒细胞的作用[1,2]。IL-17A的编码基因在种属间有较高的同源性,小鼠IL-17A和人IL-17A(hIL-17)分别定位于染色1(A12A4)和2(2q31)。此外,它的氨基酸序列在种属间也有较高的同源性,一般均含有6个半胱氨酸、1个潜在的N端糖基化位点和2个磷酸化位点保守序列(分别是蛋白激酶C和酪氨酸激酶的潜在作用点)。成熟mIL-17A包含134个氨基酸,分泌形式为同源二聚体,在体内还可以以寡聚体形式发挥作用[3]。IL-17A的受体广泛分布在各种细胞表面[4]。
由于IL-17A与其受体结合后可诱导表达多种细胞因子和粘附分子,这些细胞因子在造血、炎症、免疫的不同阶段具有不同的功能,尤其在支气管哮喘、类风湿性关节炎、器官移植和肿瘤中起重要的作用,现已成为国内外研究热点[5]。为了进一步研究IL-17A的蛋白特性及生物活性,本实验成功地克隆、表达并纯化了具有生物活性的mIL-17A蛋白。
1 材料与方法
1.1 材料 重组人IL-1β蛋白(rhIL-1β)(由本实验室表达),E.coliDH5α、E.coliRosetta(DE3)PlysS、3T3-L1前体脂肪细胞(由东北农业大学生命中心基因部保存)。pMD18-T试剂盒(购自TaKaRa公司),原核表达载体pHisSUMO Express(由本实验室改造)[6],白介素-17A抗体(bs-1183R)(购自北京博奥森生物技术有限公司),T4 DNA连接酶限制性内切酶(购自NEB公司),高糖DMEM培养基(购自G ibco公司),新生牛血清(NCS,购自Hyclone公司),引物(由Invitrogen公司合成)。
1.2 方法
1.2.1 目的基因的克隆 根据GenBank报道的mIL-17A序列,利用软件Primer Premier5.0设计引物如下:P1:5′-catgccatggcagcgatcatccctcaaagct-3′(划线部分为NcoⅠ酶切位点);P2:5′-cgggatcc ttaggctgcctggcggacaat-3′(划线部分为BamHⅠ酶切位点);P3:5′-tccagggagagcttcatctgtgtct-3′;P4:5′-tcagccgcgggtctctgttta-3′。取1.5 ml、0.02 mg/ml的rhIL-1β用等体积弗氏完全佐剂乳化后免疫3只小鼠,同样方法于两周后进行第二次免疫、三周后进行第三次免疫,将完成免疫的小鼠断颈处死,取胸腺,研磨后收集细胞沉淀。提取总RNA,以Oligo(dT)18为引物反转录成cDNA。以此cDNA为模板,P3、P4为引物进行第一次PCR,退火温度为55℃,20个循环。再以第一次PCR产物为模板,P1、P2为引物进行第二次PCR,退火温度为60℃,20个循环。1%琼脂糖凝胶电泳检测结果。
1.2.2 表达质粒pHisSUMO Express-mIL-17A的构建 将上述PCR产物纯化后与pMD18-T载体于16℃连接过夜,然后转化E.coliDH5α。PCR鉴定pMD18-T-mIL-17A克隆,扩增并提取质粒后,将其与pHisSUMO Express载体分别用NcoⅠ和BamHⅠ双酶切,酶切产物进行连接,转化E.coliDH5α。取经SacⅠ酶切鉴定和测序证实的阳性重组质粒扩增并转化Rosetta感受态细胞。PCR鉴定pHisSUMO Express-mIL-17A克隆。
1.2.3 重组mIL-17A的诱导与表达 将鉴定为阳性的重组工程菌接种于20 ml含100μg/ml Amp+的LB培养基中,37℃,150 r/min培养过夜。次日将活化了一次的菌液1%接种于500 ml含100μg/ml Amp+的LB培养基中,37℃,150 r/min培养至OD600≈0.3时,加入IPTG至终浓度为0.25 mmol/L,诱导表达3小时,4 000 r/min离心30分钟收集菌体。超声破碎后,4 000 r/min离心30分钟,分别收集上清和沉淀进行SDS-PAGE,分析表达情况。
1.2.4 重组mIL-17A的纯化与鉴定 将诱导表达的菌体破碎后弃上清,用含有2 mol/L尿素的PBS洗涤包涵体两次,然后用8 mol/L尿素4℃变性过夜,经HiLoad 16/60 Superdex 75 pg(GE)柱上梯度复性,然后通过Hiprep 26/10 desalting(GE)脱盐。将所得样品进行SDS-PAGE分析和Western blot鉴定。
1.2.5 3T3-L1前体脂肪细胞的培养 复苏3T3-L1细胞,在37℃、5%CO2及饱和湿度的条件下,用含有10%新生牛血清NCS的高糖DMEM培养基进行培养。取生长状态良好的3T3-L1细胞以1×106细胞/孔的密度接种于六孔板上,当细胞达到80%~90%汇合时,饥饿处理12小时,检测重组mIL-17A蛋白活性。
1.2.6 重组mIL-17A的活性鉴定 纯化后的蛋白除菌后用培养液稀释至终浓度为1.5、150、1 500 ng/ml。取2 ml上述稀释液分别处理六孔板中的3T3-L1前体脂肪细胞,以未经蛋白处理的细胞作为空白对照,以经60℃水浴灭活的蛋白(用培养液稀释至终浓度为1 500 ng/ml)处理的细胞作为阴性对照,每个浓度至少设3个重复孔。24小时后收集细胞,Trizol法提取RNA并反转录成cDNA,用real time PCR检测mIL-6的表达量并做统计学分析。
2 结果
2.1 目的基因的扩增 采用RT-PCR技术克隆得到成熟的mIL-17A基因片段,经1%琼脂糖凝胶电泳检测其大小在400 bp左右(见图1),与预计片段相符(402 bp),初步判定得到目的基因片段。
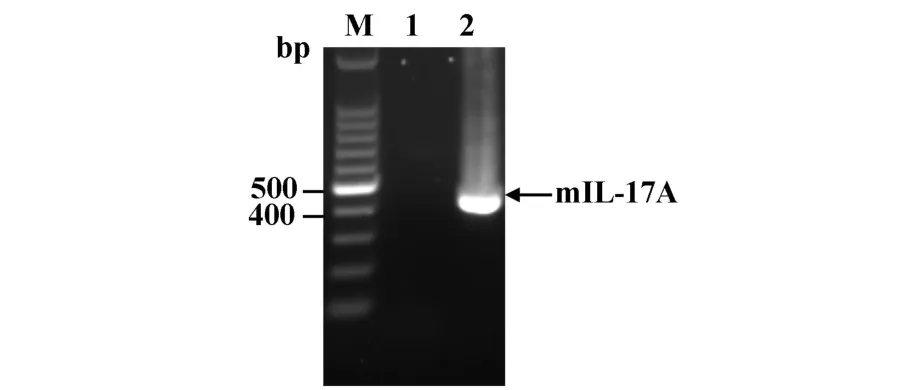
图1 PCR扩增mIL-17A基因Fig.1 Amplification of mIL-17A by PCRfrom mouse thymus stimulated by the human IL-1β
2.2 表达质粒pHisSUMO Express-mIL-17A的构建pHisSUMO Express-mIL-17A经酶切鉴定,结果如图2,300 bp处即为目的基因与pHisSUMO Express载体连接后转化E.coliDH5α的阳性克隆。挑取经测序证实的质粒转化的Rosetta感受态细胞的单菌落经PCR鉴定,1%琼脂糖凝胶电泳显示有含有目的基因(见图3),即为阳性的重组工程菌。
2.3 重组mIL-17A的诱导与表达 重组工程菌经IPTG诱导表达、破碎后进行SDS-PAGE电泳鉴定,显示破碎后的沉淀在14~18.5 kD间有目的带(见图4),与成熟mIL-17A分子量的理论值(15.5 kD)相符,即目的蛋白以包涵体形式表达。
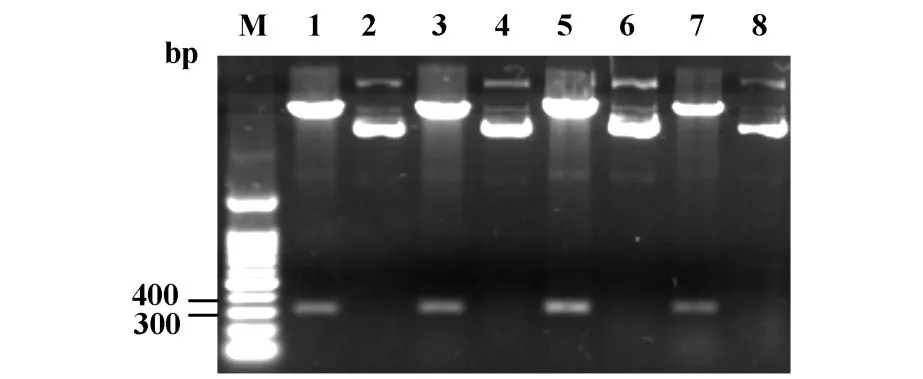
图2 酶切鉴定DH5α/mIL-17A克隆Fig.2 The confirmation of the DH5α/mIL-17A clone by RE enzyme digestion
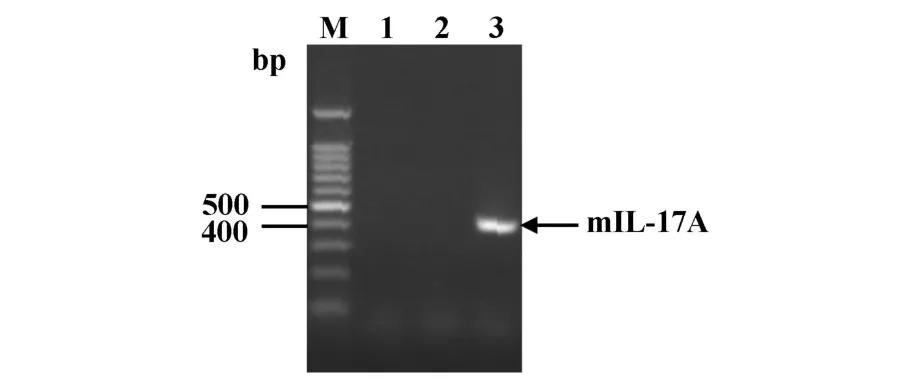
图3 PCR鉴定Rosetta/mIL-17A克隆Fig.3 The confirmation of Rosetta/mIL-17A clone by PCR
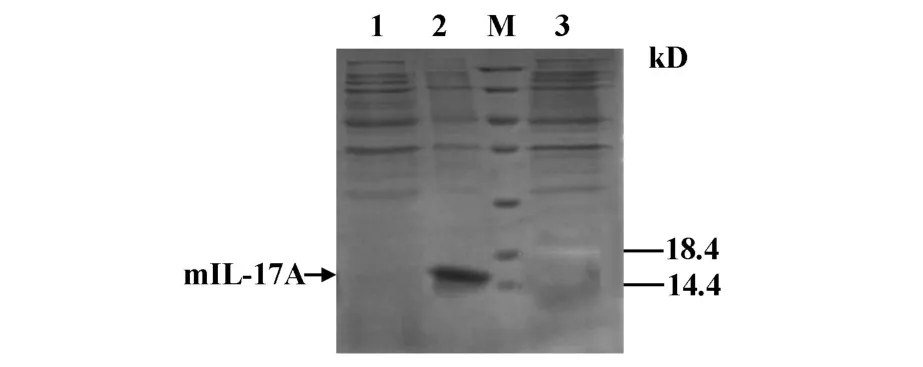
图4 表达mIL-17A的SDS-PAGE分析Fig.4 SDS-PAGEanalysis of expression of mIL-17A
2.4 重组mIL-17A的Western blot鉴定 将纯化后的蛋白样品(见图5)与阴性对照BSA进行Western blot鉴定(见图6)。经显影后在胶片上可见泳道2有唯一的条带,而纯化后的蛋白与商品化的IL-17A抗体有特异性反应,证实了所表达的蛋白是目的蛋白且纯化效果良好。
2.5 重组mIL-17A的活性鉴定 3T3-L1前体脂肪细胞是一种鼠源的成纤维细胞,经mIL-17A蛋白处理后可以上调其IL-6的表达量。所以本实验利用real time PCR方法检测经重组mIL-17A蛋白处理后3T3-L1细胞的IL-6表达水平,结果显示处理组较空白组IL-6表达水平差异显著且成浓度剂量依赖,而阴性对照组与空白对照组IL-6表达水平差异不显著(P=0.14,见图7),即重组mIL-17A蛋白具有生物学活性。
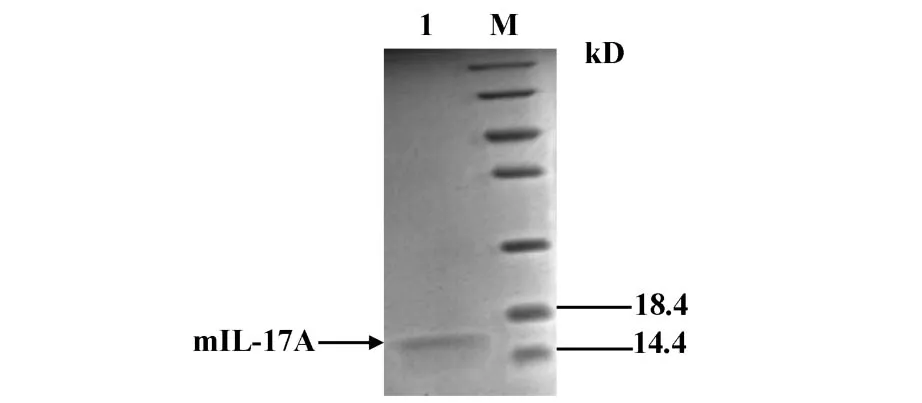
图5 纯化后的mIL-17AFig.5 The purified mIL-17A

图6 mIL-17A纯化后的Western blot鉴定Fig.6 Western blot confirmation of the purified mIL-17A
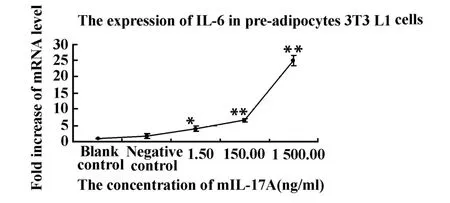
图7 mIL-17A刺激3T3-L1前脂肪细胞后real time PCR方法检测IL-6的mRNA水平Fig.7 Real time PCR detection of the mRNA level of IL-6 in pre-adipocytes 3T3-L1 cells stimulated by mIL-17A
3 讨论
研究表明,IL-17A及IL-17AR的抗体可以有效降低类风湿关节炎的炎症反应,阻滞炎症进展[7-9]。此外,在卵清蛋白(OVA)致敏小鼠激发前使用IL-17A单克隆抗体可以明显减少中性粒细胞的浸润,即拮抗IL-17A的作用有望改善慢性重度哮喘的气道重建[10]。由于IL-17A在诸多炎症疾病中均上调表达,因此人们希望通过阻断其作用以达到治疗的目的。对IL-17A生物活性的研究将为治疗药物的筛选提供理论基础,并起指导作用。
由于mIL-17A mRNA的表达部位与hIL-17A mRNA的表达部位有所不同:应用Northern杂交未能在CD4+和CD8+胸腺细胞中检测到IL-17 mRNA,用常规克隆hIL-17A的方法(通过PMA或LPS刺激T细胞制备PCR模板)克隆mIL-17A基因比较困难[3]。
在制备模板cDNA时,我们选取了三种方法:一是提取经人IL-1β免疫的小鼠的胸腺RNA后反转录成cDNA作为PCR模板;二是分离小鼠胸腺细胞,用LPS刺激24小时后提取RNA并反转录成cDNA作为PCR模板;三是分离小鼠脾脏细胞,用LPS刺激24小时后提取RNA并反转录成cDNA作为PCR模板。以相同条件进行PCR,结果(未给出)显示第一种方法较另外两种更容易得到mIL-17A基因,为其基因的获得提供了一种更为有效的方法。
在构建原核表达质粒时我们考虑到两个方面:一是目的蛋白的高效、可溶性表达;二是尽量减少表达后的纯化步骤。pHisSUMO Express载体经Nco I和BamH I酶切后将除去SUMO标签,目的蛋白将以高表达量的包涵体形式表达;而pHisSUMO Express载体经BsaⅠ和BamHⅠ酶切,目的蛋白将与SUMO标签以融合蛋白的形式表达,用SUMO蛋白酶消化后可得成熟的目的蛋白。因此构建了无标签和有标签(结果未给出)两种原核表达质粒。后续实验发现,mIL-17A蛋白可以和镍柱结合,可溶的SUMO-mIL-17A融合蛋白经SUMO酶消化后的纯化工作难度加大,而以包涵体形式表达就可以避免这个问题。经过探索,我们用HiLoad 16/60 Superdex 75 pg(GE)进行柱上复性,解决了包涵体复性困难的问题,并简化了纯化步骤,只需包涵体的洗涤、变性、复性及脱盐四步便可得到大量、纯度较高的、具有生物活性的目的蛋白。
由于本实验是用E.coilRosetta(DE3)PlysS表达mIL-17A的,所以得到的蛋白中可能会有少量的内毒素污染。据报道,60℃水浴不会对内毒素产生影响,但会使mIL-17A蛋白失活。由于内毒素等很多因素均可能刺激细胞产生炎性细胞因子,在测定其活性时,我们将重组mIL-17A蛋白经60℃水浴灭活后作为阴性对照,不仅排除了内毒素对活性实验的影响,同时排除了除重组mIL-17A蛋白外其他因素对活性实验的影响,较使用内毒素刺激细胞作为阴性对照更为严谨。
本实验摸索出了一套简单、快速、高效制备mIL-17A的方法,成功制备了有生物活性的mIL-17A,为后续研究IL-17A的特性及其生物活性奠定基础。
1 Yao Z,Painter S L,Fanslow W Cet al.Human IL-17:a novel cytokine derived from T cells[J].Immunol,1995;155(12):5483-5486.
2 Katz Y,Nadiv O,Rapoport MJet al.IL-17 regulates gene expression and protein synthesis of the complement system,C3 and factor B,in skin fibroblasts[J].Clin Exp Immunol,2000;120(1):22-29.
3 张志刚.IL-17的生物学特性及临床意义[J].国外医学·生理、病理科学与临床分册,2003;23(6):639-644.
4 Yao Z,Fanslow W C,Seldin M Fet al.Herpesvirus Saimiri encodes a new cytokine,IL-17,which binds to a novel cytokine receptor[J].Immunity,1995;3(6):811-821.
5 张景熙.IL-17与疾病相关的研究进展[J].国外医学·免疫学分册,2004;27(1):52-55.
6 姜媛媛,刘铭瑶,任桂萍et al.高效可溶性重组蛋白表达载体的构建[J].生物工程学报,2010;26(1):121-129.
7 Lubberts E,Joosten L A,Oppers Bet al.IL-1-independent role of IL-17 in synovial inflammation and joint destruction during collagen-induced arthritis[J].Immunol,2001;167(2):1004-1013.
8 Lubberts E,K oenders M I,Oppers-Walgreen Bet al.Treatment with a neutralizing anti-murine interleukin-17 antibody after the onset of collagen-induced arthritis reduces joint inflammation,cartilage destruction,and bone erosion[J].Arthritis Rheum,2004;50(2):650-659.
9 王 峰,黄安斌.IL-17在类风湿性关节炎中的作用[J].国际骨科学杂志,2006;27(5):301-303.
10 Hellings P W,Kasran A,Liu Zet al.Interleukin-17 orchestrates the granulocyte influx into airways after allergen inhalation in a mouse model of allergic asthma[J].AmJ Respir Cell Mol Biol,2003;28(1):42-50.
[收稿2009-12-12 修回2010-04-06]
(编辑 许四平)
Cloning,expression and activity detection of mIL-17A
ZHANG Wei,G AO Hong-Mei,YE Xian-Long,YU Yi-Xue,LIU Ming-Yao,WANG Wen-Fei,REN Gui-Ping,LI De-Shan.
College of Life Science,Northeast Agriculture University,Harbin150030,China
Objective:To clone mouse interleukin-17A(mIL-17A),construct mIL-17A prokaryotic expression plasmid and express bioactive mIL-17A protein inE.coil Rosetta(DE3)PlysS.Methods:The total RNA of the mouse thymus stimulated by human IL-1βwas abstracted,and then the RNA was reverse-transcripted into cDNA that was used as the template for PCR reaction.The primers were designed according to the published mIL-17A sequence.The cDNA coding for mature mIL-17A was cloned by nested PCR.The mIL-17A cDNA was subcloned to the prokaryotic expression vector pHisSUMO Express and confirmed by DNA sequencing.The pHisSUMO Express-mIL-17A was transformed into the ROSETTA competence cells.The recombinant bacteria were induced by IPTGfor protein expression,and the Western blot was used to confirm the protein.The purified protein was used to stimulate the pre-adipocyte 3T3-L1 cells.Expression of IL-6 was detected by real time PCR.Results:The mIL-17A was clonedfrom the mouse thymus stimulated by human IL-1β.The recombinant mIL-17A was expressedfrom prokaryotic system and purified as an inclusion body.The mIL-17A was confirmed by Western blot using conmmerially available antibody against mIL-17A.The purified mIL-17A upregulated the expression of IL-6 in pre-adipocytes 3T3-L1 cells.Conclusion:The mouse IL-17A is cloned from thymus and bioactive mIL-17A is purified for further study of the cytokine.
mIL-17;Cloning;Expression;Inclusion;Activity detection
Q78
A
1000-484X(2010)09-0783-04
10.3969/j.issn.1000-484X.2010.09.004
①本文为哈尔滨市科技创新人才研究专项资金(2006RFXXS002)、东北农业大学创新团队项目(CXZ001)
张 薇(1986年-),女,在读硕士,E-mail:zhangwei-baomashan@163.com;
及指导教师:李德山(1950年-),男,龙江学者,东北农业大学特聘教授,主要从事治疗Ⅱ型糖尿病新药物的研究、治疗类风湿性关节炎基因工程抗体的研究、发现人resistin受体的研究,E-mail:deshanli@163.com。

