55例子宫内膜癌伴子宫下段受累的临床评价
江静颖,张 晔
(南京医科大学附属无锡市妇幼保健院肿瘤科,江苏无锡,214002)
子宫内膜癌是妇科常见恶性肿瘤之一,病变多位于子宫体底部和宫角附近[1],偶尔也发生在子宫下段,原发于这一部位的肿瘤称作子宫峡部子宫内膜腺癌(UIE)[2]。而子宫内膜癌伴子宫下段累及(LUSI)包括了原发于宫体宫底部的子宫内膜癌弥漫扩散至子宫下段或其他方式侵犯子宫下段者。关于LUSI的相关研究目前国内鲜有报道,本文对LUSI的临床病理特征及其与子宫内膜癌预后的相关性进行了研究。
1 资料与方法
1.1 一般资料
回顾分析了2000年12月~2006年12月期间在本院肿瘤科初治治疗为手术治疗、经病理检查证实为子宫内膜癌的患者207例。有以下因素之一者不列入研究对象中:①术前行放射治疗者;②未在本院行手术治疗者或术后随访的患者;③术后常规病理切片报告未描述子宫下段情况者;④若颈管有大的弥漫性病灶,不能除外宫颈癌侵犯子宫下段者。研究对象按有无LUSI分为2组:一组为LUSI组(有 LUSI),共 55例;另一组为对照组(无LUSI),共152例。患者的临床分期采用1988年的FIGO手术病理分期,肿瘤组织分级采用WHO的分级标准[3]。治疗方案依据以下原则:对术前诊断为临床Ⅰ期的患者行筋膜外全子宫切除术及双侧附件切除术,对具有高危因素如病理细胞分级为G3,发现肌层浸润深度>1/2,肿瘤大小范围超过宫腔的50%,附件转移、腹水细胞学阳性、宫颈受侵或为特殊类型的子宫内膜癌如浆液性乳头状癌等,则行盆腔或腹主动旁淋巴结取样或切除术;术前诊断为临床Ⅱ期者行广泛性全子宫切除术+双侧附件切除术+盆腔淋巴结取样或切除术;术前诊断为临床Ⅲ、Ⅳ期者行肿瘤细胞减灭术。对过度肥胖、高龄、有严重内科合并症不能耐受过大手术的患者适当缩小子宫切除的范围(行筋膜外全子宫切除术+双侧附件切除术),和/或改盆腔淋巴结清扫术为活检或探查,术后有高危因素的患者(如肌层浸润>1/2、宫颈受累、淋巴结转移、腹腔细胞学阳性、子宫外转移等)接受辅助放化疗。详细记录各病例的年龄、手术病理分期、组织病理类型、组织学分级、有无LUSI、脉管受累及治疗后患者的生存情况。
2 结 果
2.1 2组临床资料的情况
LUSI组(有LUSI)占全部病例的26.57%(55/207),55岁以下26例,55岁以上 29例,平均年龄(56.02土 9.42)岁;对照组(无 LUSI)152例,占全部病例的74.88%(152/207),55岁以下65例,55岁以上87例,平均年龄(56.43±9.83)岁,2组无显著性差别。随访时间5~108个月,中位随访时间59个月。失访11例,其中 LUSI组4例,对照组7例,失访率5.3%,样本代表性好。
2.2 2组临床病理特征的比较
LUSI组手术病理分期Ⅰ期的患者占61.8%,对照组手术病理分期Ⅰ期的患者占84.2%,2组差异有显著性(P<0.05)。LUSI组中中低组织学分级、肌层浸润、宫颈受累、脉管浸润及盆/腹腔淋巴结转移的发生率均高于对照组,2组差异有显著性(P<0.05)。LUSI组中高风险组织病理类型如浆液性乳头状癌、透明细胞癌及腺癌伴鳞化等非内膜样腺癌的发生率高于对照组,分别达7.3%,10.9%,12.7%,各个组织病理亚型与对照组相比无显著性差别,并且LUSI组非子宫内膜样腺癌的高风险组织亚型占全部病例的30.9%(17/55),对照组非子宫内膜样腺癌的高风险组织亚型占全部病例的19.1%(29/152),2者比较亦无显著性差别。2组浆膜受累、腹腔细胞学阳性的发生率、附件受累情况无显著性差别,见表1。

表1 2组患者的临床病理特征的比较
2.2 2组生存率及预后因素的比较
LUSI组随访时间5~104个月,中位随访时间58个月,对照组随访时间5~108个月,中位随访时间59个月,2组随访时间相比无显著性差别。LUSI组5年生存率低于对照组(P<0.01)。本研究单因素回归分析显示年龄、病理类型、手术病理分期、组织低分化、深肌层浸润、脉管浸润、宫颈受累、腹腔细胞学阳性、附件受累、浆膜受累、淋巴结转移、有无LUSI等均可作为子宫内膜癌的不良预后因素。再将这些因素以Cox比例风险回归模型进行多因素分析,仅有组织分级、病理类型、脉管浸润以及手术病理分期为独立的预后相关因素,LUSI不是独立的预后相关因素,见表2。
3 讨 论
子宫下段在子宫解剖学及组织学上是一个可以辨认的特殊部位,是子宫体与子宫颈之间的过渡区域。O.Lavie等从组织学角度定义子宫下段上端既有子宫内膜间质,又有子宫内膜腺体[4],而子宫下段的宫颈端为没有粘蛋白、没有循环的上皮组织,缺乏宫颈间质的纤维成分。LUSI并不是子宫内膜癌FIGO手术病理分期的1项分期标准,而宫颈侵犯被划分为子宫内膜癌FIGO手术病理分期Ⅱ期,由此可以想到邻近宫颈的子宫下段的癌肿累及也有可能对子宫内膜癌的预后产生一定的影响。各个研究报道的LUSI的发生率为5%~58%。O.Lavie等[4]及O.Gemer等[7]报道的研究对象均为子宫内膜癌手术病理Ⅰ期患者,相对预后较好,LUSI在Ⅰ期子宫内膜癌中的发生率分别为24%及17.9%。而本研究中包含所有手术病理分期患者,LUSI的发生率较之偏高为26.57%。
目前比较公认的影响子宫内膜癌预后的因素有年龄、手术病理分期、病理类型、组织分级、肌层受侵深度、宫颈受累、子宫外病灶(如淋巴结侵犯、附件受累、脉管受累、腹腔细胞学阳性)等。肿瘤在宫腔内累犯的位置是否重要尚不统一,国外对于LUSI对子宫内膜癌预后的影响众说纷纭。Hachisuga等[8]将12例子宫下段的子宫内膜癌与196例子宫体上段的内膜癌相比较,发现子宫下段的子宫内膜癌的中位发病年龄偏低,与组织分级高、细胞分化不良、深肌层浸润有关,但淋巴转移与其没有相关性。虽然研究的例数较少,但已经提示了子宫下段的子宫内膜癌的特殊性。Mayr[6]等在240例患者中将累及子宫下段的子宫内膜癌与侵犯宫颈及局限于宫体的子宫内膜癌相对比,统计其发生率为19%,与侵犯宫颈的子宫内膜癌相近,同时其生物学行为如高风险组织类型、脉管浸润及肌层浸润等介于侵犯宫颈及局限于宫体的子宫内膜癌之间,提出了LUSI有与侵犯宫颈的子宫内膜癌相近的生物学行为。Madom等[9]对299例子宫内膜癌的研究表明LUSI可以预测淋巴结的转移。但 Phelan等[10]对Ⅰ期子宫内膜癌的研究则认为两者在临床病理特征方面无明显不同。
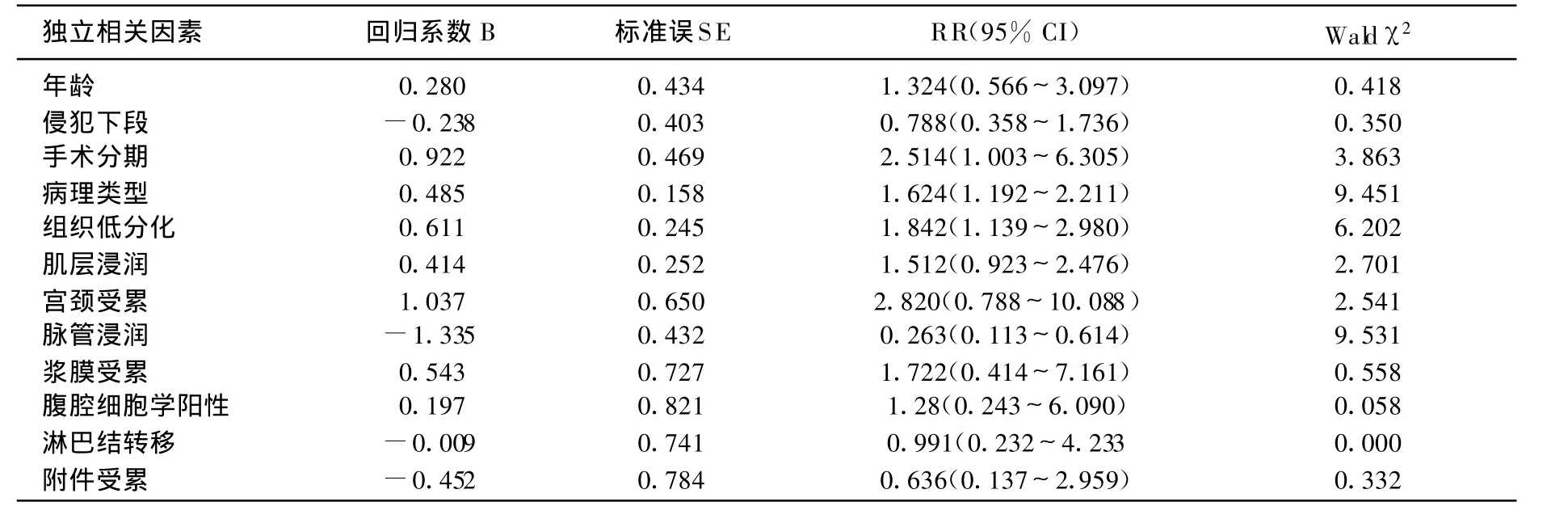
表2 Cox多因素回归分析子宫内膜癌的独立性预后相关因素
作者的研究显示:LUSI组(58.98±9.55岁)与无LUSI的对照组(57.69±10.77岁)发病年龄相似,均以围绝经期妇女多见。LUSI组非子宫内膜样腺癌的高风险组织类型如浆液性乳头状癌、透明细胞癌、鳞腺癌等所占比例增高,分别达12.7%,7.3%,5.5%。同时LUSI组虽然发生浆膜受累、腹腔细胞学阳性及附件受累与无LUSI组无明显差别,但更多出现组织分级低、肌层浸润、宫颈侵犯、脉管浸润以及盆/腹腔淋巴结转移(P<0.05),这也是LUSI组手术病理分期较高的原因。这一结果与 O.Lavie等[4]及 O.Gemer等[7]研究结果相似。所以子宫内膜癌患者若术前出现组织学分级高及高风险组织病理类型时,需警惕LUSI的发生,术中应剖视子宫注意肉眼评估大体标本,同时术中快速冰冻切片病理检查应着重子宫下段部位及相关高危因素的评估,以期对子宫内膜癌患者的手术病理分期做出正确的术中判断,指导手术范围的确定。
本研究中单因素回归分析显示LUSI与子宫内膜癌的预后影响因素一样均是子宫内膜癌的不良预后因素,多因素回归显示仅有病理类型、组织分级、手术病理分期及脉管受累是子宫内膜癌的独立预后因素。但LUSI组病例中肌层浸润、宫颈受累及脉管浸润的发生率增加,这些都增加了子宫内膜癌发生盆腹腔淋巴结转移的风险,LUSI组5年生存率低于无LUSI组。O.Gemer等[7]研究表明LUSI与淋巴结转移相关,Mayr等亦认为LUSI增加了盆腔再发的风险[6]。因此在术后子宫切除标本病理检查中发现LUSI时应作为选择术后辅助放化疗的一个指标。
研究中发现 LUSI患者多为Ⅰ期患者,是否未行腹膜后淋巴结切除术导致LUSI患者潜在的淋巴结转移被忽视,可能这些Ⅰ期患者已经有淋巴结转移,而应该被诊断为Ⅲc期。缺乏术后辅助放化疗有可能影响患者的预后,而使得对子宫内膜癌Ⅰ期患者LUSI的预后评价过高。所以选择随机对照研究,对子宫内膜癌患者常规行腹膜后淋巴结切除术,更有利于评价LUSI是否为影响子宫内膜癌预后的一个独立因素。
[1]Clement P B,Young R H.Endometrioid carcinoma of uterine corpus:a review of its pathology with emphasis on recent advances and problematic aspects[J].Adv Anat Patho1,2002,9(3):145.
[2]Jacques S M,Qurshi F,Ramirez N C,et al.Tumors of the uterine isthmus:clinicopathologic feature。Immunohistochemical characterization of P53 expression and hormone receptor[J].Int J Gynecol Pathol,1997,13:33.
[3]Boronow RC,Moow CP,Creasman WT,et al.Surgical staging in endometrial cancer:clinical-pathologic findings of a prospective study[J].obstet Gynecol,1984,63:825.
[4]O Lavie,L Uriev,M Gdalevich.The outcome of patients with stage I endometrialcancer involving the lower uterine segment[J].Int J Gynecol Cancer,2008,18:1079.
[5]连利娟.林巧稚妇科肿瘤学[M].第4版.北京:人民卫生出版社,2006:452.
[6]Mayr NA,Wen BC,Benda JA,et al.Postoperative radiation therapy in clinical stage I endometrial cancer:corpus,cervical and low uterine segment involvement-patterns of failure[J].Radiology,1995,196:323.
[7]O Gemer,M Gdalevich,M Voldarsky,et al.Lower uterine segment involvement is associated with adverseoutcome in patients with stage I endometroidendometrial cancer:Results of a multicenter study[J].EJSO,2009,35:865.
[8]Hachisuga T,Kaku T,Enjoji M.Carcinoma of the lower uterine segment:clinicopathologic analysis of 12 cases[J].Int J Gynecol Pathol,1989,8(1):26.
[9]L M Madom,A K Brown,F Lui,et al.Lower uterine segment involvement as a predictor for lymph node spread in endometrial carcinoma[J].Gynecologic Oncology,2007,107:75.
[10]Cynthia Phelan,Anthony G Montag,Jacob Rotmensch,et al.Outcome and Management of Pathological Stage I Carcinoma Patients with Involvement of the Lower Uterine Segment[J].Gynecologic Oncology,2001,83:513.

