头低位预置诱导大鼠脑缺血耐受的研究
罗 伟,苏 海,李菊香,肖鲁闽
199 0 年Kita-gawa等[1]用沙土鼠全脑缺血模型,发现沙土鼠预先短暂的缺血可诱导脑缺血耐受,可对抗随后而来的脑组织的致死性缺血性损伤,由此激发了脑缺血耐受的大量研究。但大多数预置方式在技术上操作相对复杂,或副反应较大。因此,需要从新的角度研究,寻找更简单易行的预处理方法。头低位倾斜卧床(head-down tilt bed rest,HDT)是理疗科常用的辅助治疗措施,方法简便,易于操作。其是否可作为一种脑缺血耐受预置方法,目前国内外尚未见相关的报道,这也正是本实验的研究主旨所在。
1 材料与方法
1.1 头低位预置方式的建立 采用尾悬吊大鼠头低位[2],从大鼠尾巴根部起,按纵向走行,将一长约6 cm,与尾部等宽的医用胶布条,粘贴于尾部皮肤表面两侧,并连续缠绕一层1.5 cm宽的纱布条以对纵行胶布加强固定,然后在上面缠绕2圈~3圈0.8 cm宽的医用胶布条,悬吊于笼顶,调整好长度使大鼠后肢在伸直时刚好不能触及笼的底部,从而使大鼠始终保持成头低位(约-30°)。大鼠借前肢在笼内自由活动,自由进食。
1.2 局灶性脑缺血模型的制作[3]健康雄性Sprague-Dawley大鼠 21只,体重280 g~320 g(江西医学院动物中心提供),按随机化原则平均分为H组、D组、C组,以本研究室的成熟技术,将三组大鼠以腔内线栓法制成永久性大脑中动脉梗死模型。大鼠经3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,背位固定,在气管旁右侧分离出颈总动脉、颈外动脉,颈内动脉。在颈总动脉靠近分叉处剪一0.2 mm小切口,将直径为0.205 mm单尼龙线(一端加热使之成光滑球面)插入颈内动脉,到达一定长度(约18 mm~20 mm)后,会感到有阻力。此时说明线的远端已经到达大脑中动脉。清醒后,大鼠出现不同程度的左侧肢体瘫痪症状,以前肢体为甚,表明模型制备成功。其中H组在造模前连续头低位预置7 d,D组在造模前用复方丹参滴丸3丸溶于2 mL葡萄糖溶液中灌胃,每天1次,也连续7d,C组不进行预处理。
1.3 观察指标
1.3.1 神经功能缺损体征评分 参考Bederson等[4,5]的方法在术后 4 h、8 h、24 h进行5分制评分。评分标准:0分,无神经功能缺陷;1分,不能完全伸展病灶对侧前爪;2分,向病灶对侧转圈;3分,向病灶对侧倾倒;4分,不能自发行走,伴有意识障碍。
1.3.2 四氮唑(T TC)染色及脑梗死灶测量 缺血24 h后立即断头,剪开颅骨,取出大脑,将整个大脑在冠状面均匀切成1.5 cm厚的脑片,共6片,行TTC染色。红色为正常脑组织,白色为梗死区。用数码相机微距摄片,输入电脑,用图像处理软件(photoshop7.0.1)计算梗死体积。为了抵消个体差异,计算每只大鼠梗死体积占整个大脑体积的百分比[6]。
1.3.3 组织学观察 大鼠脑冠状切片拍片后,对第2张和倒数第2张脑片石蜡包埋,HE染色,光镜观察。
1.3.4 缺血区损伤神经元的半定量分析 这两张脑片对应于《大鼠脑立体定向图谱》中大鼠前囟前 1.2 mm、前囟后3.4 mm两个冠状切面,分别对海马CA1区和顶叶皮层2个脑区进行缺血性损伤的组织学半定量分析。每个脑区任取5个视野,神经元损害程度为损伤神经元占整个脑区的比率,分4级:0级,无神经元损伤;1级,神经元损伤不到10%;2级,神经元损伤10%~50%;3级,神经元损伤超过50%。
2 结 果
2.1 术后4 h、8 h、24 h神经功能评分 MCAO 后,大鼠均表现出不同程度的对侧(左边)肢体瘫痪症状,尤以左前肢为重,大多表现为提起尾部后左前肢不能外展,呈屈曲内收。参考Bederson和Menzise的评分方法,多数大鼠MCAO后为1级。详见表1。
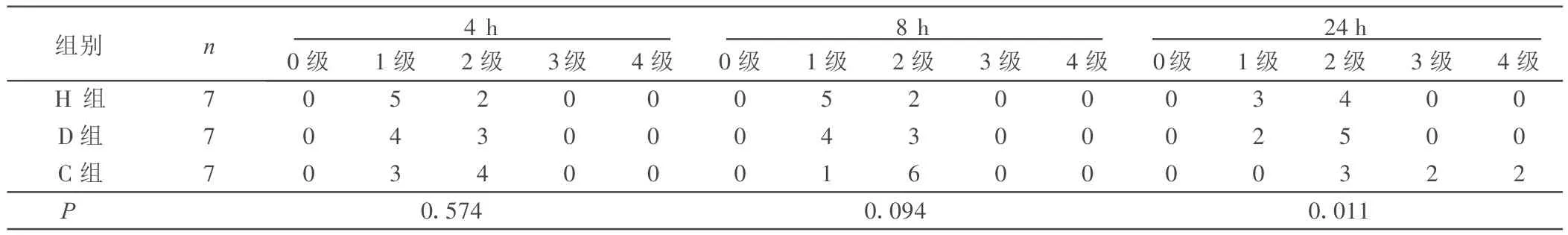
表1 术后4 h、8 h、24 h神经功能评分 只
2.2 脑梗死灶测量结果 实验大鼠MCAO 24 h后,脑组织大体标本可见缺血侧大脑中动脉供血区出现相对于对侧苍白的梗死区,缺血侧M CA及其分支扩张淤血,缺血侧半球较对侧肿大。经TTC染色,梗死灶为白色,正常脑组织为红色,两者界限清晰可辨。各脑片出现大小相对不等的梗死灶,梗死范围多以第3层、第4层脑片为明显。详见表2。
表2 各组脑梗死范围的比较(±s)

表2 各组脑梗死范围的比较(±s)
组别 鼠数只梗死体积mm3大脑体积mm3梗死体积/大脑体积%H组 7 169.39±37.001) 1 300.06±236.07 13.03±1.961)D组 7 185.66±33.641) 1 227.30±145.75 15.13±2.171)C组 7 294.94±63.39 1 148.83±226.73 25.72±2.86与C组比较,1)P<0.05
2.3 坏死细胞观察 HE染色:细胞呈固缩、嗜伊红性改变的为红色神经元,完全失去细胞核结构者为鬼影细胞,两者皆为坏死细胞特征。光镜下病灶中心呈筛网状,病灶周边可见较多的红色神经元核鬼影细胞,同时可见固缩、水肿大的神经细胞及炎性细胞浸润,微血管内可见血栓形成。
2.4 缺血区神经元损伤程度的半定量分析 本实验还观测了大鼠2个不同区域的神经元损伤情况,来评估头低位的脑保护作用。H组和D组中,海马CA1区、顶叶皮层的神经元损伤程度均有明显减轻。详见表3。
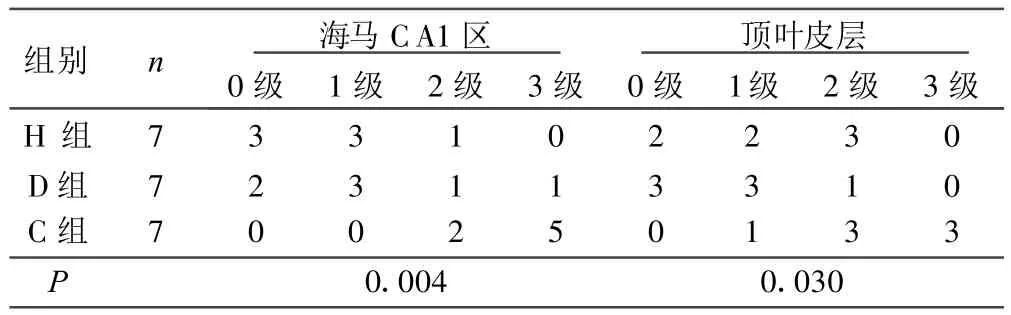
表3 缺血区神经元损伤程度的半定量分析 只
3 讨 论
脑缺血损伤常可致不同程度的神经功能障碍,严重影响病人的生存质量,甚至危及生命。长期以来,人们一直努力寻找安全有效的药物及措施以减轻脑缺血损伤。早在1986年Murry等[7]就在犬心肌缺血模型中发现了缺血预处理和缺血耐受现象。1990年Kitagawa等[1]证实该现象同样存在于大脑,随后更多的实验证实了缺血耐受现象的器官普遍性。随着研究的深入,脑缺血预处理的概念逐渐拓展,预处理的方法不再仅限于脑缺血,而是涵盖了许多“亚毒性”的侵害性物质或措施。有关预处理机制的研究也成为当前的热点之一。
头低位倾斜卧床是一种被广泛采用的地面模拟太空失重的研究方法。目前开始在临床(理疗科)用作为一种防治脑部疾病等的治疗手段,但其作用机制却不是很清楚。有研究表明头低位时流体静水压消失,约有2 000 mL血液由下肢转移到上身,其中20%左右分布到头部,引起脑循环的改变。Kawai等[8]比较了8名被试者坐位、平卧位和头低位-6°时脑中动脉的血流速度。与坐位相比,平卧位和头低位时脑血流速度分别增加111%和114%,而与平卧位相比,头低位时无明显变化。头低位时脑灌注压和颅内压的增高及整个血循环状态的改变对脑循环产生一定影响。猴-6°头低位7 d和19 d后,脑质量增加13%,脑中动脉、小动脉、静脉、毛细血管和软脑膜持久性充血,管壁通透性异常,血管周围水肿,有少量血细胞渗出[9];兔-20°头低位第3天出现毛细血管紧密连接受损,内皮细胞壁出现皱褶、失去完整性和光滑性,内皮细胞内饮泡增加,周细胞内溶酶体增多及毛细血管萎缩[10]。在显微切片中可见红细胞游出血管壁外。本实验采用尾悬吊大鼠头低位的预置方法,研究对永久性脑缺血的影响。在悬吊期间可见大鼠头、面部及颈部肿胀,部分大鼠眼结膜严重充血,表明体液向上身转移明显。
本研究首次应用改进的线栓法MCAO模型研究了大鼠头低位预置7 d对永久性脑梗死的影响,结果显示头低位组和药物组均产生明显的脑保护作用。单从神经功能损害评分的结果来看,术后8 h开始,头低位组和药物组均可以明显改善大鼠神经功能的恢复,但是术后4 h则没有明显改善,可能有以下几个原因:①麻醉药物的作用还没有完全消失,造成观察大鼠神经功能时产生假象;②术后脑组织正处于较严重的缺血损伤状态,头低位的脑保护作用不足以有效地纠正这种情况;③头低位的脑保护作用不是在短期内立刻发挥作用的,而是相对缓慢,但是持续地发挥脑保护作用。
本研究认为,头低位预置对随后永久性脑缺血产生了保护作用,表现在神经功能损害减轻和梗死范围减少,梗死周边神经元损害程度减轻等多方面。通过相关分析研究发现,术后神经功能、脑梗死体积和神经元损伤程度之间具有明显相关性,也即:神经元损伤程度越小,脑梗死体积越小,术后神经功能的改善也就越好,但其机制有待进一步研究。
[1]Kitagawa K,Matsumoto M,Tagaya M,et al.Ischemic tolerance phenomenon found in the brain[J].Brain Res,1990,528(1):21-24.
[2]陈杰,马进,丁兆平,等.一种模拟长期失重影响的大鼠尾部悬吊模型[J].空间科学学报,1993,13(2):159-162.
[3]沈顺姬,陈嘉峰.大鼠局灶性脑缺血模型的建立[J].中风与神经疾病杂志,2002,19(4):246-247.
[4]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion evaluation of the middle and development of a meurologic evaluation[J].Stroke,1986,17:472.
[5]Menzies SA,Hoff JL,Betz AL.Middle cerebral artery occlusion in rats:A neurological and pathological evalution of a reproducible model[J].Neurosurgery,1992,31:100-107.
[6]Joshua B,Lawrance,Sabelle M,et al.Evaluation of 2,3,5-triphenyltetrazolium chloride as a stain for detection and quantification of experimental cerebral infarction in rats[J].Stroke,1986,17:1304-1307.
[7]Murry CE,Jennings RB,Reimer KA.Preconditioning with ischemia:A delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-1136.
[8]Kawai Y,Murthy G,Watenpaugh DE,et al.Cerebral blood flow velocity increase with acute head down tilt of humans[J].The Phy siologist,1992,35(1):186-187.
[9]Savina EA.Antiorthostatic hy pokinesia in monkey(experimental morphological study)[J].The Physiologist,1983,26(6):76.
[10]沈羡云,兰景全,向求鲁.模拟失重时兔脑微循环的变化[J].航天医学与医学工程,1989,2(2):89-93.

