花生壳提取物的三种体外抗氧化方法的综合比较
杨颖,宋曙辉,王文琪,徐桂花
(1.宁夏大学农学院,宁夏银川750001;2.国家蔬菜工程技术研究中心,北京100097)
花生壳提取物的三种体外抗氧化方法的综合比较
杨颖1,2,宋曙辉2,王文琪2,徐桂花1
(1.宁夏大学农学院,宁夏银川750001;2.国家蔬菜工程技术研究中心,北京100097)
采用DPPH、TBA和Xan-XOD 3种体外评价方法评价花生壳提取物的抗氧化活性,结果表明,在这3种抗氧化评价体系中,花生壳提取物均显示了良好的抗氧化性能,DPPH中IC50为7 μg/mL,大豆油中IC50为0.017%,亚麻油中为0.027%,花生油中为1.19%,Xan-XOD中IC50为0.2 mg/mL。
花生壳提取物;木犀草素;DPPH;TBA;Xan-XOD;抗氧化
Abstract:Three different systems including DPPH scavenging method,TBA and Xan-XOD were used to investigate the antioxidant activity of peanut hull extract.The results showed that the extract had high antioxidant activity in these evaluation systems.In DPPH the IC50is the 7 μg/mL,In TBA the IC50is the 0.017%for soybean oil,the 0.027%for linseed oil,the 1.19%for peanut oil,in Xan-XOD the IC50is the 0.2 mg/mL.
Key words:peanut hull extract;Luteolin;DPPH;TBA;Xan-XOD;antioxidant
抗氧化的评价方法有体内和体外两种方法,体内评价多采用动物,如大鼠和小鼠进行体内抗氧化酶类的评价,抗氧化酶一般是取超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等,以及尿酸、谷胱甘肽、VC、类胡萝卜素、生育酚和辅酶Q10等。体外抗氧化能力的测定方法主要有ABTS法、DPPH法、FRAP法、ORAC法、PCL法等;目前常用来测定抗氧化活性方法的原理主要基于两类[1]:一是对人工合成自由基的清除(如·OH、超氧阴离子自由基、二苯代苦味酞基自由基等);二是在特定环境下,对测试体系中脂类物质氧化抑制能力的测定(如:硫氰酸铁法FTC法、硫代巴比妥酸反应物TBARs法)。
花生壳中含有较高的木犀草素。木犀草素作为一种天然黄酮化合物具有抗氧化功能,本研究主要是运用清除DPPH·、·OH及抑制脂质过氧化等3种抗氧化评价方法对花生壳提取物的抗氧化能力进行评价,使花生壳资源能够得到更好的开发利用。
1 材料与方法
1.1 设备
离心机:飞鸽牌TDL-40B;分析天平:岛津LM-20,百万分之一;UV-2550紫外分光光度计:日本岛津。
1.2 试剂
木犀草素标准品、二苯代苦味肼基(DPPH)、黄嘌呤(Xanthine)、羟胺(HONH2)、黄嘌呤氧化酶(Xanthine oxidase,XOD)、对氨基苯磺酸(sulfanilic acid)、萘乙二胺(NED)均购自 Sigma;芦丁、槲皮素、抗坏血酸、2.6-二叔丁基对甲酚(BHT)、三氯乙酸(TCA)、硫代巴比妥酸(TBA)、三氯甲烷、磷酸盐缓冲液(PBS:磷酸二氢钠(NaH2PO4·2H2O)、磷酸氢二钠(Na2HPO4·12H2O)、盐酸、无水乙醇、甲醇均为分析纯。
1.3 花生壳提取液的制备
取烘干粉碎的花生壳粉,70%乙醇提取,提取液离心,取上清液备用,其浓度均为溶液中的木犀草素的浓度。
1.4 方法
1.4.1 清除DPPH·的能力测定
1.4.1.1 测定原理
DPPH·在有机溶剂中是一种稳定的以氮为中心的自由基,其结构中含有3个苯环,1个氮原子上有一个孤对电子,呈现紫色。若受试物能清除它,则表示受试物具有清除自由基的作用,是一种筛选自由基清除剂的简便方法,国内外将其广泛用于清除自由基的研究[2]。该方法的原理是[3]:DPPH·在517 nm波长处有最强吸收呈深紫色,当DPPH·溶液中加入自由基清除剂时,由于与其单电子配对而使溶液颜色变浅,吸收逐渐消失,其退色程度与其所接受的电子数成线性关系,因而可用分光法进行测量,从而评价试验样品的抗氧化能力。
1.4.1.2 测定方法
称取一定量的DPPH·,配成0.2 mmoL/L的DPPH溶液,于冰箱中冷藏保存,按照表1的方法加入制备好的花生壳提取液测定清除DPPH·的能力。

表1 DPPH·试验加样表Table 1 DPPH test plus sample table
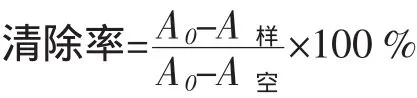
式中:A0为双蒸水与DPPH溶液反应的吸光值;A样:样品溶液与DPPH溶液反应的吸光值;A空:样品溶液与乙醇溶液反应的吸光值。
1.4.2 抗油脂过氧化力的测定[4]
1.4.2.1 测定原理
油脂发生过氧化反应从其化学本质来讲,主要是油脂中含有不饱和脂肪酸,尤其是亚油酸和亚麻酸上含有的1,4戊二烯结构使它们对氧化的敏感性远远超过油酸中丙烯体系,这种氧化作用又受到金属离子如Fe2+、Cu2+的催化,氧化反应一旦被启动,很容易形成链式反应,加速油脂的氧化酸败。抗氧化剂作为氢给予体和自由基接受体起着抑制链式反应的作用,从而使油脂过氧化反应的发生受到一定的限制。该方法的原理是[5]:丙二醛是油脂被氧化后的产物,它可以与硫代巴比妥酸反应生成有色产物可在532 nm下测定出其吸光值,吸光度值表示油脂氧化程度,其值越大,氧化程度越严重,当油脂中加入抗氧化剂时,就会减少氧化反应的发生从而降低丙二醛的含量。
1.4.2.2 测定方法
称取1 g油样,加入一定量的花生壳提取物,于烘箱中45℃下恒温24 h,取烘过的混合油样1 mL加入2 mL 20%的TCA和2 mL 0.6%的TBA在沸水浴下20 min,取出冷却后加入5 mL三氯甲烷,充分混匀,离心后取上清液比色,在532 nm下测定其吸光度。按以下公式计算抑制率。
加好样后摇匀,于室温下静置30 min后,分光光度计测定其吸光值。按以下公式计算清除率,并通过软件计算出IC50值。
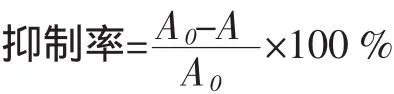
式中:A空为以蒸馏水代替样品不经烘箱处理的吸光值;A0为以蒸馏水代替样品经过烘箱处理的吸光值;A为样品管的吸光度值;A及A0计算时均需分别减去各自平行的空白即A空。
1.4.3 在Xan-XOD系统中的抗氧化力的测定[6]
1.4.3.1 测定原理
以羟胺为指示剂,以黄嘌呤为底物,黄嘌呤氧化酶可产生超氧阴离子自由基(O2-·)和过氧化氢(H2O2),二者可进一步反应生成羟基自由基(·OH)。·OH将盐酸羟胺氧化生成亚硝酸盐,后者可通过与对氨基苯磺酸与萘乙二胺的反应而被分光光度法检出。而抗氧化剂可通过抑制XOD酶的活性,或清除O2-·、H2O2、·OH等自由基以及抑制盐酸羟胺的氧化而减少亚硝酸盐的生成。
1.4.3.2 测定方法[7-8]
精确配制 0.1 mol/L 的 PBS,pH=7.4,1 mmol/L 的HONH2·HCl,0.5 mmol/L 的 Xanthine,0.04 U/mL XOD。将上述溶液以及稀释为不同浓度的花生壳提取液按表2依次加入到试管中,37℃下水浴振荡30 min。取出后取0.3 mL迅速加入0.3 mL 1%sulfanilic acid以及0.3 mL0.02%的NED后在540nm下测定其吸光度。
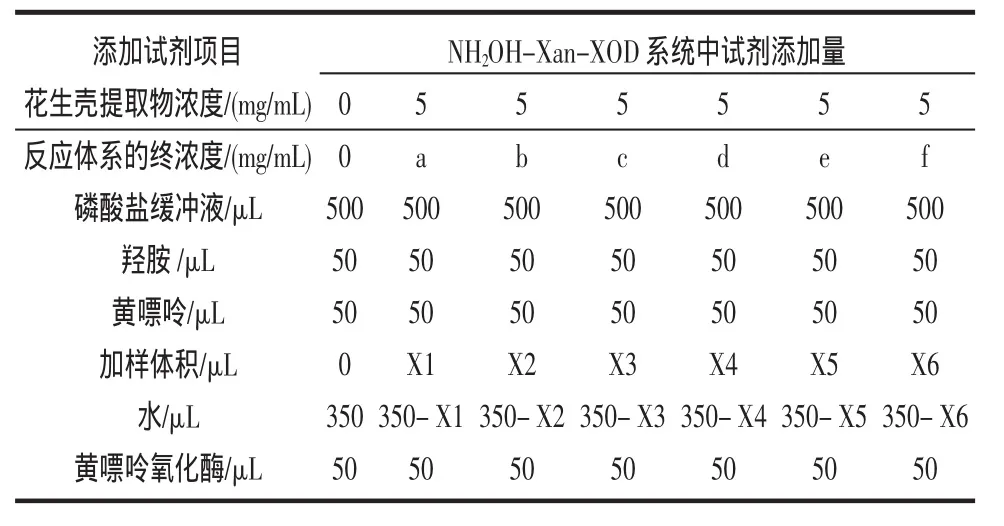
表2 NH2OH-Xan-XOD试验加样表Table 2 NH2OH-Xan-XOD plus sample table experiment
1.5 数据分析
每个试样测定2个平行试验,结果取平均值。所有数据采用Excel和origin7.5进行统计分析。
2 结果与分析
2.1 清除DPPH·试验
清除DPPH·试验,见图1。由图1可知,花生壳提取物清除DPPH·的能力与BHT基本相当,低于芦丁和Vc的清除能力。IC50从小到大依次为:VC的0.5 μg/mL>芦丁的 1.45 μg/mL>花生壳提取物的 7 μg/mL>BHT 的 10.2 μg/mL。
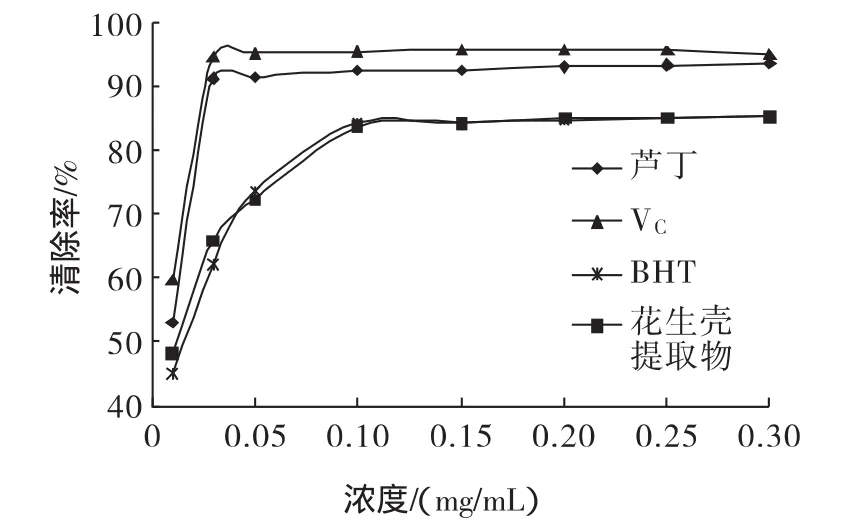
图1 花生壳提取物与其它几种抗氧化剂清除DPPH·的比较Fig.1 Peanut hull extract and several different antioxidants Comparison of Removal DPPH radical
2.2 抗油脂过氧化试验
2.2.1 花生壳提取物在不同油脂中的抗氧化效果
花生壳提取物在不同油脂中的抗氧化效果见图2。
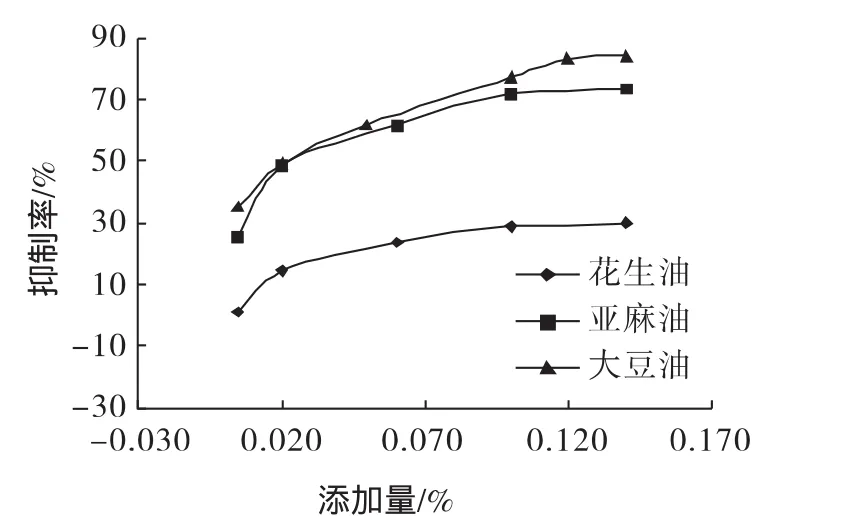
图2 花生壳提取物在不同油脂中的抗氧化效果Fig.2 Anti-oxidant of peanut hull extract effect on different oils and fats
由图2可知:随着花生壳提取物添加量的增加,其对油脂过氧化力的抑制率增大,在大豆油和亚麻油中的抑制油脂氧化的能力要强于在花生油中,计算IC50,在大豆油中的有效添加量(抑制50%过氧化反应时的添加量)为0.017%,在亚麻油中的为0.027%,在花生油中的为1.19%。由于花生油中的油酸、亚油酸等不饱和脂肪酸的含量要高于大豆油和亚麻油,所以抑制其氧化的IC50要大于大豆油和亚麻油。
2.2.2 花生壳提取物和BHT在亚麻油体系中的抗氧化比较
花生壳提取物和BHT在亚麻油体系中的抗氧化比较见图3。
由图3可知,在亚麻油评价体系中,花生壳提取物抑制能力明显高于BHT,其IC50分别为0.027%、0.12%。在相同的添加量条件下,花生壳提取物的抑制率平均为BHT的1.5倍。
2.3 NH2OH-Xan-XOD系统抗氧化试验
花生壳提取物和VC在NH2OH-Xan-XOD系统中的抗氧化能力比较如图4和图5所示。
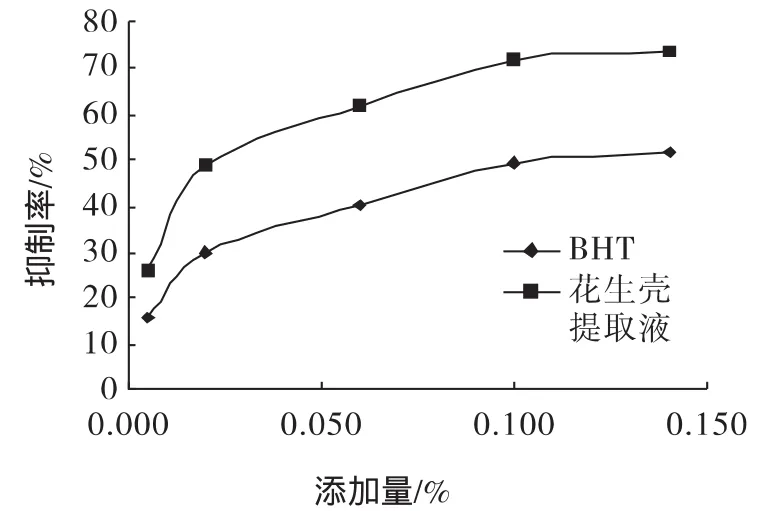
图3 花生壳提取液和BHT在亚麻油中的抗氧化效果的比较Fig.3 Peanut hull extract and BHT in the antioxidant effects of linseed oil with comparison
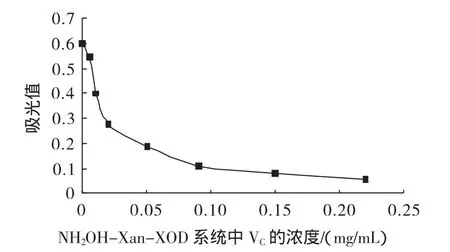
图4 VC在NH2OH-Xan-XOD系统中的抗氧化效果Fig.4 Antioxidant of VCeffect on NH2OH-Xan-XOD system
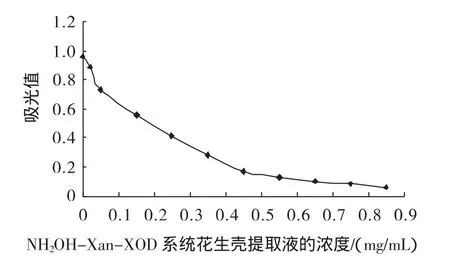
图5 花生壳提取物在NH2OH-Xan-XOD系统的抗氧化效果Fig.5 Antioxidant of peanut shell extract effect on NH2OH-Xan-XOD system
由图4和5可知,花生壳提取物在0.02 mg/mL~0.45 mg/mL范围内亚硝酸盐的生成明显减少,即·OH的生成被抑制,其IC50为200μg/mL,VC的为7.85μg/mL,花生壳提取物中因含有其他物质或杂质等,故清除·OH的能力要低于纯品VC。
3 结论
抗氧化的作用可以通过多种途径来进行评价,不同的评价系统其原理不相同。通过3个抗氧化模型系统对花生壳提取物进行评价,包括涉及人工合成的自由基的清除、对·OH的抑制及过氧化产物的抑制等。3种抗氧化方法虽然不能相互比较,但可以反应出花生壳提取物在不同体系中的抗氧化作用,如图6所示。

图6 花生壳提取物的3种抗氧化方法的综合比较Fig.6 Comparison with three methods of vitro on antioxidant of peanut hull extract
结果表明:
1)在清除DPPH·试验中,花生壳提取物有优于BHT的抗氧化效果,其 IC50为7 μg/mL;
2)在抗油脂过氧化试验中,花生壳提取物均表现出较高的抗氧化能力,在抑制亚麻油脂质过氧化试验中,其抗氧化效果明显高于BHT,其IC50大豆油中为0.017%,亚麻油中为0.027%,花生油中为1.19%;
3)在NH2OH-Xan-XOD系统中的抗氧化能力试验中,花生壳提取物的IC50在200 μg/mL,具有清除过氧化氢、超氧自由基和·OH的能力。
花生壳提取物的抗氧化能力与其中所含的木犀草素成正相关。随着木犀草素含量的增加,抗氧化的能力增强,由此表明花生壳提取物中主要的抗氧化物质为木犀草素。
[1]付陈梅,焦必宁,阚建全.果蔬总抗氧化能力间接测定法及其影响因素[J].食品科学,2008,29(4):457-460
[2]许申鸿,杭瑚.DPPH·分光光度法测定抗坏血酸[J].食品科学,1999,7:55-57
[3]Collins M A,Charles H P.Antimicrobial activity of carnosol and ursolic acid:two antioxidant constituents of Rosmarinus officinalisL[J].Food Microbiology,1987,4:311-315
[4]沈建福,张英.竹叶黄酮糖苷的水解及其苷元的抗氧化性能研究[J].中国粮油学报,2001,16(4):14-16
[5]杨淑珍,张友胜,彭丽桃,等.二氢杨梅树皮素的抗氧化效果研究[J].中国粮油学报,2004,19(2):82-84
[6]Janisch K,Hippeli S,Dornisch K,et al.Determination of the antioxidative potential of human plasma after supplementation with pycnogenol and whey[J].Food Res Int,2002,35:257-266
[7]Schempp H,Weiser D,Elstner EF.Biochemical modelreactions indicative of inflammatory processes.Activities of extracts from Fraxinus Excelsior and Populus tremula[J].Arznelmittel-Forschung,2000,50:362-372
[8]Halliwell B,Gutteridge JMC.Free Radicals in Biology and Medicine[M].Third edition:Oxford Univesity Press,1999:120-121
The Study in Comprehensive Comparison with Three Methods of Vitro on Antioxidant of Peanut Hull Extract
YANG Ying1,2,SONG Shu-hui2,WANG Wen-qi2,XU Gui-hua1
(1.Agriculture College,Ningxia University,Yinchuan 750001,Ningxia,China;2.National Engineering Research Center for Vegetables,Beijing 100097,China)
2009-09-16
杨颖(1985—),女(汉),在读研究生,主要从事功能性成分的提取及食品安全检测方面的研究。

