采后厚朴提取物处理对桃果实抗病性的影响
张 莉,冯晓元,王政军,李文生,王宝刚,杨军军
(1.青岛农业大学海都学院食品系,山东莱阳265200;2.北京市农林科学院林业果树研究所,北京100093;3.青岛农业大学图书馆,山东青岛266109)
采后厚朴提取物处理对桃果实抗病性的影响
张 莉1,冯晓元2,*,王政军3,李文生2,王宝刚2,杨军军2
(1.青岛农业大学海都学院食品系,山东莱阳265200;2.北京市农林科学院林业果树研究所,北京100093;3.青岛农业大学图书馆,山东青岛266109)
以“八月脆”桃为试材,通过损伤接种研究了采后厚朴提取物处理对桃果实采后病害的控制和抗病性酶的影响。结果表明:采收后用3.13、6.25、12.50mg/mL的厚朴提取物处理桃果实,十分有效地抑制了桃果实接种的褐腐病(Monilinia.fracticola)的发生;并且明显诱导了果实中苯丙氨酸解氨酶、几丁质酶和!-1,3-葡聚糖酶等抗性相关酶活性。
厚朴提取物,桃,苯丙氨酸解氨酶,几丁质酶,!-1,3-葡聚糖酶
Abstract:In this paper,control of postharvest diseases of peach fruit( Prunus persica cv.“ Bayuecui”)by postharvest infiltration inoculation or dipping of Cortex Magnolia Officinalis extract was investigated,and effects of these treatments on defense enzymes of peaches were also evaluated.The results indicated that 3.13mg/mL,6.25mg/mL and 12.50mg/mL Cortex Magnolia Officinalis extract treatment showed the significantly inhibitory effects in inoculated diseases of Monilinia.fracticola rot in peach fruit.And Cortex Magnolia Officinalis extract treatment effectively enhanced the activities of defense enzymes including phenylalanine ammonia-lyase(PAL),chitinase(CHT)and β-1,3-glucanase(GLU)of peach fruit.
Key words:Cortex Magnolia Officinalis extract;peach;phenylalanine ammonia-lyase;phitinase;β-1,3-glucanase中图分类号:TS255.1 文献标识码:A 文章编号:1002-0306(2010)10-0136-03
在水果采后贮藏、加工和运销过程中,经常由于病原微生物侵染引起水果大量腐烂,造成巨大经济损失。目前主要依靠使用人工合成的化学杀菌剂控制水果采后病害,但是由于病原菌抗药性问题和药剂残留问题,使用杀菌剂控制果实采后病害受到了越来越多的限制,寻找更加安全、有效的控制水果采后病害的方法就显得十分重要。中药厚朴是木兰科植物厚朴(Magnolia officinalis Rehd.et Wils.)的树皮、根皮或枝皮,是我国重要的传统中药[1]。厚朴中含有厚朴酚、各种挥发油类、生物碱以及少量皂苷、鞣质等多种化学成分,其中以厚朴酚为主要有效成分,约占原药材的5%~12%。厚朴提取物作为一种中草药保鲜剂,不仅可减轻水果采后腐烂,延长采后寿命[2],而且无毒、无污染、无残留,符合绿色食品的要求,但除了知道其有抑菌作用外[2-3],对其它的作用机制还缺乏深入的了解。因此,本文主要研究了采后厚朴提取物处理对桃果实褐腐菌(Monilinia fructicola)的控制效果以及诱导桃果实抗病性酶的情况,以此了解厚朴提取物在控制病害方面的可能作用机制,为生产实践提供理论依据。
1 材料与方法
1.1 实验材料
八月脆桃(Prunus persica cv.Bayuecui) 采自北京市平谷区王辛庄镇许家务果园,果实采收当天运回实验室;厚朴提取物 标准制备工艺生产的褐色粉末,含5%~12%厚朴酚,由北京市农科院林业果树研究所提供,经北京市疾病预防控制中心检测证明其无毒、无刺激性,可以安全用于食品;褐腐病菌(Monilinia fracticola) 由中国科学院植物研究所提供,在马铃薯(PDA)培养基上继代培养。
1.2 实验方法
1.2.1 厚朴提取物处理 分别配制浓度为3.13、6.25、12.50mg/mL的厚朴提取物溶液(用2%NaHCO3溶液调节所配制溶液的pH为7.0),浸泡果实5min,取出自然晾干。然后将果实放入0.03mm厚的聚乙烯保鲜袋中,内加乙烯吸收剂(高锰酸钾∶珍珠岩=0.68∶1),封口,在 0±0.5℃下贮藏,以清水处理为对照。在处理1周后,分别进行接种实验。每处理用果150个,重复3次。
1.2.2 病原菌及孢子悬浮液的制备 将褐腐菌接种于PDA培养基上,25℃下恒温培养7d,然后用含0.05%Tween80的无菌水制成浓度约为5×104个/mL的孢子悬浮液。悬浮液孢子计数采用血球计数板法。
1.2.3 接种方法 选择外观整齐、无病虫害和机械损伤的桃果实,用接种针在果实胴部刺1个3mm(宽)×4mm(深)的伤口,将伤口表面晾干,接种褐腐病菌悬浮液15!L。伤口晾干后将果实放在300mm×200mm×100mm的塑料包装盒中,外套一塑料袋以保持相对湿度在95%左右,存放于25℃恒温下。每天统计果实发病率,利用十字交叉法测量病斑直径。每处理用果30个,重复3次。在褐腐病发病过程中,定期(接种处理后 0、1、2、3、4d)取果实病斑周围2cm内健康果肉组织进行PAL、CHT和GLU活性测定。
1.2.4 苯丙氨酸解氨酶(PAL)酶液制备与活性测定参照 Assis 等[4]和吴芳芳等[5]的方法,加以改进。从6个果实中取5.0g果肉样品,加入10mL经4℃预冷的0.1mol/L,pH8.8的硼酸缓冲液(含5mmol/L"-巯基乙醇,4%(w/v)PVP,2mmol/L EDTA),石英砂1g,于研钵中冰浴研磨成匀浆,然后于 4℃,12000r/min离心30min,上清液用于酶活性测定。PAL酶活性以U/gFW·h表示。
1.2.5 几丁质酶(CHT)和 "-1,3-葡聚糖酶(GLU)酶液制备与活性测定 从6个果实中称取5.0g果肉,加入10mL 0.1mol/L,pH5.0的乙酸缓冲液(含5mmol/L"-巯基乙醇,4%(w/v)PVP和 1mmol/L EDTA),在冰浴条件下研磨匀浆,于4℃,12000r/min离心30min,弃去沉淀,上清液用于CHT和GLU酶活性测定。
CHT 活性测定:参照荣瑞芬等[6]和 Harman 等[7]的方法并加以改进,以每秒钟分解胶状几丁质产生1×10-6!g N-乙酰氨基葡萄糖为一个酶活性单位(U),酶活性以U/mg FW表示。GLU活性测定:参考 Abeles等[8]和 Reese 等[9]的方法并加以改进,以每秒钟分解昆布多糖产生1×10-6!g葡萄糖为一个酶活性单位(U),酶活性以U/mg FW表示。
1.2.6 数据的统计与分析 应用SPSS 11.5软件对所有数据进行方差分析(ANOVA),并利用邓肯式多重比较对差异显著性进行分析。
2 结果与分析
2.1 采后厚朴提取物处理对桃果实损伤接种褐腐病菌的影响
从图1可以看出,采后厚朴提取物处理在常温下对M.fructicola引起的桃果实褐腐病的发病率和病斑直径均有很好的抑制效果,且随浓度的增大,抑制作用逐渐增强。CK在接种后第2d就开始发病,并且发病率达到了83.33%;6.25、12.50mg/mL厚朴提取物处理的果实在第3d才开始发病,发病率分别为66.67%与33.33%,均显著低于CK(100%);其病斑直径分别为16.1%和11.3%,也显著小于 CK(51.4%),而且随着培养时间延长,效果仍很明显(P<0.05)。这说明采后厚朴提取物处理一定程度上能推迟桃果实褐腐病的发生,并对病斑扩展也有明显的抑制作用。
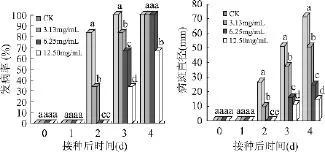
图1 采后厚朴提取物处理对桃果实损伤接种褐腐病菌发病率和病斑直径的影响
2.2 采后厚朴提取物处理对桃果实苯丙氨酸解氨酶(PAL)活性的影响
厚朴提取物处理以及损伤接种褐腐菌对桃果实PAL活性的影响如图2所示。三个浓度厚朴提取物处理果实的PAL活性在整个实验过程中均显著高于CK(P<0.05),并随浓度的增大,升高效果越明显。以6.25mg/mL处理为例,它在未接种M.fructicola(即桃果实接种后0d)时的PAL活性(23.20 U/g FW·h)比CK(16.73U/g FW·h)高出38.67%,在接种后第1d高出CK(10.70U/gFW·h)114.49%,并随着培养时间延长,效果仍很明显,到接种后第4d仍比 CK(19.20U/g FW·h)高58.59%,表明采后厚朴提取物处理能够刺激桃果实中PAL活性增强。
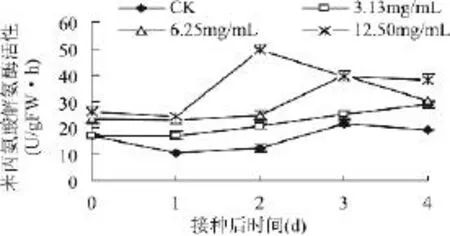
图2 采后厚朴提取物处理对发病过程中桃果实PAL活性的影响
2.3 采后厚朴提取物处理对桃果实几丁质酶(CHT)活性的影响
如图3所示,厚朴提取物各处理与CK的CHT酶活性都是在接种1d后上升达到高峰,但三个浓度厚朴提取物处理的 CHT活性显著高于 CK(P<0.05),尤其是 6.25mg/mL处理的酶活峰值最大(18.83U/mg FW),比 CK(10.24U/mg FW)高出83.89%。在接种第 2、3、4d,虽然 CK 与 3.13、6.25、12.50mg/mL厚朴提取物处理果实的CHT活性变化趋势相同,都是先下降后上升,但是CK的CHT活性明显比三个处理的低,与之相比差异显著(P<0.05)。说明厚朴提取物诱导了桃果实中CHT活性的迅速升高,并且具有持久性。

图3 采后厚朴提取物处理对发病过程中桃果实CHT活性的影响
2.4 采后厚朴提取物处理对桃果实β-1,3-葡聚糖酶(GLU)活性的影响
从图4可看出,CK 与3.13、6.25、12.50mg/mL厚朴提取物处理果实的GLU活性在接种后第2d之前都是先上升后下降的,但是CK的GLU活性显著小于三个浓度处理的(P<0.05)。到了第3d,CK的GLU活性急剧下降达到最低点,而 3.13、6.25、12.50mg/mL厚朴提取物处理的GLU活性仍在继续升高或仅有少许降低,比此时CK(322.40U/mg FW)分别高出了76.21%、125.31%和97.10%;到实验结束即接种后第4d,仍分别显著高于CK(P<0.05),说明厚朴提取物很大程度上激活了桃果实中的GLU活性。
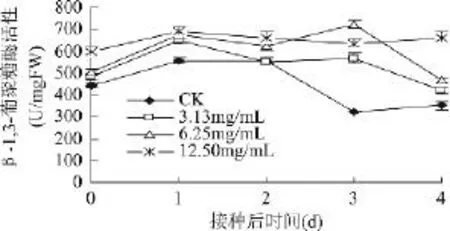
图4 采后厚朴提取物处理对发病过程中桃果实GLU活性的影响
3 讨论
植物的抗病性反应中,抗性相关酶发挥了重要作用,这主要包括酚类代谢系统中的一些酶和病程相关蛋白(PRs)家族。苯丙氨酸解氨酶(PAL)、几丁质酶(CHT)及 β-1,3-葡聚糖酶(GLU)就是存在于植物体内与抗病性有关的酶。PAL是苯丙烷类代谢中的关键酶和限速酶,由该途径合成的中间产物酚类物质以及木质素和类黄酮类、植保素等都是植物体内一些重要的抗菌物质。CHT和GLU属于病程相关蛋白的成员,可以降解病原菌细胞壁的主要组成成分几丁质和β-1,3-葡聚糖,使病原微生物的生长受到限制[6,10],两种酶还具有协同杀菌作用,当两者协同表达时,植物可以显现出最强的抑菌活性。生物或非生物处理都可诱导植物防御酶活性提高,对此已有大量报道:拮抗菌处理可以诱导苹果中PAL、CHT、GLU 等酶活性的提高[11];UV-C 处理番茄后,诱导 PAL活性的增加,激活了CHT、GLU 活性[6];水杨酸(SA)可以诱导多种植物产生病程相关蛋白如CHT和GLU[12-13];黄柏、虎杖提取物处理梨果实后,均对PAL、CHT和GLU活性有不同程度地诱导提高[14-15]等。然而,有关厚朴提取物诱导抗性酶活性变化方面的情况却鲜有报道。
4 结论
实验结果表明,桃果实接种褐腐菌后,厚朴提取物处理果实中苯丙烷类代谢的关键酶PAL活性明显增强(图2);桃果实CHT和GLU活性在厚朴提取物处理后显著升高(图3和图4)。相应地,厚朴提取物处理后的桃果实增强了对病原菌侵染的抵抗能力,不同程度地降低了果实损伤接种M.fructicola后引起的褐腐病的发病率,减小了病斑直径(图1),说明桃果实经厚朴提取物处理产生的抗病性与其诱导的PAL、CHT和GLU活性直接相关。
[1]张建和,符伟玉,莫丽儿.中药厚朴及其提取工艺的研究概况[J].时珍国医国药,2004,15(5):313-314.
[2]李美霞,冯晓元,邓西民,等.植物提取物对桃采后褐腐病的防治研究[J].保鲜与加工,2004(3):27-29.
[3]孔苗,冯晓元,李文生,等.和厚朴酚对水果采后致腐真菌的抑制作用[J].保鲜与加工,2005(3):10-12.
[4]Assis JS,Maldonado R,Munoz T,et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biol Technol,2001,23:33-39.
[5]吴芳芳,檀根甲.苹果感染炭疽病菌后6种酶活性的变化[J].安徽农业大学学报,2004,31(1):46-50.
[6]荣瑞芬,冯双庆.采后番茄果皮中抗病相关酶活性的诱导[J].北京联合大学学报:自然科学版,2003,17(3):36-39.
[7]Harman G E,Hayes C K Lorito M,et al.Chitinolytic enzymes of Tricboderma harzianum:purification of chitobiosidase and endochitinase[J].Phytopathobgy,1993,83:313-318.
[8]Abeles F B,Forrence L E.Temporal and hormonal control of β-1,3-glucanase in Phaseolus vulgaris L[ J].Plant Physiol,1979,45:395-400.
[9]Reese E T,Mandel M.β-glucanases other than cellulase[J].Methods in Enzymology Ⅷ,1996,104:607-602.
[10]邢晓科,郭顺星.伴生菌对猪苓几种酶活性的影响[J].中国中药杂志,2004,29(4):311-313.
[11]Ippolito A,EI-Ghaouth A,Wilson C L,et al.Control of pastharvest decay of apple fruit by Aureobasidium pullulans and induction of defense responses[ J].Postharvest Biol Technol,2000,19:265-272.
[12]Derckel J P,Legendre L,Audran J C,et al.Chitinase of the grapevine( Vitis vinifera L.):five isoforms induced in leaves by salicylic acid are constitutively expressed in other tissues[J].Plant Sci,1996,119:31-37.
[13]Yao HJ,Tian SP.Effects of pre-and post-harvest application of salicylic acid or methyl jasm-onate on inducing disease resistance of sweet cherry fruit in storage[J].Postharvest Biol Technol,2005,35:253-262.
[14]张莉,冯晓元,丁立孝,等.黄柏提取物对采后梨果实PAL、CHT 及 GLU 的诱导[J].食品研究与开发,2007,28(2):28-31.
[15]张莉,冯晓元,李文生,等.虎杖提取物处理对采后梨果实抗性相关酶活性的诱导[J].食品工业科技,2007,28(3):64-66.
Effect of Cortex Magno/ia Officina/is extract treatment on disease resistance of harvested peach fruit
ZHANG Li1,FENG Xiao-yuan2,*,WANG Zheng-jun3,LI Wen-sheng2,WANG Bao-gang2,YANG Jun-jun2
(1.Food Department of Haidu College,Qingdao Agricultural University,Laiyang 265200,China;2.Institute of Forestry and Pomology,Beijing Academy of Agriculture and Forestry Sciences,Beijing 100093,China;3.Qingdao Agricultural University Library,Qingdao 266109,China)
2009-03-16 *通讯联系人
张莉(1979-),女,硕士,助教,主要从事农产品贮藏与加工工作。
北京市科委基金课题(D0704002040431)。

