花生红衣中多酚类物质清除DPPH自由基能力和抑菌性能的研究
赵 萍,林樱姬,金征宇,王 雅,王 莉,亓文静
(1.食品科学与技术国家重点实验室江南大学食品科学与工程学院,江苏无锡214122;2.兰州理工大学生命科学与工程学院,甘肃兰州730050)
花生红衣中多酚类物质清除DPPH自由基能力和抑菌性能的研究
赵 萍1,2,林樱姬2,金征宇1,王 雅2,王 莉2,亓文静2
(1.食品科学与技术国家重点实验室江南大学食品科学与工程学院,江苏无锡214122;2.兰州理工大学生命科学与工程学院,甘肃兰州730050)
研究了花生红衣多酚类物质对DPPH自由基的清除能力及抑菌性能。将花生红衣多酚粗提和纯化后的物质与没食子酸标准品、单宁酸标准品及抗坏血酸的EC50值作比较,得到花生红衣多酚粗提物EC50(0.194mg/L)<纯化花生红衣多酚 EC50(0.705mg/L)<没食子酸 EC50(0.760mg/L)<单宁酸的 EC50(5.409mg/L)<抗坏血酸的 EC50(3.745mg/L)。纯化后花生红衣多酚对枯草芽孢杆菌、大肠杆菌、青霉、黑曲霉和毛霉均有抑菌性能,最低抑菌浓度为250mg/L。
花生红衣,多酚,DPPH自由基,抑菌
Abstract:The bacteriostasis and scavenging DPPH· c apability of the polyphenols extracted from peanut testa were studied.The results showed that scavenging effects on DPPH·of cude peanut testa extract EC5(00.194mg/L)were better than purified polyphenols EC5(00.705mg/L),Gallic Acid EC5(00.76mg/L),Tannic acid EC5(05.409mg/L),∨CEC50(3.745mg/L).There were antibacterial properties of pure polyphenols from peanut testa,such as Staphylococcus aureus,Escherichia coli,Penicillium sp.,Actinomucor sp.and Aspergillus niger.The minimum inhibiting concentrations were all 250mg/L.
Key words:peanut testa;polyphenols;DPPH·;bacteriostasic
花生红衣中富含多酚类化合物,具有抗氧化等生物活性[1]。但在花生加工业中,花生红衣仍作为一种经济效益很低的副产品存在,没有得到充分的综合利用[2]。国内外对植物资源的研究非常活跃,从植物中提取的某些活性物质具有抗菌、抗氧化和其他生理作用,为植物源防腐剂的发展提供了物质基础[3-4]。我国学者研究了大蒜、生姜、丁香等50多种香辛料植物及大黄、甘草、银杏叶等200多种中草药及其他植物如竹叶等提取物的抗菌实验,发现有150多种具有广谱的抑菌活性,已经作为天然防腐剂在某些食品中作了一些简单的应用。BRANEN[5]提出酚类物质对很多细菌有效;CHANG和 BRANEN报道在真菌培养基中250mg/kg的BHA就可以抑制霉菌生长以及黄曲霉毒素的生成;RACCAH在酚类抗氧化剂抑菌活性文献综述中提出:酚类物质抑菌能力比较强[6]。而对于花生红衣中多酚类物质是否也同样具有抑菌效果的研究则比较少。
1 材料与方法
1.1 材料与仪器
鲁花大花生红衣 山东鲁花公司提供,将其粉碎过40目筛,备用;DPPH·(二苯代苦味酰基自由基)、GA(没食子酸标准品)、单宁酸标准品 SIGMAALDRICH.Inc;无水乙醇 山东莱阳市双双化工有限公司;维生素C 天津市医药工业技术研究所;铁氰化钾 国药集团化学试剂有限公司;Folin-C试剂[7];所用试剂 均为分析纯;大肠杆菌(Escherichia coli(Migula)Castellani et Chalmers,GSICC 30507)、金黄色葡萄球菌金黄色亚种(Staphylococcus aureus subsp.Aureeus Rosenbach,GSICC 31902) 由甘肃省微生物菌种保藏中心提供;枯草芽孢杆菌(Bacillus subtilis)、青霉(Penicillium sp.)、黑曲霉(Aspegillus niger)、毛霉(Actinomucor sp.) 由兰州理工大学生命科学与食品实验中心提供。
超声波细胞粉碎机 JY92-Ⅱ,宁波新芝生物科技股份有限公司;UV-9200紫外分光光度计 UVSpectrophtotmeter Cary50 Probe;743 型 Rancimat仪瑞士万通;电子分析天平 AB104-N梅特勒-托利多仪器有限公司;飞鸽牌台式离心机TDL-5-A 上海安亭科学仪器厂;冻干机FD-1-55 北京博衣康实验仪器有限公司。
1.2 实验方法
1.2.1 花生红衣多酚的制备流程 花生红衣粉碎筛→超声细胞粉碎→离心→减压浓缩→AB-8大孔树脂纯化→减压浓缩→冻干
1.2.2 花生红衣多酚的制备[8]花生红衣粉碎过40目筛,以70%乙醇溶液为提取溶剂,料液比1∶12(g/mL),利用超声细胞粉碎仪,功率为240W,超声提取10min。提取液离心后,弃去沉淀,在30℃下减压浓缩,蒸去乙醇,得粗提液。粗提液过AB-8大孔树脂,60%乙醇洗脱,30℃下减压浓缩,浓缩液至冻干机冷冻干燥,得纯化后多酚产物。
1.2.3 花生红衣多酚对DPPH·清除能力测定[9-10]DPPH·是一种人工合成的稳定自由基,其乙醇溶液显紫色,在517nm处有最大吸收。当有自由基清除剂存在时,DPPH·的单电子由于被配对,DPPH·浓度减小而使其颜色变浅,在517nm波长处的吸光度值变小,这种颜色变浅的程度与配对电子数成化学计量关系,因而可用分光光度法进行定量分析。由于该分析方法测定简便、快速,同时DPPH·较长的半衰期使此方法保持了良好的重现性,因此,尽管DPPH·并非人体内实际产生的自由基,对DPPH·的淬灭能力仍然可以有效地评价抗氧化剂的活性,在国内外被广泛用于清除自由基物质性质的研究与天然抗氧化剂的筛选。其能力用清除率(Scavenging Rate,SR)来表示,清除率越大,抗氧化能力越强。
1.2.3.1 待测液的制备 将未纯化的花生红衣提取物(PTE)和经纯化的花生红衣多酚(PPTE,纯度64%)、维生素 C(VC)和没食子酸(GA)、单宁酸(TA)标准品分别配制成体积分数为0.1mg/mL的无水乙醇溶液(母液),再将所配制的母液按照要求稀释成不同浓度的溶液。
1.2.3.2 DPPH·溶液的可见光谱 以无水乙醇为对照,精确吸取的DPPH·溶液2mL与2mL无水乙醇混合均匀后,以相对应的溶剂(4mL无水乙醇)为对照,用分光光度计测定上述溶液在最大吸收波长下的吸光度值(A0),在分光光度计上对DPPH·溶液进行在440~600nm下扫描,确定最大吸收波长为517nm。
1.2.3.3 样品溶液对DPPH·抗氧化能力测定 精确吸取上述不同浓度的 PPTE溶液2mL,分别与0.025mg/mL的DPPH·溶液2mL和2mL无水乙醇混合,摇匀后放置30min。以相对应的溶剂(无水乙醇)为对照调零,用分光光度计分别测定上述溶液在517nm处的吸光度值(Ai和 Aj),分别测得 Ai和Aj值。
清除率 SR(%)=[1-(Ai-Aj)/A0]×100%
其中,Ai:2mL样液与2mL的DPPH·溶液混合后在波长最大吸收波峰处的吸光度值;Aj:2mL样液与2mL无水乙醇溶剂混合后在波长最大吸收波峰处的光值;A0:2mL DPPH·溶液与2mL无水乙醇溶剂混合后在波长最大吸收波峰处的吸光度值。
1.2.4 花生红衣多酚抑菌性能的测定
1.2.4.1 培养基的制备 将配制好的各种菌株的培养基高压蒸汽灭菌(121℃、15min),冷却至 50~60℃,采用无菌操作倾注于干热灭菌(160℃、3h)过的培养皿内,每培养皿装15~20mL(培养皿内培养基的厚度约3~5mm),制备充足数量的菌种(每个供试菌种、每种多酚浓度做3个重复),放入4℃冰箱保存,不超过2d。
供试菌株悬浮液的制备:分别用接种针挑取少许菌体接种于装有玻璃珠及50mL无菌生理盐水的三角瓶中,振荡10min,制成均匀的菌悬浮液。调整菌悬浮液的浓度,使其含孢子或菌体量在106~107个/mL之间。分别用灭菌的移液枪向凝固的平板上加0.1mL菌体悬浮液,用无菌三角玻璃刮铲涂布均匀。
1.2.4.2 菌液的制备 用接种环挑取一环菌体或孢子放入装有50mL无菌生理盐水的锥形瓶中,在微型漩涡混合机上充分混匀,制成菌体悬液或孢子悬液备用。
1.2.4.3 PPTE抑菌活性测定-滤纸片法 用打孔器将滤纸打成10mm的圆片,把滤纸圆片用称量纸包好,每片称量纸隔开放两片在培养皿中;将培养皿包好,用干热灭菌法灭菌(160℃、3h),分别置于不同浓度的PPTE水溶液中浸泡10min;沥去多余试液,用无菌镊子放在涂好菌液的培养基上。对照用0.85%的无菌生理盐水浸泡。用无菌镊子镊取滤纸圆片,沿瓶壁沥去多余的PPTE溶液,采用无菌操作置于已用菌液涂布好的培养皿中。每个供试菌种做3个平行。每个培养皿中十字形对称放置 4 张滤纸圆片,分别用 5、3、1、0.5、0.25、0.1g/L PPTE溶液浸泡及0.85%无菌生理盐水(对照)浸泡。细菌、平板倒置于37℃恒温培养箱中培养24h;霉菌倒置于28℃恒温培养箱中培养48h,取出观察有无抑菌作用,培养结束后,用刻度尺测试培养基中抑菌圈的直径。
1.2.4.4 最低抑菌浓度(MIC)的测定[11]参考以上方法,对几种菌采用6种浓度的PPTE做最佳最小浓度抑菌实验。每株菌、每个平皿用无菌打孔器有规律地均匀打6个孔,其中一个作为对照(无菌0.85%生理盐水),其它加5种不同浓度的PPTE溶液。每种菌的每种浓度的PPTE做6个平行,观察结果,以不长菌的最低提取物溶液浓度为该提取物的最低抑菌浓度,以其平均值作为抑菌结果。
2 结果与分析
2.1 花生红衣多酚对DPPH·清除能力测定
通过表1可以看出,PTE、PPTE、维生素C和没食子酸对DPPH·都有一定的清除率,且PTE的EC50<PPTE的EC50<没食子酸的EC50<抗坏血酸的EC50<单宁酸的EC50,说明花生红衣多酚的清除自由基的能力比抗坏血酸、单宁酸和没食子酸强,这可能是由于花生红衣多酚中存在一些其他抗氧化性强的物质。从表中可以看出,经大孔树脂纯化后的花生红衣多酚的EC50值与没食子酸标准品的EC50值相近,可以看出花生红衣经纯化后,纯品的自由基清除能力已接近没食子酸标准品。而PTE的抗氧化性强于纯化后花生红衣多酚,主要原因可能是多酚类物质比较敏感,易分解变质,由于经过一系列的纯化过程,失去了其他物质的协同作用、自身的抗氧化物质产生变化,造成抗氧化活性的损失。而PTE与各单体之间可能存在相互间的作用与协同,使抗氧化能力增强。
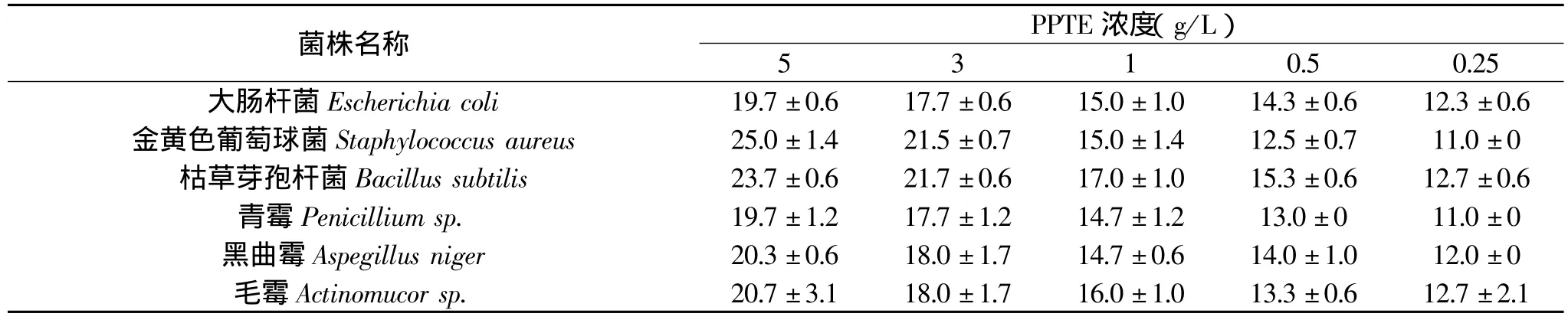
表2 PPTE抑菌圈直径(mm)

表3 PPTE最低抑制浓度

表1 PTE、PPTE、GA、TA 和 VC清除DPPH·回归方程及EC50值比较
2.2 PPTE的抑菌效果
由表2可知,PPTE对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌等细菌,黑曲霉、毛霉、青霉等真菌有明显抑制作用,对大肠杆菌、枯草芽孢杆菌、黑曲霉、毛霉抑制作用比较明显,当浓度达到250mg/L以上时,既有明显的抑菌圈产生,且抑菌能力随浓度增加而增强,随浓度逐步增加抑菌圈直径相应地增大。
2.3 最低抑菌浓度(MIC)
由表3可知,PPTE对枯草芽孢杆菌、大肠杆菌、青霉、黑曲霉、毛霉、葡萄球菌的最低抑制浓度均为250mg/L。
3 结论
3.1 PTE对DPPH·具有较好的清除作用,半清除浓度PTE为0.194mg/L,PPTE为0.705mg/L。PPTE半清除度已接近没食子酸标准品;而PTE的半清除度强于没食子酸标准品。因此,花生红衣提取物可以作为一种功能性抗氧化添加剂,在食品、医药、化妆品等领域具有广阔的应用前景。
3.2 PPTE对枯草芽孢杆菌、大肠杆菌、青霉、黑曲霉、毛霉和葡萄球菌的生长具有一定的抑制作用,最低抑菌浓度均为250mg/L,且抑菌圈大小随浓度的增加而增大。
[1]刘大川,刘强,等.花生红衣中自藜芦醇、原花色素提取工艺研究[J].食品科学,2005(7):l44-148.
[2]Jiangmei Yu,Mohamed Ahmendna,Ipek Goktepe.Effects of processing methods and extraction solvents on concentration and antioxidant activity of peanut skin phenolics[J].Food Chemistry,2005(90):199-206.
[3]Sökmen A,Sökmen M,Dafera D,et al.The in vitro antioxidant and antimicrobial activities of the essential oil and methanol extracts of Achillea biebersteini Afan(Asteraceae)[J].Phytother Res,2004,18:451-456.
[4]Lis-Balchin M,Steyrl H,Krenn E.The comparative effect of novel Pelargonium essential oilsand the ircorresponding hydrosols as antimicrobial agents in a model food system[J].Phytother Res,2003,17:60-65.
[5]BRANEN A L,DAVIDSON P M,KATZ B.Antimicrobial properties of phenolic antioxidants and lipids[J].Food Technol,1980,34(5):42-53.
[6]RACCACH M.The antimicrobial activity of phenolic antioxidants in foods:a review[J].Food Safety,1984,6:141-170.[7]Peterson,G L,Anal.Biochem[M].1979:100,201-220.
[8]赵萍,王雅,张轶,等.葵花籽粕乙醇提取物的抗氧化活性的研究[J].食品科学,2007,28(10):219-222.
[9]ARUOMAOI.Nutrition and health aspects of free radical sand antioxidants[J].Food Chemistry Toxic,1994,32(7):671-683.
[10]SáNCHEZ-MORENO C,LARRAURI J A,SAURACALIXTO F.A procedure tomeasure the antiradical efficiency of polyphenols[J].Journal Sciences Food Agriculture,1998,76:270-276.
[11]白喜婷,朱文学,罗磊,等.牡丹籽提取物的抑菌特性研究[J].中国酿造,2009,204(3):59-62.
Study on capability of scavenging DPPH·and bacteriostasic activity of polyphenols from peanut testa
ZHAO Ping1,2,LIN Ying-ji2,JIN Zheng-yu1,WANG Ya2,WANG Li2,QI Wen-jing2
(1.The State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
TS201.2
A
1002-0306(2010)10-0129-04
2009-10-15
赵萍(1964-),女,博士研究生,教授,主要从事农产品产后贮藏加工研究。
甘肃省自然科学研究基金计划(0803RJZA044)。

