黄河三角洲耐高渗碱性纤维素酶产生细菌YRD-19的诱变育种和产酶条件优化
桂春燕,陈义伦,*,谢晓平,董欣睿,宋 冀,吴玉双,韩明渠,刁日明,周 波,*
(1.山东农业大学食品科学与工程学院,山东泰安271018;2.山东农业大学生命科学学院,山东泰安271018;3.北京汇通达科技有限公司,北京100086;4.天津牧光生物技术有限公司,天津300193)
黄河三角洲耐高渗碱性纤维素酶产生细菌YRD-19的诱变育种和产酶条件优化
桂春燕1,陈义伦1,*,谢晓平2,董欣睿2,宋 冀2,吴玉双3,韩明渠3,刁日明4,周 波2,*
(1.山东农业大学食品科学与工程学院,山东泰安271018;2.山东农业大学生命科学学院,山东泰安271018;3.北京汇通达科技有限公司,北京100086;4.天津牧光生物技术有限公司,天津300193)
用紫外线对1株产耐盐碱纤维素酶的枯草芽孢杆菌YRD-19进行诱变育种,获得产酶能力是出发菌株5.97倍,并且产酶性能稳定的菌株YRD-19-35。进一步对其发酵条件进行研究,优化了培养基和培养条件。实验结果表明,优化培养基为:1.5%乳糖,1.5%蛋白胨,NaCl∶KH2PO4=5∶1,添加量为0.55%;优化培养条件为:接种量为2%,发酵温度为37℃,培养基初始pH为8.0,种子活化时间为24h,发酵时间为48h,装液量为50mL,摇床转速为200r/min时菌株YRD-19-35产酶的酶活力达到最高。在上述条件下,纤维素酶活力可达182.705U/g。
紫外诱变,纤维素酶,酶活力,发酵条件
Abstract:The original strain Bacillus sp.YRD-19 was mutated by U∨,and its enzyme productivity was 5.97 fold higher than that of parent strain.The continuous 6 generations test showed that the mutant YRD-19-35 was stable in the alkaline cellulase(CMCase)production.The effects of compositions of culture medium and cultural conditions on cellulose production were investigated.The optimal culture media were:lactose 1.5%,peptone 1.5%,NaCl∶KH2PO4=5∶1(0.55%).The optimum enzyme-producing conditions were pH 7.2 at 37℃,and the enzyme activity reached 182.705U/g after 48h of culture.
Key words:ultraviolet mutagenesis;cellulase;enzyme activity;fermentation conditions
碱性纤维素酶在碱性条件下具有内切!-1,4葡聚酶活力,已经成为一种世界各国普遍重视的新型酶制剂,碱性纤维素酶具有耐碱性强、热稳定性好、pH适应广泛等特点[2],已经在洗涤剂工业成功地获得应用,在食品、化工、造纸、麻纺、环境保护等领域均有重要作用和应用前景[1]。但是长期以来,纤维素酶产生菌的产酶能力都不太理想,因此通过诱变技术选育纤维素酶高产菌株就成了解决这个问题的关键[3]。本实验采用的菌种分离自黄河三角洲盐碱地区的碱性土壤中,不仅能够分泌碱性纤维素酶,而且分泌的纤维素酶能够耐高盐,可以应用到比较特殊的环境中去。本实验以枯草芽孢杆菌YRD-19为出发菌株,对其进行紫外诱变,筛选出产酶较高、酶活稳定的菌株YRD-19-35,并且对其产酶条件进行了优化。
1 材料与方法
1.1 实验材料
菌种YRD-19 由本实验室从黄河三角洲的盐碱地区分离到的一株耐盐碱,并能分泌耐盐碱纤维素酶的枯草芽孢杆菌;LB液体培养基 蛋白胨10.0g,酵母膏 5.0g,氯化钠 10.0g,水 1000mL,pH7.0;选择培养基 羧甲基纤维素钠10.0g,硫酸铵4.0g,磷酸二氢钾2.0g,蛋白胨1.0g,七水硫酸镁0.15g,制霉菌素 50万单位,琼脂 16~20g,水 1000mL,pH7.0~7.5;种子活化培养基[2](30mL/瓶) 蛋白胨10.0g,酵母粉 10.0g,CMC-Na 10.0g,氯化钠 5.0g,KH2PO41.0g,水 1000mL,pH7.2~7.5;发酵培养基(50mL/瓶)
蛋白胨 10.0g,酵母粉 10.0g,CMC-Na 10.0g,氯化钠 5.0g,KH2PO41.0g,秸 秆少 许(0.25g/瓶),水1000mL,pH7.2~7.5。
1.2 实验方法
1.2.1 菌株YRD-19生长曲线的绘制 将菌株YRD-19在LB液体培养基中活化18h,接入250mL三角瓶中,进行摇床培养。并于接种后的第0、2、4、6、8、10、12、14、16、18、20、24h,取一定菌液进行稀释后,利用分光光度计在600nm的波长下测定吸光度值。然后以OD600为纵坐标,生长时间为横坐标,绘制出菌株YRD-19的生长曲线。
1.2.2 菌株YRD-19的诱变处理
1.2.2.1 菌悬液的制备 取1环YRD-19菌种接种到液体LB培养基中,培养到对数生长期,然后离心沉淀菌体,弃去上清液[4]。用0.85%生理盐水(已灭菌)将菌体制成悬浮液,再离心,洗涤菌体两次。将菌悬液适当稀释,制备菌悬液,调节菌液浓度约1 ×108个/mL,备用[5]。
1.2.2.2 紫外诱变处理[4]紫外灯照射前,先预热20~30min。取8个培养皿,然后取5mL菌悬液置于直径9cm的培养皿中,在磁力搅拌器的搅拌下,选用20W紫外灯,照射距离为30cm,进行不同时间的照射处理。
1.2.2.3 突变株筛选 平板初筛:取诱变后的菌液,适当稀释后在选择培养基上进行涂布,以未经诱变的菌液稀释涂平板对照,37℃培养48h后,挑取透明圈直径与菌落直径比值较大的转接到LB斜面培养基上[6]。摇瓶复筛:将初筛到的菌株接种到液体发酵培养基上,37℃摇床培养 48h,测定酶活[7]。
1.2.3 产酶条件的优化[8]为了确定诱变菌株YRD-19-35的最优产酶条件,在发酵培养基的基础上选择不同的碳源、氮源以及营养盐之比进行发酵产酶,并通过正交实验设计和方差分析来确定诱变菌株YRD-19-35的产酶最优培养基配方;并且在产酶最优培养基的基础上进行发酵条件的优化(种龄、发酵时间、培养温度、初始pH)。
1.2.4 酶活测定方法[9]发酵液在4℃条件下,经5000r/min离心10min,取上清液作为粗酶液,并且用0.2mol/L的磷酸缓冲液(pH=8.0)进行适当稀释,取2mL稀释过的酶液加入到25mL刻度试管中,加入2mL1%的CMC-Na底物溶液,在60℃的水浴中保温30min,再加入5mL DNS试剂,在沸水中煮沸5min,之后用冷水冷却至室温,定容至25mL。在540nm下测定吸光度值,以灭活的酶液作为空白对照。
在pH8.0,60℃条件下,每分钟水解底物产生1!g还原糖所用的酶量作为一个酶活力单位U/g。
2 结果与分析
2.1 菌株YRD-19生长曲线的测定
由图1可以看出,YRD-19在一个较短的延迟期后,菌株即进入对数生长期,培养12h以后即进入稳定期,菌体浓度基本保持不变,因此对出发菌株宜选用培养10~11h(对数生长中后期)的菌体制成菌悬液,进行诱变处理。
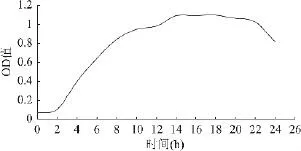
图1 菌株YRD-19的生长曲线
2.2 紫外线诱变剂量的选择
从图2可以看出,随着紫外线照射时间的延长,在0~90s照射时间内,菌落数下降较快,活菌数迅速减少。照射时间约为46、62s时,其致死率分别为80%、90%;100s 后,细菌几乎全部死亡。Leslie A[10]等 和Gerard A[11]等研究表明,致死率为99.0%时,可保证菌体发生最大程度的突变,故在本实验中选择在20W紫外灯,菌悬液距紫外灯管30cm下,照射64s为紫外诱变的剂量。
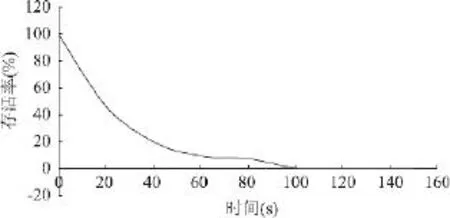
图2 菌株YRD-19紫外线照射时间与细菌存活率的关系
2.3 菌株的诱变与筛选
2.3.1 致死率为90%的诱变菌株的初筛 通过紫外诱变,一共选出了6株诱变菌株。通过平板初筛,比较各菌株的透明圈直径与菌落直径比值,并与出发菌株进行比较,结果见表1。
由表1可见,6株诱变菌株的水解圈直径与菌落直径比值相差比较大,并且比出发菌株YRD-19的要大很多,说明它们的酶活力比出发菌株YRD-19要高,它们之间的酶活也有较大的差异。但是透明圈只能用来初步判定菌株的酶活高低,不能完全代表菌种的产酶能力,这还需要对菌种进行液体发酵复筛。
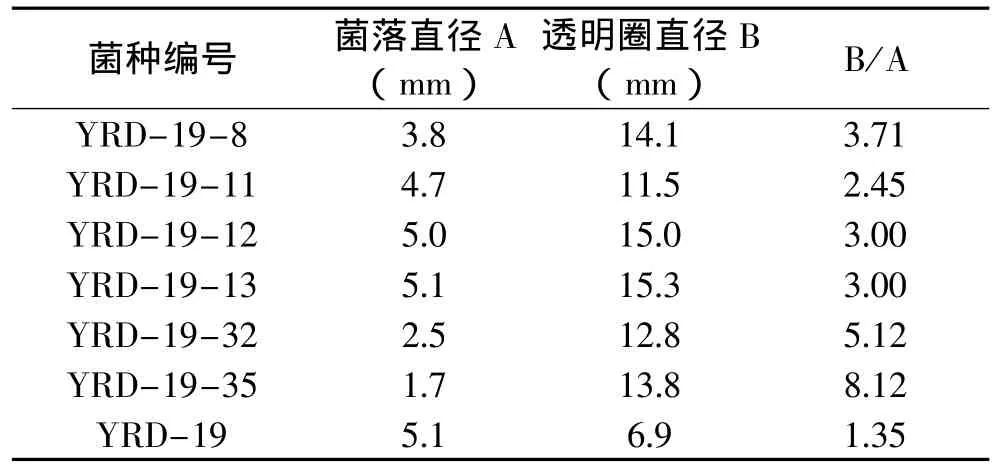
表1 致死率为90%的初筛菌株与出发菌株的比较
2.3.2 致死率为90%的诱变菌株的复筛 通过摇瓶复筛,测得6株诱变菌株的酶活力,并与出发菌株YRD-19进行比较,结果见表2。
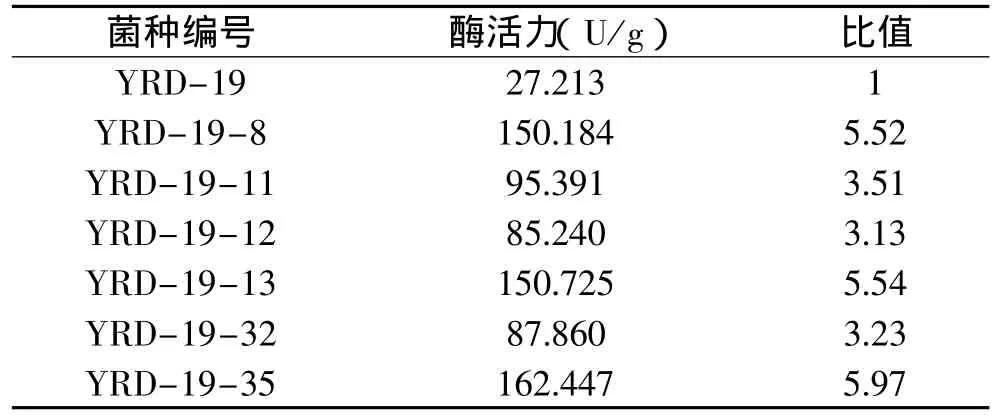
表2 致死率为90%的复筛菌株与出发菌株的酶活比较
从表2可以看出,诱变菌株与出发菌株相比酶活都有了很大的提高。其中,YRD-19-8、YRD-19-13和YRD-19-35的酶活力分别是出发菌株YRD-19 的5.52、5.54、5.97 倍,YRD-19-11、YRD-19-12和YRD-19-32的酶活力分别是出发菌株YRD-19的3.51、3.13、3.23 倍。
2.3.3 诱变菌株酶活稳定性的测定 对6株诱变菌株分别进行了5次传代,并分别进行了酶活测定,测定结果见表3。
由表3可以看出,经过5次传代之后,菌株YRD-19-8、YRD-19-11、YRD-19-12 和 YRD-19-13的酶活力都下降了,没有良好的稳定性;菌株YRD-19-32和YRD-19-35的酶活力基本上保持不变,具有良好的稳定性。菌株YRD-19-35的酶活要比YRD-19-32的高一倍,所以我们最终选用菌株YRD-19-35作为诱变菌株。
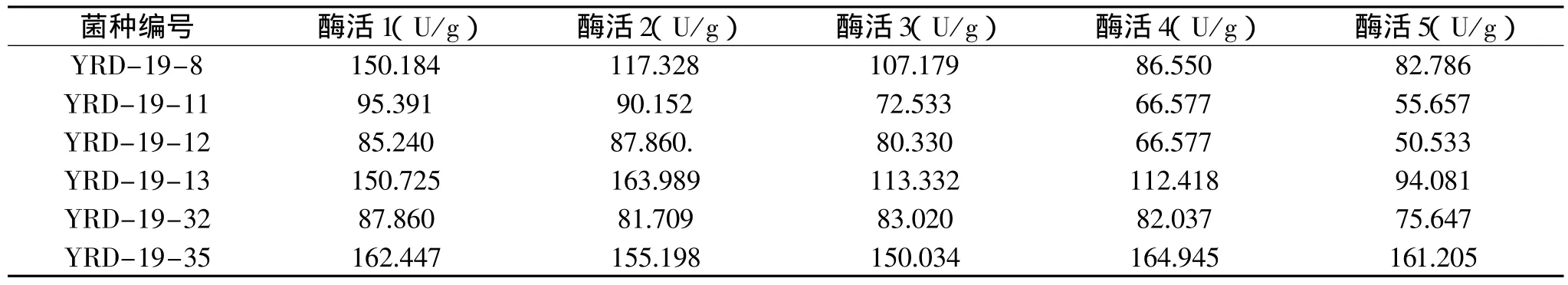
表3 6株诱变菌株的酶活稳定性测定结果
2.4 菌株YRD-19-35产酶条件优化
2.4.1 发酵培养基的优化
2.4.1.1 碳源对产酶的影响 碳源是微生物生长和诱导产酶的重要物质。纤维素酶是一种诱导酶,因此选择合适的碳源是诱导产酶的重要条件。本实验采用的基础培养基(%)为:蛋白胨1.0,酵母粉1.0,KH2PO40.1,NaCl 0.5,调节 pH 至7.2,以1%羧甲基纤维素钠(CMC-Na)、1%麸皮、1%可溶性淀粉、1%葡萄糖、1%蔗糖和1%乳糖为碳源,进行液体发酵产酶实验,研究不同碳源对产酶的影响,结果见表4。

表4 不同碳源对产酶的影响
由表4可以看出,添加不同的碳源对纤维素酶活力的影响很大。以乳糖为碳源时产酶最高,说明乳糖是其发酵的最佳碳源。
2.4.1.2 氮源对产酶的影响 本实验采用的基础培养基(%)为:乳糖 1.0,KH2PO40.1,NaCl0.5,以 1%蛋白胨、1%酵母粉、1%牛肉膏、0.5%蛋白胨+0.5%酵母粉、1%蛋白胨+1%酵母粉、1%硫酸铵、1%磷酸氢二铵等作为不同氮源,调节pH为7.2,进行液体发酵产酶实验,研究氮源对产酶的影响,结果如表5所示。
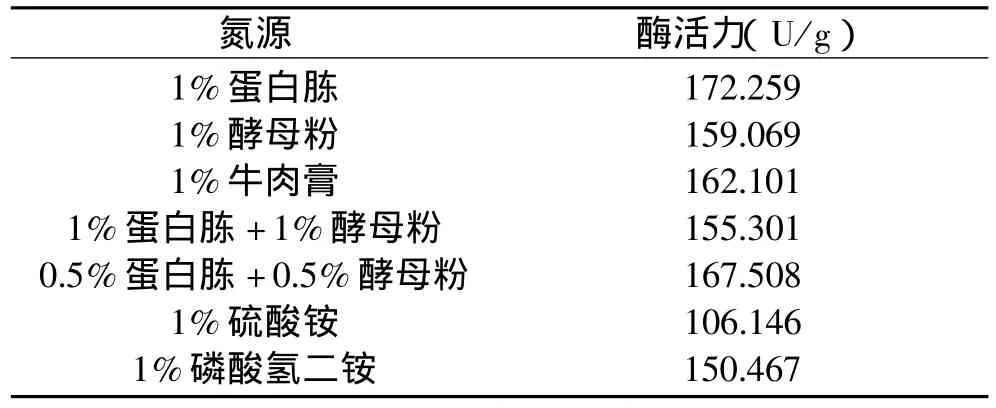
表5 不同氮源对产酶的影响
由表5可以看出,硫酸铵会使发酵液的pH改变过大,影响纤维素酶的产生;磷酸氢二铵对pH的变化有缓冲作用,促进产酶效果较好;而当以蛋白胨作为氮源时产酶最多,所以以1%蛋白胨作为菌株YRD-19-35发酵产酶的最佳氮源。
2.4.1.3 营养盐对产酶的影响 在产酶发酵培养基中主要有两种营养盐:氯化钠和磷酸二氢钾,这两者的添加质量之比对菌株的产酶效果也有一定的影响,本实验主要研究了以下三个比值对菌株YRD-19-35产酶效果的影响。结果见表6。
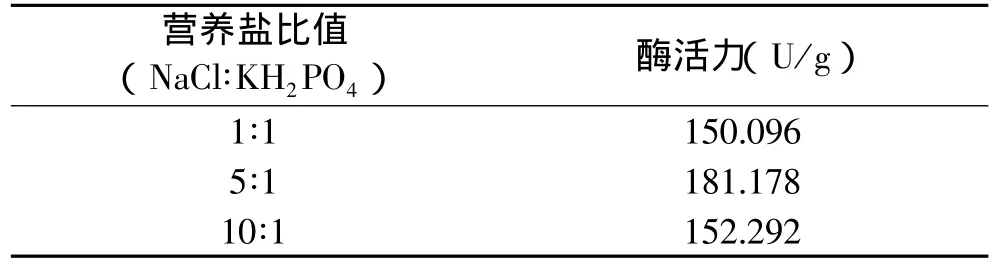
表6 不同营养盐质量分数对产酶的影响
由表6可以看出,当氯化钠和磷酸二氢钾的比值为5∶1时,菌株YRD-19-35的产酶效果最佳。
2.4.1.4 正交实验设计 通过单因素实验,确定发酵培养基的碳源、氮源以及营养盐的比例3个因素,即乳糖、蛋白胨、NaCl∶KH2PO4=5∶1。各取 3 个水平,测定发酵产物的纤维素酶活性,进行L9(34)正交实验,运用SAS程序进行正交实验设计及正交数据分析,实验因素与水平见表7。
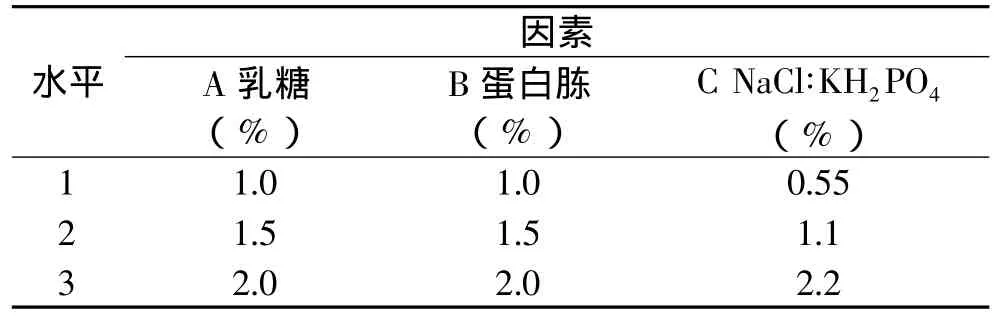
表7 正交实验水平表
由表8的 R值分析可知,蛋白胨 >乳糖 >NaCl∶KH2PO4,对产纤维素酶活影响最大的因素是蛋白胨添加量,其次是乳糖的添加量,而NaCl∶KH2PO4的添加量影响最小。
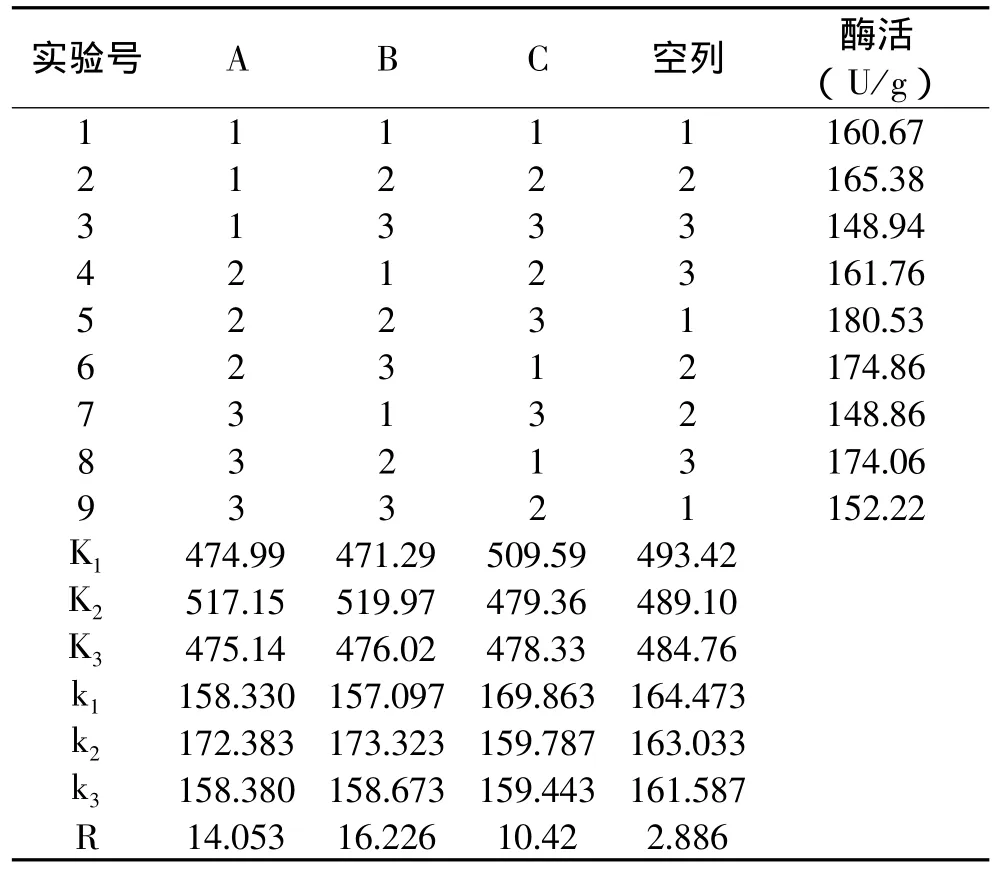
表8 纤维素酶活正交实验结果
由方差分析表9可以看出,乳糖和蛋白胨的添加量对纤维素酶活高低影响都显著,NaCl∶KH2PO4的添加量对纤维素酶活高低影响不显著。
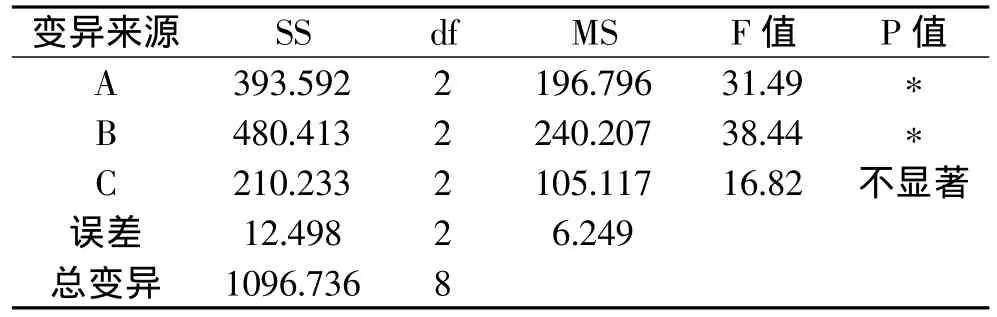
表9 正交设计纤维素酶活方差分析表
由表10可知,乳糖水平1,3之间差异不显著,与水平2差异显著,选择水平2;蛋白胨水平1,3之间差异不显著,与水平2差异显著,选择水平2;NaCl∶KH2PO4水平2,3之间差异不显著,与水平1差异显著,选择水平1。即纤维素酶活最好的实验组合为A2B2C1,最佳发酵培养基条件是:乳糖1.5%,蛋白胨1.5%,NaCl∶KH2PO40.55% 。
2.4.2 最适培养基下培养条件的优化
2.4.2.1 种子培养时间对产酶的影响 在最佳发酵培养基的基础上,将菌龄分别为24、36、48h的种子液接入摇瓶进行发酵实验,结果如表11所示。
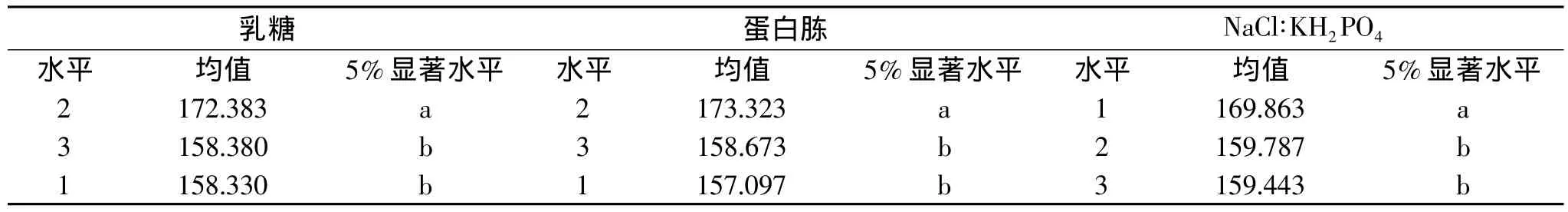
表10 多重比较结果
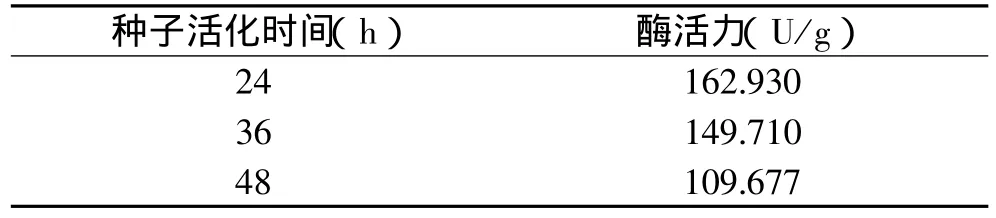
表11 种子活化时间对产酶的影响
由表11表明,当种子活化24h时再进行发酵,纤维素酶的酶活力最高。
2.4.2.2 发酵时间对产酶的影响 在最佳发酵培养基的基础上,选定不同发酵时间16、24、36、48、60h 进行酶活测定,结果见图3。
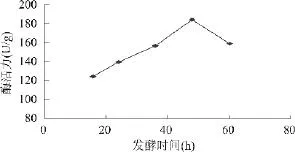
图3 发酵时间对产酶的影响
由图3的结果表明,当发酵时间为48h时,菌株YRD-19-35产纤维素酶的效果最佳。
2.4.2.3 培养温度对产酶的影响 将培养24h的种子活化液以2%的接种量分别接入发酵培养基中,在不同温度(25、30、35、37、40、45℃)下进行摇床发酵培养,研究培养温度对菌株YRD-19-35产酶的影响,结果见图4。
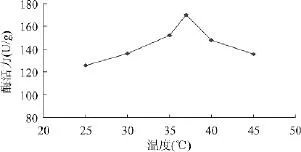
图4 温度对产酶的影响
由图4的结果表明,当发酵培养温度为37℃时,菌株YRD-19-35产纤维素酶的效果最佳。
2.4.2.4 培养基的初始pH对发酵产酶的影响 将菌株 YRD-19-35 在不同初始 pH(6.0、7.2、8.0、9.0、10.0、12.0)的发酵产酶培养基条件下进行发酵,研究菌株的产酶情况,结果见图5。
由图5可以看出,当培养基的初始pH为8.0时,
菌株YRD-19-35所产纤维素酶的酶活力最高。
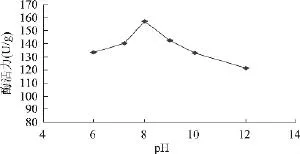
图5 pH对产酶的影响
3 结论
枯草芽孢杆菌YRD-19经过紫外诱变,选育到一株纤维素酶活力提高5.97倍的诱变菌株YRD-19-35,在最优发酵产酶条件下,纤维素酶活力最高可达到182.705U/g,比出发菌株27.213 U/g提高了6.71倍。
实验结果表明:菌株YRD-19-35适合产酶的最优培养基条件为:1.5%乳糖,1.5%蛋白胨,NaCl∶KH2PO4=5∶1,添加量为 0.55% 。在此最适培养基基础上,研究温度、pH、种子活化时间及发酵时间等因素对产酶的影响。实验结果表明:发酵温度为37℃,pH为8.0,种子活化时间为24h,发酵时间为48h,时菌株YRD-19-35产酶的酶活力达到最高。
通过产酶条件优化实验的研究发现,诱变菌株YRD-19-35诱导产酶的最佳碳源是乳糖。而之前发表过的文章多采用的是蔗糖[2],羧甲基纤维素钠[13]以及麸皮[8,12]等等,用乳糖作为纤维素酶的诱导剂还没有研究。并且与以上这三种碳源相比较,使用乳糖作为该菌株的诱导剂,酶活分别提高了7.52%、33.30%和13.75%。
[1]窦烨,王清路,李俏俏.纤维素酶的应用现状[J].中国酿造,2008(12):15-17.
[2]肖黎明,王卫卫,郭燕.1株产碱性纤维素酶软化芽孢杆菌IS-B4的选育及产酶条件的研究[J].食品与发酵工业,2008,34(5):59-62.
[3]李西波,刘胜利,王文兵.高产纤维素酶菌株的诱变选育和筛选[J].2006,25(6):107-110.
[4]陈香,蒋立建,等.紫外线诱变提高细菌产纤维素酶活力的研究[J].化学与生物工程,2008(2):45-47.
[5]施巧琴,吴松刚.工业微生物育种学[M].北京:科学出版社,2003:56-57.
[6]曾文青,刘蓉,等.纤维素酶系高产菌株的选育[J].四川省卫生管理干部学院学报,2000,19(1):4-6.
[7]范琳,牛艳芳,等.高产纤维素酶菌株的诱变选育研究[J].内蒙古师范大学学报:自然科学版,2004,23(2):195-198.
[8]杨博,黄蓉,曾晶,等.BA-25菌株碱性纤维素酶产酶条件优化研究[J].生命科学研究,2006,10(3):92-98.
[9]饲料添加剂纤维素酶活力的测定分光光度法.中华人民共和国农业行业标准——NY/T 912-2004[S].2005-01-04发布,2005-02-01实施.
[10]Lopez MJ,Carmen VM,et al.Lignocellulose degrading enzymes produced by the ascomycete Coniochaeta ligniaria and related species:Application for a lignocellulosic substrate treatment[J].Enzyme Microb Technol,2007,40:794.
[11]Hill J,Nelson E,et al.Environmental,economic,and energetic costs and benefits of biodiesel and ethanol biofuels[J].Proc Natl Acad Sci USA,2006,103:11206.
[12]钟文文.纤维素酶产生菌的选育及发酵条件优化[J].环境工程学报,2007,1(11):140-144.
[13]韩学易,陈惠,吴琦,等.产纤维素酶枯草芽孢杆菌C-36的产酶条件研究[J].四川农业大学学报,2006,24(2):178-181.
Study on the screening and fermentation of osmophilic of alkaline cellulase higher production strain Baci//us sp.YRD-19
GUI Chun-yan1,CHEN Yi-lun1,*,XIE Xiao-ping2,DONG Xin-rui2,SONG Ji2,WU Yu-shuang3,HAN Ming-qu3,DIAO Ri-ming4,ZHOU Bo2,*
(1.Institute of Food Science and Engineering,Shandong Agriculture University,Tai’an 271018,China;2.Institute of Life Sciences,Shandong Agriculture University,Tai’an 271018,China;3.Beijing Huitongda Technology Company,Beijing 100086,China;4.Tianjin Muguang Bio-Technology Company,Tianjin 300193,China)
TS201.3
A
1002-0306(2010)10-0163-05
2009-09-25 *通讯联系人
桂春燕(1984-),女,在读硕士研究生,研究方向:应用微生物。
国家科技基础条件平台微生物菌种资源整理整合项目(2005DKA21201-13);国家科技支撑计划黄淮平原区农田秸秆资源综合利用技术集成研究与示范(2007BAD89B09-16)资助。

