盐藻SOD纯化条件研究
郭金耀,杨晓玲
(淮海工学院海洋学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005)
盐藻SOD纯化条件研究
郭金耀,杨晓玲
(淮海工学院海洋学院,江苏省海洋生物技术重点实验室,江苏 连云港 222005)
为了便于对盐藻SOD的研究与利用,建立一种较好的盐藻SOD纯化方法,实验对盐藻SOD的纯化条件进行了研究。结果表明,对盐藻SOD提取液在70℃下加热20 min,取上清加入0.4倍-35℃丙酮沉淀SOD,沉淀溶解于适量的20 m M、pH 7.6 PBS缓冲液中上DEAE-52柱,用ddH2O+1.00 mol/L NaCI-0.02 mol/L PBS (pH 7.6)组合进行梯度洗脱,可有效地将盐藻提取液中的SOD与杂蛋白分离,获得近60%的SOD活力回收率,纯化倍数达到413。
盐藻;SOD;热变性;丙酮沉淀;柱层析
Abstract:In order to research and utilize SOD in Dunaliella salina,it is necessary for us to establish the method of purification the SOD in Dunaliella salina.Experiment studied treatment conditions for Purification the SOD in Dunaliella salina.Results show that under the following conditions: the SOD crude extracts heated for 20 min at 70 ℃; the supernatant liquid added acetone of 0.4 times and -35℃ was precipitated; the precipitated SOD dissolved in the 20 mM,pH 7.6 PBS buffer and separated by DEAE-52 column chromatography; adopting a method of gradient elution SOD washed with combination ddH2O+1.00mol/L NaCI-0.02 mol/L PBS (pH 7.6)from column,the SOD in Dunaliella salina can be efficiently separated and purified from its protein.The recovery rate was about 60%,and purification multiplier was as high as 413.
Key words:Dunaliella salina; superoxide dismuta; heat treatment; acetone precipitation; column chromatography
在生物机体中,超氧化物歧化酶(SOD)是自由基的主要清除者[1]。目前 SOD已较多地应用于医药、化妆品、保健品及食品中,且随着研究的深入,它的应用范围不断扩大[2]。SOD研究和应用的深度和广度已居酶类生化制剂的前列[3]。目前国际市场SOD精品售价高达3万美元/g[4]。SOD是一族含金属的酶。根据分子结构中所含有金属元素种类的不同,SOD分为Fe-SOD,Mn-SOD和Cu、Zn-SOD 3种不同的类型。SOD广泛存在于动植物、真核微生物和部分原核微生物等需氧生物细胞内[5]。对不同生物中 SOD的分离纯化存在有多种多样的方法,并已有许多报道,如陈艺虹等[6]研究了猪血 Cu、Zn-SOD的分离纯化,张沙艳[7]等研究了玉米SOD的分离及纯化,苏昕等[8]研究了酵母SOD分离纯化及其酶学性质等。但盐藻 SOD的纯化方法仍未见报道。由于盐藻具有极度耐盐性,可在饱和盐水中生存,盐藻SOD成为一种高盐适应酶[9],且活性很高[10],所以盐藻 SOD具有重要的研究利用价值。本实验对盐藻 SOD的纯化条件进行了研究,现将研究结果报道如下。
1 材料与方法
1.1 实验材料
参照郭金耀等的方法[9],将盐藻(Dunaliella salina)培养至对数生长期用于实验。
1.2 实验方法
1.2.1 盐藻 SOD 的提取方法 取盐藻培养液4 000 r/min离心15 min,收集藻细胞溶解于适量的蒸馏水中反复冻融3次,用超声波破碎20 min,然后以4 000 r/min离心20 min得上清,即为盐藻SOD的粗提取液。测定酶活和蛋白含量。
1.2.2 盐藻 SOD活性的测定方法 采用邻苯三酚自氧化法[11]。以每毫升反应液中每分钟抑制邻苯三酚自氧化速率达 50%的酶量定义为一个酶活力单位(U)。
1.2.3 盐藻蛋白质含量的测定 参照郭金耀等[12]的方法进行。
1.2.4 加热温度选择实验 试管中加入适量盐藻SOD粗提取液,分别在40、50、60、70、80 ℃水浴中加热20 min,然后4 000 r/min离心20 min,上清即为SOD粗纯化液。测定酶活和蛋白含量。
1.2.5 丙酮比例选择实验 试管中加入适量盐藻SOD粗提取液,分别加入-35℃的丙酮0.2、0.4、0.6、0.8、1.0 倍(v/v),置4℃冰箱中缓慢搅拌2 h,然后4 000 r/min离心20 min,沉淀溶解于适量的20 m M pH 7.6 PBS缓冲液中,即为SOD粗纯化液。测定酶活和蛋白含量。
1.2.6 离子交换柱层析流动相选择实验 实验在美国伯乐公司生产的Biologic DuoFlow蛋白质层析系统中进行。离子交换层析流动相为4种不同的A、B双组份洗脱液:① ddH2O+1.00mol/L NaCI-0.02 mol/L PBS (pH 7.6);② ddH2O+1.00 mol/L NaCI-0.02 mol/L Tris (pH 7.6);③ ddH2O+0.60 mol/L PBS (pH 7.6);④ ddH2O+0.02 mol/L Tris(pH 7.6)。采用阶式梯度洗脱方式进行冲洗。上样前,DEAE-52柱(1.6×25 cm)用洗脱液B液充分平衡;将经加热和丙酮处理的样品经0.45 nm微孔滤膜过虑,上样量为 3 ml。洗脱时,控制流速为1.5 ml/min,洗脱体积90 ml,并用检测器检测记录A280和A260变化动态,洗脱峰手动收集,进行酶活和蛋白含量测定。
2 结果与分析
2.1 加热温度对盐藻SOD酶学特性的影响
分别测定不同处理温度加热获得的纯化液中SOD的活力及蛋白质含量,计算SOD比活力,结果如图1。
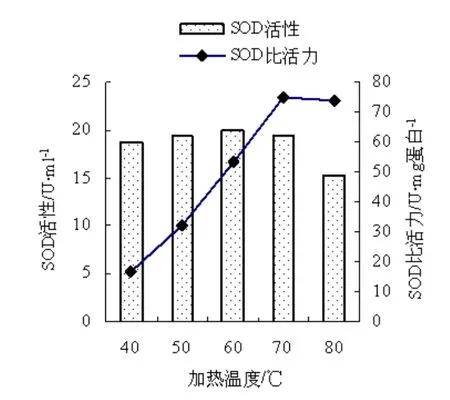
图1 温度与SOD活力及比活力的关系Fig.1 Relation between temperature and the activity and specific activity of SOD
由图 1可见,在 40-70 ℃的温度范围内加热20 min,SOD的活力几乎没有变化,仍保持在较高水平。只有当温度升高至80 ℃时,SOD活力开始明显下降。说明SOD能耐70 ℃以下的高温,在这种温度下 SOD不会变性失活。同时也可以看出,SOD的比活力随着加热温度的提高呈直线上升的趋势,到温度升至70 ℃时,SOD的比活力升至最高。当温度继续升高至80 ℃时,SOD的比活力不再增加。说明在加热的过程中,提取液中有许多的杂蛋白类发生了变性而沉淀。随着加热温度的提高,这种杂蛋白变性沉淀进一步加剧,使 SOD的比活力不断上升,即纯度逐渐增加。由此可见,对盐藻SOD提取液在70 ℃下加热20 min是提纯SOD的一个有利条件。
2.2 丙酮加入比例对盐藻SOD酶学特性的影响
分别测定加入不同比例丙酮处理获得的纯化液中SOD的活力及蛋白质含量,计算SOD比活力,结果如图2。
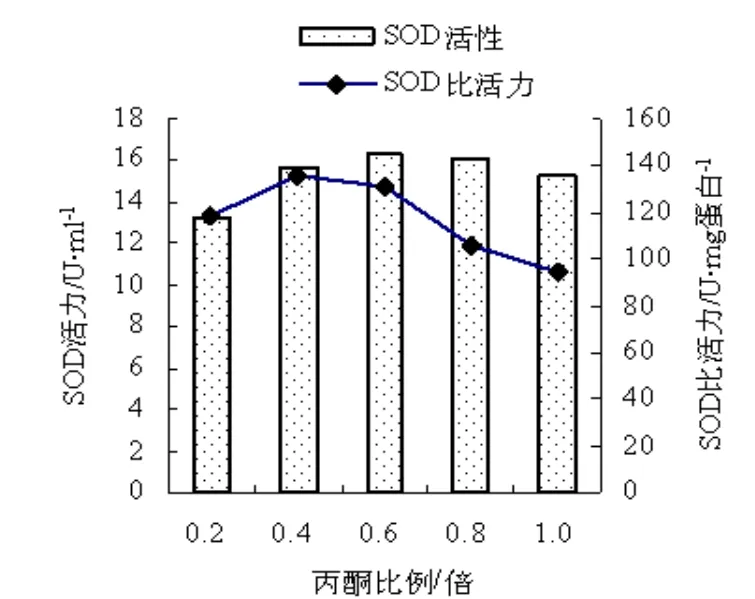
图2 丙酮比例对SOD活力及比活力影响Fig.2 Influences of the ratio of acetoned on the activity and specific activity of SOD
从图2可见,随着加入丙酮比例的增加,SOD活力也随之增加,丙酮比例增加至0.6时,SOD活力达到最大,继续增加丙酮比例至1.0时,SOD活力有所下降。说明在提取液中较多的丙酮加入对SOD的活力影响较小。但同时可见,丙酮加入比例超过0.4后,继续提高丙酮加入的比例,获得的纯化液中 SOD的比活力几乎呈现直线下降趋势。在丙酮加入比例为0.4时,SOD的比活力最高,即获得的纯化液中 SOD的纯度最高。说明在丙酮加入比例为0.4时,提取液中的杂蛋白变性沉淀较少,较少一同进入SOD沉淀中,使离心获得的SOD纯度提高,纯化液中 SOD的比活力增强。在丙酮加入比例增高时,提取液中的杂蛋白变性沉淀增多,会一同进入SOD沉淀中,使离心获得的SOD纯度降低,纯化液中SOD的比活力减小。所以,0.4倍的丙酮加入量是SOD纯化的又一个有利条件。
2.3 流动相对离子交换层析结果的影响
实验在美国伯乐公司生产的Biologic DuoFlow蛋白质层析系统中进行。离子交换层析流动相为4种不同的A、B双组份洗脱液,采用阶式梯度洗脱方式进行冲洗。洗脱结果见表1。

表1 盐藻SOD在DEAE-52柱中的梯度洗脱结果Tab.1 Results of gradient elution SOD by DEAE-52 column chromatography
由表1可知,洗脱剂B分别为单纯的PBS或Tris的梯度洗脱,没有洗脱峰出现。说明SOD不被保留,可能由于流动相中大量强阴离子与阴离子交换剂上抗衡离子紧密结合的缘故。洗脱剂B为NaCI-Tris的梯度洗脱,在洗脱进行至72.25 min时出现1个洗脱峰,其余时间段都没有洗脱峰出现。说明SOD与杂蛋白分不开。洗脱剂B为NaCI- PBS的梯度洗脱,在洗脱进行至64.00 min和75.09 min时分别出现1个洗脱峰,两峰完全分开。说明SOD得到了较好的分离。所以,盐藻SOD在DEAE-52柱上的梯度洗脱中,最佳洗脱剂为ddH2O+1.00 mol/L NaCI-0.02 mol/L PBS (pH 7.6)组合。
2.4 盐藻SOD的分离纯化结果
对盐藻SOD提取液在70℃下加热20 min,取上清加入0.4倍-35℃丙酮沉淀SOD,制成SOD柱层析上样溶液,在美国伯乐公司生产的Biologic DuoFlow蛋白质层析系统中上DEAE-52柱,用
ddH2O+1.00 mol/L NaCI-0.02 mol/L PBS (pH 7.6)组合进行梯度洗脱,测定分析每一分离纯化阶段中的SOD活力、蛋白质含量和SOD比活力。实验结果见表2。
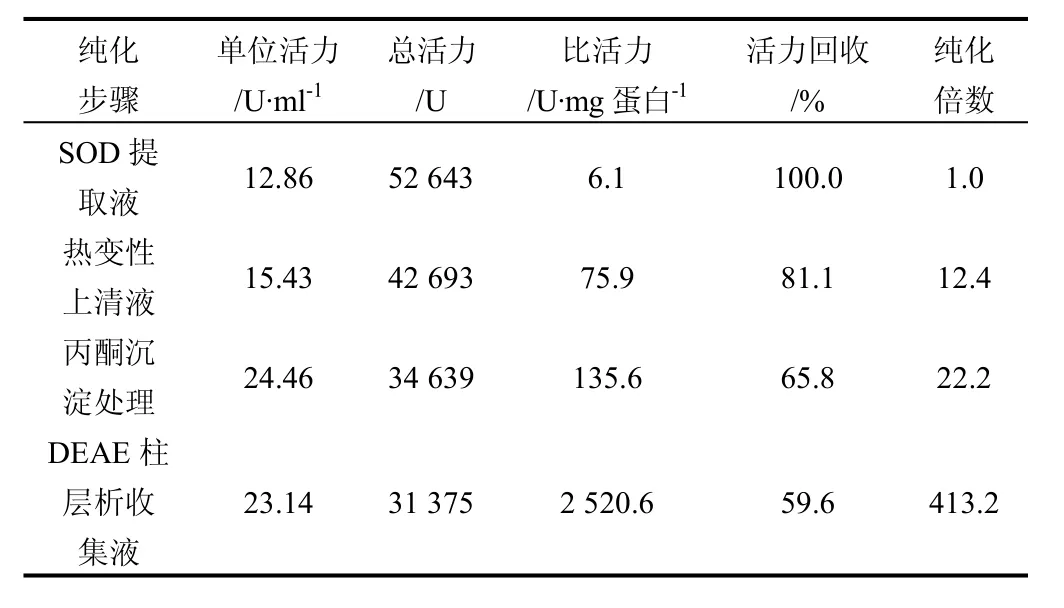
表2 盐藻SOD的分离纯化结果Tab.2 Results of separation and purification of SOD in Dunaliella salina
由表2可见,盐藻SOD提取液经过热变性、丙酮沉淀和DEAE柱层析的处理过程,SOD的总活力有一定的损失,但比活力显著提高,活力回收率达到近60%,纯化倍数提高至413。说明这一盐藻SOD的纯化过程,有效地将盐藻提取液中的 SOD与杂蛋白分离,可形成具有较高纯度的 SOD纯化产品,为盐藻 SOD的进一步研究与利用奠定了基础——建立了一种较好的盐藻SOD纯化技术方法。
3 讨论与小结
盐藻SOD具有耐高温的特性。对盐藻SOD纯化时,可以通过加热使提取液中的其它蛋白发生变性沉淀而与 SOD分离。实验中,通过 70℃加热20 min的处理,使SOD的比活力提高了12.4倍,有效地去除了提取液中的其它蛋白质。所以对提取液70℃加热20 min是提纯SOD非常便利而又有效的一项操作处理。
SOD与提取液中其它蛋白在丙酮中的溶解性存在较大差异,可以利用丙酮加入的不同比例来提纯SOD。实验中,对加热处理后的SOD溶液再加入0.4倍的丙酮时,纯化效果最好。这是纯化SOD的第二项好的操作。
纯化SOD的第三项有效操作是DEAE柱层析。这项操作需要一定的设备条件,并且不同的洗脱液洗脱会获得不同的结果。实验中比较了4种双组份洗脱液的效果,结果表明 ddH2O+1.00 mol/L NaCI-0.02 mol/L PBS (pH 7.6)组合为最佳,它可使SOD比活力比提取液提高413倍。这项操作为盐藻SOD的分子特性研究奠定了基础。
[1]许平.芦荟超氧化物歧化酶(SOD)的分离纯化研究 [J].重庆工商大学学报(自然科学版),2007,24(1): 22 – 24.
[2]李宏,单振秀,王宜林,等.红酵母提取 SOD 的研究 [J].食品科学(工艺技术版),2003,24 (12): 81 - 84.
[3]黎瑞珍,扬庆建,陈贻锐.超氧化物歧化酶(SOD)活性的测定及其应用研究 [J].琼州大学学报,2004,11(5): 34- 36.
[4]陈莉,申小蓉,赵红洋,等.佛甲草中 SOD 提取条件的优化[J].草原与草坪,2009(1): 1-6.
[5]高建华,郭艳翔,刘佳宾,等.杏鲍菇菌丝体中SOD提取方法研究 [J].食品科学(食用菌版),2007(2): 79 - 80.
[6]陈艺虹,张志群,王兰,等.猪血 Cu、Zn-SOD 的分离纯化 [J].微生物学杂志,2004,24(2): 58-59.
[7]张沙艳,高成华.玉米超氧化物歧化酶(SOD)的分离及纯化 [J].沈阳师范大学学报(自然科学版),2006,24(2): 231-233.
[8]苏昕,阎浩林,梁丽莉.酵母SOD分离纯化及其酶学性质的研究[J].沈阳药科大学学报,2005,22(1): 67-70.
[9]郭金耀,杨晓玲.盐藻 SOD 的盐适应性与物质积累的关系 [J].海洋通报,2008,27(4): 59-62.
[10]陶明煊,吴国荣,魏锦城.蓝、绿藻 SOD 同工酶类型及其进化[J].南京师大学报(自然科学版),1999,22(4): 93-97.
[11]张中林,孙宏伟,郑剑玲,等.邻苯三酚法测定 3种食用菌超氧化物歧化酶(SOD)活性 [J].辽宁中医药大学学报,2009,11(5):185-186.
[12]郭金耀,杨晓玲.锰对盐藻生长与物质积累的调控作用 [J].水产科学,2008,27(3): 148-150.
Research of treatment conditions for purification superoxide dismutase in Dunaliella salina
GUO Jin-yao,YANG Xiao-ling
(Key Construction Lab of Marine Biotechnology of Jiangsu Province,School of Marine Science and Technology,Huaihai Institute of Technology,Lianyungang 222005,China)
Q554; Q94921+2
A
1001-6932(2010)04-0417-04
2009-09-09;
2009-12-11
江苏省海洋生物技术重点实验室开放课题项目(HS08010),淮海工学院自然科学基金(Z2007033)
郭金耀(1956-),男,教授,现从事海洋藻类生理学研究。电子邮箱:gjyao6688@yahoo.com.cn

