GnRH-A免疫与母兔生殖激素浓度的变化
魏锁成,巩转娣,韦敏,赵兴绪
(1.甘肃农业大学动物医学院,兰州730070;2.西北民族大学生命科学与工程学院,兰州 730030; 3.西北民族大学医学院,兰州 730030)
研究报告
GnRH-A免疫与母兔生殖激素浓度的变化
魏锁成1,2,巩转娣3,韦敏2,赵兴绪1
(1.甘肃农业大学动物医学院,兰州730070;2.西北民族大学生命科学与工程学院,兰州 730030; 3.西北民族大学医学院,兰州 730030)
目的探讨促性腺激素释放激素类似物(GnRH-A)对动物生殖功能调节的效果和作用机制。方法
24只日本大耳白兔分为四组,分别在实验Ⅰ组(EG-I)、实验Ⅱ组(EG-II)和实验III(EG-III)组兔的颈背侧注射1.0 m L(100、100和50 μg/m L)GnRH-A抗原,实验II组和实验III组于第3周以原剂量加强注射一次,用ELISA法测定血清GnRH抗体效价、促卵泡刺激素(FSH)和促黄体生成素(LH)含量。结果注射GnRH-A后10 d实验组兔均出现GnRH抗体,而对照组未检测到;EG-I在第30天达到高峰,而EG-II和EG-III于40~50 d至峰值,但在实验结束时(70 d)实验组均高于对照组,40~70 d时EG-II显著高于EG-I和EG-III。30~50 d时EG-II的LH明显高于EG-I和EG-III及对照组。EG-II和EG-III的FSH浓度在40 d达到峰值,但EG-II高于EG-I、对照组及EG-III,EG-I和对照组无显著差异。结论兔体内注射GnRH-A可以明显提高GnRH抗体效价,增强LH和FSH的合成与分泌,加强注射效果更明显,且与注射剂量相关,持续时间为40 d左右。
促性腺激素释放激素类似物;促卵泡刺激素;促黄体生成素;母兔
促性腺激素释放激素(GnRH)由丘脑下部释放后与垂体前叶的促性腺激素分泌细胞(嗜碱性细胞)细胞膜上的特异受体结合,通过激活腺苷酸环化酶-cAMP-蛋白质酶体系,促进促黄体生成素(LH)和促卵泡刺激素(FSH)的合成与释放,但是,LH和FSH对GnRH的作用有所不同。促性腺激素释放激素类似物(GnRH-A)是在天然的GnRH分子结构上替换了第6、10位上的氨基酸所得,GnRH-A与GnRH具有十分相近的作用,然而,这种结构的改变可减慢肽的降解,延长半衰期,使受体结合力增强100~200倍[1,2]。
Martemucci等[3]和Herman等均报道,GnRH主动免疫引起血浆LH水平急剧降低,而FSH只有轻度降低。有人给大鼠、兔、绵羊等动物快速静脉注射GnRH及GnRH-A时,主要引起血浆LH水平明显升高,但是用相同剂量的GnRH缓慢注射时,不但使LH水平升高,而且FSH水平也明显升高。此外,近年来国内外广泛应用GnRH及GnRH-A来提高家畜繁殖性能,取得了良好的效果,认为GnRH及GnRH-A可诱发母畜排卵、提高受胎率。如配种前给母畜肌肉注射GnRH-A,可诱发母畜排卵,提高受胎率;分娩后早期用GnRH处理可加速牛的发情排卵、子宫复旧、缩短产犊间隔。Phatak等、马玉林等[4]对羊的实验表明,注射一定剂量的GnRH及类似物,能有效的提高其受胎率12%~15%。适量GnRH-A通过下丘脑-垂体-卵巢轴,引起垂体释放LH和FSH[5]。因而,GnRH-A注射后对动物生殖功能与性腺激素的合成及分泌究竟有何作用? GnRH-A的注射剂量多少为宜?GnRH的抗体效价如何变化?作用的维持时间多长?下丘脑及垂体的组织结构是否改变等等问题需进一步深入探讨。为此,我们在前期研究的基础上,对日本大耳白兔的GnRH-A进行了生殖免疫调节实验研究,以期为科学应用GnRH-A调控母畜的生殖机能提供依据,并探讨GnRH-A的作用机制和临床推广价值。
1 材料与方法
1.1 主要试剂
GnRH-A,Zillion公司生产,纯度(HPLC)≥98.99%;碳二亚胺盐酸盐(EDC.HCL),上海延长生化科技发展有限公司生产,纯度(HPLC)≥99.23%;牛血清白蛋白(BSA)和弗氏不完全佐剂,美国Sigma公司生产;二抗为辣根过氧化物酶标记的羊抗兔血清,博大泰克生产;促卵泡激素检测试剂盒(ELISA)、促黄体激素检测试剂盒(ELISA),北京北方生物技术研究所提供,96孔板。
1.2 主要仪器
TQ16-W型高速离心机(长沙湘仪),透析带(Solarbio公司),96孔酶标板(博大泰克),Multiskan MK3型酶标仪(Thermo公司),分析天平等。
1.3 实验动物
3月龄健康日本大耳白兔(Oryctolagus cuniculus)24只,雌性,体质量2.2~2.6 kg,购于兰州生物制品研究所实验动物中心(编号:2006-033),随机分为4组,实验Ⅰ组(EG-I)、实验II组(EG-II)、实验Ⅲ组(EG-III)和空白对照组(CG),每组6只。所用兔均分笼饲养,自由饮食。预饲10 d后进行正式实验,按实验动物使用的3R原则给予人道关怀。
1.4 抗原制备
以碳二亚胺盐酸盐(EDC.HCL)为偶合剂,将GnRH-A与牛血清白蛋白(BSA)连接为复合物,再加入弗氏不完全佐剂制成抗原乳剂。利用紫外吸收法求出GnRH-A的结合率为85%。并按参考文献[6]进行无菌性、安全性和物理性状检验。
1.5 免疫注射方法
在实验Ⅰ组(EG-I)、实验Ⅱ组(EG-II)、实验Ⅲ组(EG-III)每只兔的颈背部皮下注射1.0 mL(100、100和50 μg/m L)GnRH-A抗原。EG-II和EG-III组于3周后分别用相同剂量与方法加强免疫一次。对照组(CG)不做任何处理。免疫注射当天记为d0。
1.6 血样采集
每只兔于注射GnRH-A抗原前1 d、注射后10、20、30、40、50、60和70 d分别从颈静脉采血10 mL,采集的血液立即37℃水浴30 m in,2500~3000 r/ min离心10~12 m in,分离血清,-20℃保存。采血前禁食12 h。
1.7 检测项目
1.7.1 GnRH抗体效价测定:用间接ELISA法测定[7]。
1.7.2 血清FSH和LH浓度测定:用血清促卵泡激素(FSH)诊断试剂盒和血清促黄体激素(LH)诊断试剂盒(ELISA法)测定。具体操作步骤如下:①设空白孔、标准品孔、待测样品孔。每个标准品孔加入标准液50 μL,待测样品孔加血清50 μL。②每孔加FITC标记抗体50 μL,充分混匀,37℃孵育60 m in。空白孔不加任何液体。③弃去液体,每孔加洗涤液,静置10 s,重复3次拍干。④每孔加入酶结合物,充分混匀,37℃孵育30 min。⑤加显色剂A液和B液各50 μL,振荡混匀,37℃避光显色15 m in。⑥每孔加终止溶液50 μL。⑦用酶标仪在450 nm波长测量各孔的吸光度(A值)。
1.8 数据统计学分析
以Spss13.0统计学软件处理数据,用平均值±标准差(±s)表示,t检验进行显著性检验。
2 结果
2.1 抗原包被浓度及血清最佳工作浓度结果
当抗原稀释800倍和血清稀释100倍时,其A490为0.987,最接近1,所以抗原最佳浓度为1∶800倍稀释,血清的最佳浓度为1∶100倍稀释[7]。
2.2 GnRH抗体效价见表1。
表1 血清GnRH抗体效价测定值(±s)Tab.1 Determination of serum GnRH antibody titer in the immunized rabbits(±s)

表1 血清GnRH抗体效价测定值(±s)Tab.1 Determination of serum GnRH antibody titer in the immunized rabbits(±s)
注:同一列中,标肩字母相同表示差异无显著性(P>0.05);标肩不同表示差异有显著性(P<0.05),其中标肩字母相连(如ab,bc等)表示差异有显著性(P<0.05),标肩字母间有间隔(如ac,bd等)表示差异有显著性(P<0.01)。下同。Notes:The same superscript letters in the same column mean that there was no significant difference(P>0.05).The different superscript letters mean that there was a significant difference between groups,of which ad jacent superscripts(such as ab)indicate that the difference was significant(P<0.05),while interval superscripts(such as ac,bd)show that the difference was highly significant(P<0.01).The same as in the following tables.
组别Group免疫时间(d)Immunization time(d) 0 10 20 30 40 50 60 70 EG-I 0 200 400a800a400c200c100c100 EG-II 0 200 400a800a1600a1600a800a400 EG-III 0 100 200b400b800b800b400b200 Control 0 0 0c0c0d0d0c0
由表1可以得出,EG-I、EG-II和EG-III在注射GnRH-A后10 d均出现GnRH抗体,对照组未检测到GnRH抗体,实验组始终高于对照组;在第10~30天时EG-I和EG-II组抗体效价相同,但显著高于EG-III(P<0.05)及对照组(P<0.01);EG-I在第30天达到高峰,而EG-II和EG-III于40~50 d至峰值,然后抗体效价开始下降,但在实验结束时(70 d) 3个实验组仍高于对照组(P<0.05);40~70 d时EG-II显著高于EG-I和EG-III(P<0.01)。表明兔体内注射GnRH-A可以明显提高GnRH抗体效价,加强注射效果更明显,其持续时间为40 d左右。
2.3 血清LH浓度测定值见图1。
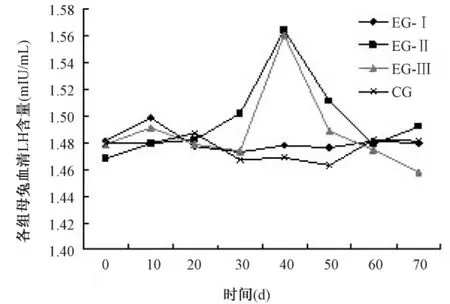
图1 兔血清LH浓度的变化Fig.1 Changes of serum luteinizing hormone concentration in the female rabbits
由图1得出,EG-I的LH除注射后10 d略升高外,始终保持稳定,这与对照组基本相同;EG-II和EG-III的LH均在注射后40 d至峰值(P<0.05),此后降低。30~50 d时EG-II明显高于EG-I和EG-III及对照组,也高于注射前水平。证明加强注射GnRH-A可以增强LH的合成与分泌,而且与注射的剂量相关。
2.4 血清FSH浓度的测定值见表2。
从表2得出,EG-II和EG-III的FSH浓度在注射后30 d开始升高,至40 d达到峰值,EG-II明显高于EG-I和对照组(P<0.01)及EG-III(P<0.05),EG-III也高于EG-I和对照组(P<0.05);整个实验期间EG-I和对照组差异无显著性。表明加强注射GnRH-A可以增强FSH的合成与分泌,而且注射剂量大作用更明显。
3 讨论
GnRH由丘脑下部合成,并以脉冲方式分泌进入垂体门脉系统,到达垂体前叶发挥诱导促性腺激素释放的作用,调节垂体LH/FSH的合成与释放[8,9]。GnRH与具有免疫原性的大分子蛋白载体偶联后免疫动物,可诱导体内产生特异性抗GnRH的抗体。Adams等[10]用钥孔威血蓝蛋白(keyhole limper hemocyain,KLH)与GnRH偶联对小公牛进行免疫,20周后抗体效价达到最高值,Esbenshade等[11]用GnRH免疫母猪,也发现抗体效价在第15周达到最高。本实验表明GnRH-A注射兔后10d实验组血清中均可检测到GnRH抗体,GnRH抗体在30 d左右达到高峰,其中EG-I、EG-II和EG-III的GnRH效价分别为为1∶800、1∶800和1∶400,EG-II (100 μg/m L加强组)在50 d时仍高达1∶1600,说明GnRH抗体效价有一定的持续时间,且与注射剂量密切相关,这与Bambino的结论相吻合。因此,为了更好的维持抗体高水平,加强免疫是必要。
表2 母兔血清FSH测定值(±s,m IU/m L)Tab.2 The concentration of serum follicle-stimulating hormone in the female rabbits(Unit:m IU/mL)
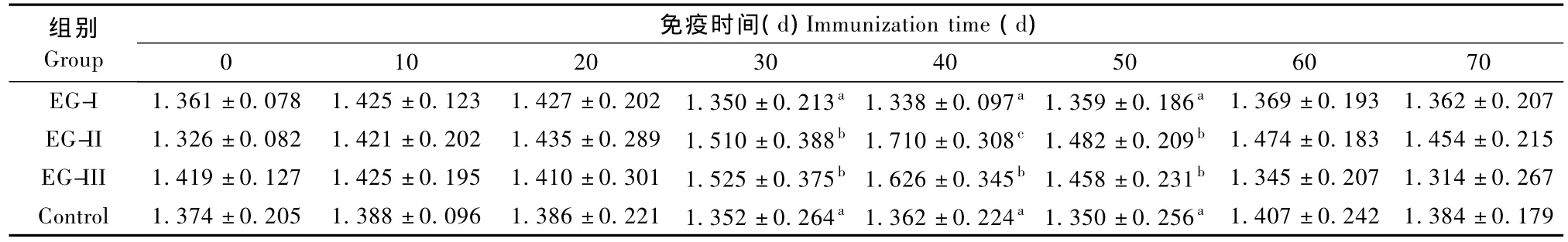
表2 母兔血清FSH测定值(±s,m IU/m L)Tab.2 The concentration of serum follicle-stimulating hormone in the female rabbits(Unit:m IU/mL)
组别Group免疫时间(d)Immunization time(d) 0 10 20 30 40 50 60 70 EG-I 1.361±0.078 1.425±0.123 1.427±0.202 1.350±0.213a1.338±0.097a1.359±0.186a1.369±0.193 1.362±0.207 EG-II 1.326±0.082 1.421±0.202 1.435±0.289 1.510±0.388b1.710±0.308c1.482±0.209b1.474±0.183 1.454±0.215 EG-III 1.419±0.127 1.425±0.195 1.410±0.301 1.525±0.375b1.626±0.345b1.458±0.231b1.345±0.207 1.314±0.267 Control 1.374±0.205 1.388±0.096 1.386±0.221 1.352±0.264a1.362±0.224a1.350±0.256a1.407±0.242 1.384±0.179
GnRH抗体可特异地中和动物体内的GnRH,从而影响到与GnRH有关的LH和FSH等激素的合成与分泌,使动物正常的生殖性能发生改变。GnRH不但可通过影响垂体LH和FSH的分泌,而且还直接作用于性腺,调节性腺功能。GnRH主要是降低性腺上的LH受体的数量而不改变受体的亲和力。GnRH免疫由于引起垂体促性腺激素尤其是LH水平的下降,将导致性腺、性激素的变化,最终导致生育力的降低甚至丧失[12]。Esbenshade等[11]用GnRH免疫母猪后血清中LH浓度在12周降到不可测的水平,这些研究结果表明GnRH免疫动物后,对内源性LH和FSH的合成与分泌有特异性抑制作用。Clarke等[13]用GnRH免疫公羊和母羊,经检测免疫动物外用血液中LH和FSH水平,与对照组相比明显降低。然而,叶联顺[14]用尿促性腺激素(HMG)加HcG对6~12月龄的新西兰母兔进行超排处理,测定超排前后不同时期血清FSH、LH和P (孕激素)的浓度,结果表明FSH和LH分别在超排后96 h和15 h达高峰水平,证明家兔超排后生殖内分泌激素有显著性变化。由此可见,排卵前后血清生殖激素的浓度是不相同的。本实验证明给兔在第3周强化免疫后LH和FSH水平增加,表现为EG-II的LH在30~50 d明显高于EG-I和EG-III及对照组,也高于注射前水平,而EG-I和对照组无显著差异;FSH浓度的变化与LH基本相同,EG-II和EGIII的FSH浓度在注射后30 d开始升高,至40 d达到峰值,EG-II明显高于EG-I和对照组及EG-III。这是否与本实验中的兔有排卵以及注射GnRH-A的剂量或次数有关尚待深入探讨。
另外,一些体外实验证实,垂体细胞受GnRH刺激时,LH和FSH的最大分泌量和基础分泌量不同,LH的比率比FSH高,因此LH分泌量的变化幅度比FSH的大,本实验也基本证明了这一点[15]。
[1]Chabbert-Buffet N.GnRH antagonists[J].Clin Obster Gynecol 2003,46(2):254-264.
[2]郭红宇,高云荷.GnRH类似物的研究进展[J].中国实用妇科与产科杂志,2005;21(11):6-12.
[3]Martemucci G.Effect of CnRH on Conception rate in repeatbreeder dairy cows.Anim Breed Abst.1984,(53):1-245.
[4]马玉林.应用LRH-A提高青海高原毛肉兼川半细毛羊受胎率的试验[J].青海畜牧兽医杂志.1998,28(2):5-6.
[5]吴结革,茹达.GnRH及其类似物在动物繁殖中的应用[J].南京农专学报.2000,16(3):48-51.
[6]王君伟.兽医生物制品的质量检验,兽医生物制品的质量管理和控制[M].中国农业出版社.2002:181-186.
[7]魏锁成,张剑.GnRH-A免疫去势对兔血清睾酮和血液细胞的作用[J].中国实验动物学报.2009,17(1):45-49.
[8]赵兴绪.兽医产科学[M].第3版.北京:中国农业出版社. 2002:66-90.
[9]魏锁成.动物免疫去势的基本原理及其应用[J].西北民族大学学报,2006,17(2):49-53.
[10]Adams TE,Adams BM.Feedlot performance of steers and bulls actively immunized against gonadotropin releasing hormone[J].J Animal Sci,1992,70(6):1691-1698.
[11]Eshcnshade KL.Active immunization of gilts against gonadotropin-releasing hormone[J].Biol Reprod.1985,(33): 569-577.
[12]杨仕群.GnRH免疫及其在畜牧业上的应用[J].四川畜牧兽医.2004,31(1):35-38.
[13]Clarke IJ,Brown BW,Tran VV,et al.Neonatal immunization against gonadotropin-releasing hormone(GnRH)results in diminished GnRH secretion in adulthood[J].Endocrinology. 1998,139(4):2007-2014.
[14]叶联顺,吕静,计垣,等.新西兰大耳自兔超排前后生殖内分泌激素变化的研究[J].西南师范大学学报(自然科学版),2003,28(5):805-807.
[15]Bambino TH,Schreiber JR,Hsueh AJ.Gonadotropin-releasing hormone and its agonist inhibit testicular luteinizing hormone receptor and steroidogenesis in immature and adult hypophysectomized rats[J].Endocrinology.1980,(107):908-914.
GnRH-A Imm unization and the Changes of Reproductive Horm one Concentration in Fem ale Rabbits
WEI Suo-cheng1,2,GONG Zhuan-di3,WEI M in2,ZHAO Xing-xu1
(1.Gansu Agriculture University,Lanzhou 730070;2.Life Science and Engineering College; 3.Medical College,Northwest University for Nationalities,Lanzhou 730030,China)
ObjectiveThe objective of this study was to investigate the efficacy and mechanisms of reproductive function immunological regulation by injecting gonadotropin releasing hormone analogue(GnRH-A)in animals.M ethods
24 female rabbits were divided random ly into four groups,namely experimental group 1(EG-I),experimental group 2 (EG-II),experimental group 3(EG-III)and control group(CG).The experimental groups were injected with GnRH-A antigen 1.0 m L at different doses(100 μg/m L,100 μg/m L and 50 μg/m L),respectively,and the rabbits of EG-II and EG-III groups were re-injected at the original doses at the third week.Serum GnRH antibody titer,follicle-stimulating hormone(FSH)and luteinizing hormone(LH)concentrations were determined by ELISA.ResultsSerum GnRH antibody titers were detected in three experimental groups after 10 d of injecting GnRH-A,but not in the control group.The antibody titers of EG-I,EG-Ⅱand EG-Ⅲreached a peak level on d30 and d40~d50,respectively.The antibody titers of EG-II were higher than that of EG-I and EG-III(P<0.01)during the period from 40 days to 70 days.LH concentration of EG-II exceeded other groups at 30 d-50 d.FSH concentrations of EG-II and EG-III reached the peak on 40 d,EG-II FSH was higher than other groups(P<0.05).There was no significant difference between EG-Iand CG.ConlusionInjecting GnRH-A to rabbits may apparently improve GnRH antibody titer,enhance LH and FSH synthesis and secretion. Strengthening injection is more effective,lasting for about 40 days,and is related with the injecting dosage.
Gonadotropin;Releasing hormone analogues-A(GnRH-A);Luteinizing hormone;Folliclestimulating hormone;Female rabbit
S852.2
A
1005-4847(2010)03-0247-04
2009-09-27
国家民委2007年度重点资助项目(编号:MW 2007-ZD-027)。
魏锁成(1962-),男,教授,研究方向:动物医学和动物生殖生物技术。E-mail:weisc668@163.com
赵兴绪E-mail:zhaoxx@gsau.edu.cn

