三个品种豚鼠血液蛋白多态性的比较分析
蔡月琴,赵伟春,宋见惠,陈民利,叶丽,徐孝平,吴尉,张利棕
(1.浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053;
2.浙江中医药大学生物工程学院,杭州 310053;3.浙江大学医学院实验动物中心,杭州 310058)
研究报告
三个品种豚鼠血液蛋白多态性的比较分析
蔡月琴1,赵伟春2,宋见惠3,陈民利1,叶丽2,徐孝平1,吴尉1,张利棕1
(1.浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053;
2.浙江中医药大学生物工程学院,杭州 310053;3.浙江大学医学院实验动物中心,杭州 310058)
目的比较分析白毛黑眼(WHBE)豚鼠和DHP豚鼠、花色豚鼠三个品种豚鼠在13个血液蛋白位点上的多态性。方法采用垂直板浓度和pH均不连续的聚丙烯酰胺凝胶电泳法对WHBE豚鼠、DHP豚鼠和花色豚鼠的66只个体的后白蛋白(Po)、前转铁蛋白1(Prt1)、前转铁蛋白2(Prt2)、转铁蛋白1(Tf1)、转铁蛋白2(Tf2)、后转铁蛋白(Ptf)、慢α球蛋白(Sag)、红细胞酯酶(Es)、血清酯酶1(Est1)、血清酯酶3(Est3)、血红蛋白α(Hbα)、血红蛋白β(Hbβ)和白蛋白(Alb)共13个蛋白位点进行了电泳及染色,再利用电泳图谱对各蛋白位点基因频率、平均杂合度和遗传距离进行计算,然后结合聚类分析。结果Tf1、Tf2、Ptf、Est1和Es在三个豚鼠品种中表现为多态,其中Tf1可作为识别WHBE豚鼠的遗传标记。Po、Prt1、Prt2、Sag、Est3、Hbα、Hbβ和Alb等位点在三个豚鼠品种中的表型一致。Hardy-Weinberg平衡状态分析表明,Es为DHP豚鼠的高度不平衡位点。Ptf为花色豚鼠的高度不平衡位点。在WHBE豚鼠中,Tf1为高度不平衡位点,Est1为不平衡位点。在三个豚鼠品种中,所检测的13个蛋白位点的平均杂合度的排列顺序为:花色豚鼠(0.350 1)>WHBE豚鼠(0.339 0)>DHP豚鼠(0.313 5)。聚类分析结果表明,花色豚鼠和WHBE豚鼠的遗传遗传距离最近(0.064 3),DHP豚鼠与花色豚鼠的遗传距离最远(0.179 2)。结论利用这些蛋白位点可以有效鉴别WHBE豚鼠、DHP豚鼠和花色豚鼠血液蛋白的遗传多态性。
豚鼠;血液蛋白多态性;基因频率;杂合度;遗传距离
血液蛋白遗传多态性是指功能相同的血液蛋白质存在两种或两种以上的遗传变异体,可以作为一个遗传标记因子,来反映动物的遗传变异情况,且血液蛋白基因型严格按照孟德尔遗传方式传递,并且能保持终身不变,不受环境影响,不存在性别间差异。由于不同品种间不同位点的血液蛋白具有一定差异性,因此可从其表型判断基因型,计算基因频率、遗传距离、遗传相似性系数,进行聚类分析,通过对遗传多态性的研究将有助于了解群体遗传背景与遗传特征,也可以作为遗传标记为定向选育提供重要的依据[1,2]。
豚鼠作为实验动物被广泛地应用于各个医学和药学的研究领域,随着生物医药科技及其产业的发展,豚鼠使用量在不断增加,在实验动物应用量上占第4位。目前,对豚鼠解剖学、行为学和生理生化等方面的研究已经比较成熟,相对而言豚鼠血液蛋白方面的研究较少。刘迪文等[3]采用生化电泳法测定了Zmu-1:DHP育成品系豚鼠14个同工酶的遗传标记,其中4个位点在Zmu-1:DHP豚鼠中呈多态性。傅军[4]对Zmu-1:DHP品系豚鼠和Hartley品系豚鼠的血清蛋白质进行SDS-聚丙烯酰胺凝胶电泳测定,结果显示Zmu-1:DHP豚鼠的血清蛋白可分辨出21条蛋白区带,而Hartley品系豚鼠有20条蛋白区带,表明两品系豚鼠血清蛋白组成上有差异。目前国内正在培育和使用的实验豚鼠主要为DHP豚鼠和花色豚鼠(英国种豚鼠),本中心研究人员于2004年2月在实验用豚鼠生产群中发现了两只白毛黑眼豚鼠后,通过与DHP豚鼠或花色豚鼠交配培育而建立的一个新实验豚鼠种群,暂命名为白毛黑眼豚鼠(WHBE豚鼠),目前正处于WHBE豚鼠封闭群的培育过程中。本文以WHBE豚鼠、DHP豚鼠和花色豚鼠为对象,研究三个品种血液蛋白的遗传多态性,旨在揭示这三个品种的群体遗传结构,探寻利用血液蛋白多态性作为遗传标记的可能性,为豚鼠的进一步选育提高提供科学的依据。
1 材料与方法
1.1 实验动物
DHP豚鼠30只,花色豚鼠20只,WHBE豚鼠16只,来源于浙江中医药大学实验豚鼠生产基地【SCXK(浙)2008-0037】。
1.2 样品制备
每只豚鼠自心脏采集血样2 mL,其中1 m L血样加入至肝素抗凝管中,反复倒置,使抗凝剂与血液混匀,离心(3000 r/m in,10 m in,4℃),弃上层血浆,用10倍于红细胞压积的生理盐水洗涤3次,最后取洗涤过的红细胞0.5 m L于离心管中,并加等体积的蒸馏水,震荡使红细胞破裂溶血,制成红细胞溶血液,于-20℃冰箱中保存;剩余的血样置不加抗凝剂的离心管中,离心(3000 r/m in,10 m in,4℃),分离出血清,于-20℃冰箱中保存。
1.3 电泳测定
1.3.1 Po、Prt1、Prt2、Tf1、Tf2、Ptf和Sag的电泳测定:采用Tris-甘氨酸系统,分离胶缓冲液Tris-HCl (pH 8.9),浓缩胶缓冲液Tris-HCl(pH 6.7),电极缓冲液Tris-甘氨酸(pH 8.3),浓缩胶浓度为3.5%,交联度为20%,分离胶浓度为12%。各位点的电泳步骤均按丁美方等[5]介绍的方法进行测定。
1.3.2 Hb和A lb的电泳测定:采用Tris-甘氨酸系统,浓缩胶浓度为3.5%,交联度为20%,分离胶浓度为8%,交联度为4%。其中检测Hb时,将2倍稀释的红细胞溶血液再作5倍稀释,制成10%的溶血液;检测A lb时,将血清作10倍稀释。
1.3.3 红细胞酯酶(Es)、血清酯酶(Est)电泳测定:采用Tris-硼酸-柠檬酸系统,浓缩胶浓度为3.5%,交联度为20%,分离胶浓度为8%。电泳于4℃冰箱中进行,上样前预先电泳15 m in,起始电压150 V,待样品进入分离胶后电压调至350 V,电泳时间为4 h。
1.4 判型及统计分析
1.4.1 判型标准:基因型的命名按照各组分在电场中向阳极迁移速度的快慢来确定,基因符号用A、B、C等字母表示。各等位基因及表型识别均参考Grunder[6,7]、Juneja[8]、Arana[9]和Bellen等[10]的标准。
1.4.2 基因型频率及基因频率的计算:对于遗传方式清楚的蛋白位点,由于其等位基因呈共显性遗传,因此,表型频率即基因型频率。根据表型频率,采用基因计数法即可计算出基因频率。
1.4.3 Hardy-Weinberg平衡的检验:根据基因型频率实际观测值计算理论值,并用X2适合性检验比较实际值与理论值的差异,检验二者的差异是否显著,了解群体的基因频率是否符合Hardy-Weinberg平衡定律。
1.4.4 平均杂合度及有效等位基因数的计算:
P:某一位点第i个等位基因的频率,h:某多态位点的杂合度,r:观测到的多态位点个数
1.4.5 遗传距离:采用奈氏遗传距离(Nei,1978)[11],由下式计算:
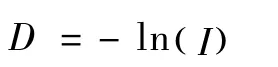
其中ln为自然对数,I为两群体间的遗传相似系数。
遗传相似系数由下式计算:
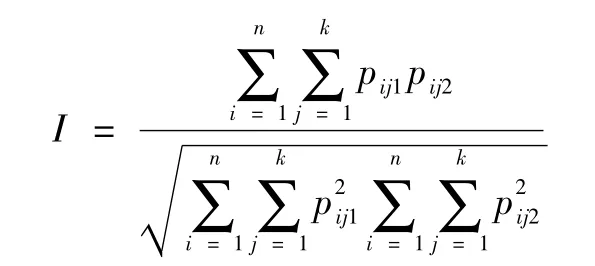
其中n为基因位点的个数,k为第n个基因位点等位基因的数目,Pij1、Pij2分别为群体1和群体2在第n个位点第k个等位基因的频率。
2 结果与分析
2.1 13个蛋白位点的电泳图谱和基因型频率及基因频率分析
豚鼠Po、Prt1、Prt2、Tf1、Tf2、Ptf和Sag的电泳图谱见图1A。由图1A可知,Po、Prt1、Prt2和Sag在DHP豚鼠、花色豚鼠和WHBE豚鼠中均表现为一种表型。Po、Prt1和Sag均有两个条带,即AB型,未检测到AA和BB型,Prt2只有一个条带,即AA型。Tf1位点在三个豚鼠品种中均呈现多态(表1),DHP豚鼠有BB和BC两种表型,花色豚鼠只有BC一种表型,WHBE豚鼠也有两种表型,但与DHP豚鼠不同,为AB和AC两种表型。Tf2位点亦呈现多态(表1),在DHP豚鼠、花色豚鼠和WHBE豚鼠中均表现为AA、BB和AB三种表型。Ptf在凝胶上的位置距离Tf很近,且染色较浅(图1A),Ptf位点在DHP豚鼠和WHBE豚鼠中只有BB型,而花色豚鼠除了BB型外,还有AA型(表1)。
Est-1在DHP豚鼠和花色豚鼠均有三种表型AC、BC和CC,受一个位点上三个共显性等位基因的控制;而在WHBE豚鼠中却只有两种表型AC和BC(见图1B和表1)。由图1B可知,Est-3在三个豚鼠品种中均检测到三个条带,且表型一致。Es的电泳结果见图1C,除了DHP豚鼠有两个样品表现为AA型以外,其它样品均为BB型(表1)。Hbα和Hbβ检测结果见图1D,Hbα位点在三个豚鼠品种中均为单态,在所有被检测样品中未发现变异。而每个样品Hbβ均分离出两条带,呈AB表型。泳动较快的Hbα比泳动较慢的Hbβ成分多。Alb的电泳图谱见图1E,所有被检测个体的Alb均呈均一的球状带。
2.2 蛋白位点变异程度和Hardy-W einberg平衡状态分析
各蛋白位点在不同豚鼠品种中的纯合度、杂合度和有效等位基因数的计算结果见表2。不同品种豚鼠在13个血液蛋白位点上的平均杂合度存在差异,其中花色豚鼠的平均杂合度最大(0.350 1),DHP豚鼠的平均杂合度最小(0.313 5)。在不同豚鼠品种间,各多态蛋白位点的变异程度亦存在差异。在DHP豚鼠中,各多态蛋白位点的杂合度大小顺序为Est1>Tf2>Tf1>Es>Ptf;花色豚鼠杂合度大小的顺序为Tf1>Est1>Ptf>Tf2>Es;WHBE豚鼠杂合度大小的顺序为Tf1>Est1>Tf2>Es=Ptf。这说明不同豚鼠品种的遗传背景不同,变异程度也不尽相同。
由于Po、Prt1、Prt2、Sag、Est3、Hbα、Hbβ和Alb等位点在各豚鼠品种中只有一种表型,因此不进行Hardy-Weinberg平衡状态分析,其余蛋白位点的统计结果见表2。经X2适合性检验,在DHP豚鼠中Es为高度不平衡位点(P<0.01);在花色豚鼠中,Ptf为高度不平衡位点(P<0.01);在WHBE豚鼠中,Tf1为高度不平衡位点(P<0.01),Est1为不平衡位点(0.01<P<0.05)。

注:A为Po、Prt1、Prt2、Tf1、Tf2、Ptf和Sag位点电泳图谱;B为血清酯酶电泳图谱;C为红细胞酯酶电泳图谱;D为血红蛋白电泳图谱;E为白蛋白电泳图谱。图1 13个蛋白位点的部分电泳图谱Note:A:Electrophoretic patterns of Po,Prt1,Prt2,Tf1,Tf2,Ptf and Sag;B:Electrophoretic patterns of Est;C:Electrophoretic patterns of Es;D: Electrophoretic patterns of Hb;E:Electrophoretic patterns of AlbFig.1 Electrophoretic patterns of 13 protein loci in the guinea pigs
2.3 不同豚鼠品种的遗传相似性
从表3可知,在三个品种的豚鼠中,花色豚鼠和WHBE豚鼠的遗传相似系数最大(0.9377),遗传距离最近(0.0643),其次是DHP豚鼠和WHBE豚鼠,而DHP豚鼠与花色豚鼠的遗传相似系数最小(0.8359),遗传距离最远(0.1792)。
3 讨论
3.1 豚鼠各个蛋白位点的基因型频率和基因频率
本研究发现,Po、Prt1、Prt2、Sag、Est3、Hbα、Hbβ和Alb等8个位点在三个豚鼠品种中均表现为单态,具有相同的迁移率,在被检测的品种中,这些单态蛋白位点只有一种表型,可能是由于长期的生物进化使这些位点上的遗传变异向同一方向发展,保持了一种稳定性,因此利用这些蛋白位点研究豚鼠品种或品系间的差异意义不大。
Tf1、Tf2、Ptf、Est1和Es在三个豚鼠品种中表现为多态,Tf能特异性地结合和运输铁,它有运铁、保铁、缓冲解毒、抑制细菌等作用,因此与动物的健康和疾病有密切关系,更重要的是Tf具有遗传多态性,不同的动物具有特异的变异体,因此Tf是一个在动物上应用最为广泛的遗传标记。本研究中,Tf1在花色豚鼠中单态,而在DHP豚鼠和WHBE豚鼠中都表现多态,共出现四种表型,白化豚鼠有BB和BC两种表型,而WHBE豚鼠为AB和AC两种表型,所以Tf1位点可作为识别WHBE豚鼠的遗传标记。Tf2在三个豚鼠品种中均呈现多态,均表现为AA、BB和AB三种表型。Ptf距离Tf2位置很近,且染色较浅,在三个品种中共有2种表型,受两个等位基因A、B控制,在Ptf位点上花色豚鼠的表型和其他两个品种存在差异。Est-1在白化豚鼠和花色豚鼠均有三种表型AC、BC和CC,受一个位点上三个共显性等位基因的控制;而在WHBE豚鼠中却只有两种表型AC和BC,在三种豚鼠品种中,C均为优势基因。Es由于带型较为复杂,且染色较快,时间掌握不好很容易使条带连成一片,即使在其他研究较多的动物上报道也甚少[12],本研究经过数次电泳实验发现在三个豚鼠品种中Es均只有一个带型,未分离到其他带型,由于目前对于豚鼠血液蛋白多态性的研究还没有展开,是遗传机制原因还是由于采用不连续聚丙烯酰胺电泳的方法导致这一结果还不清楚,有待进一步研究。
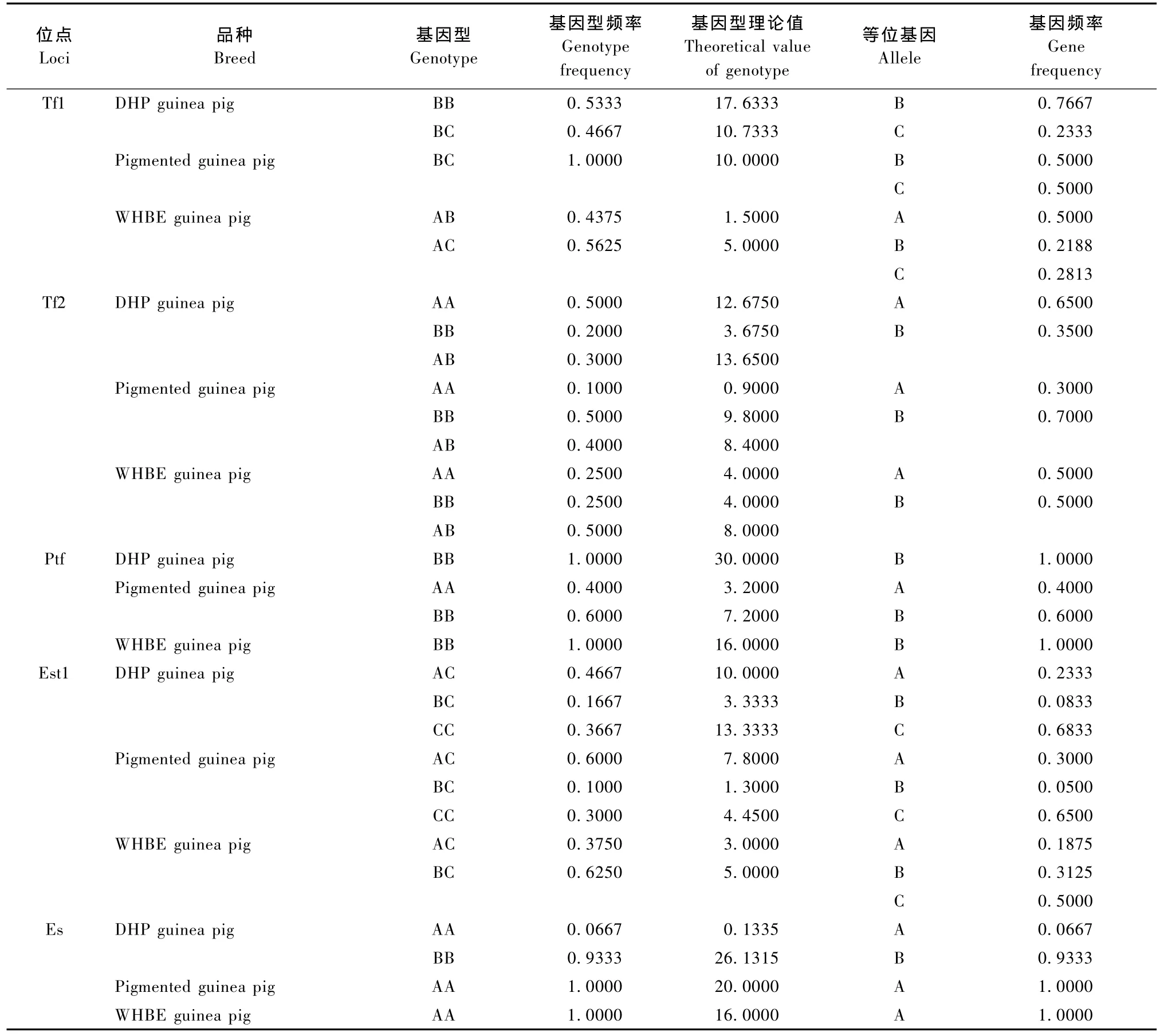
表1 Tf1、Tf2、Ptf、Est1和Es位点的基因型频率和基因频率Tab.1 Genotype frequency and gene frequency of Tf1,Tf2,Ptf,Est1 and Es loci
3.2 多态蛋白位点的Hardy-W einberg平衡状态分析
经X2适合性检验,在白化豚鼠中,Tf1、Tf2和Est1为平衡位点,Es为高度不平衡位点;在花色豚鼠中,Tf2和Est1为平衡位点,Ptf为高度不平衡位点;在WHBE豚鼠中,Tf1为高度不平衡位点,Est1为不平衡位点。这些不平衡位点的基因频率偏离Hardy-Weinberg平衡状态,说明这些位点受到了选择、突变等因素的影响。分析可能有以下几种原因:①进行选择培育时,配种能力强的种豚鼠有更多的机会参与配种并留下后代,而产仔成活率高、哺乳能力强的母豚鼠有更多的机会留在育种群,后代也就有更多的机会留在育种群,因此严格的人工选择是使群体偏离平衡的主要原因。②目前饲养的实验豚鼠从英国实验室购进并进行培育,这种由于种群的迁移而造成的基因频率偏离平衡需要很多个世代的随机交配才可能达到平衡。③新基因的出现往往会使基因频率在很大程度上偏离平衡,它是群体基因频率变化的一个主要原因。如果利用这些不同类型豚鼠中不平衡位点的存在,将其作为标记基因,结合豚鼠的生物学特性,筛选出与这些性状相关的位点,将为豚鼠的选种、育种工作提供科学的依据。
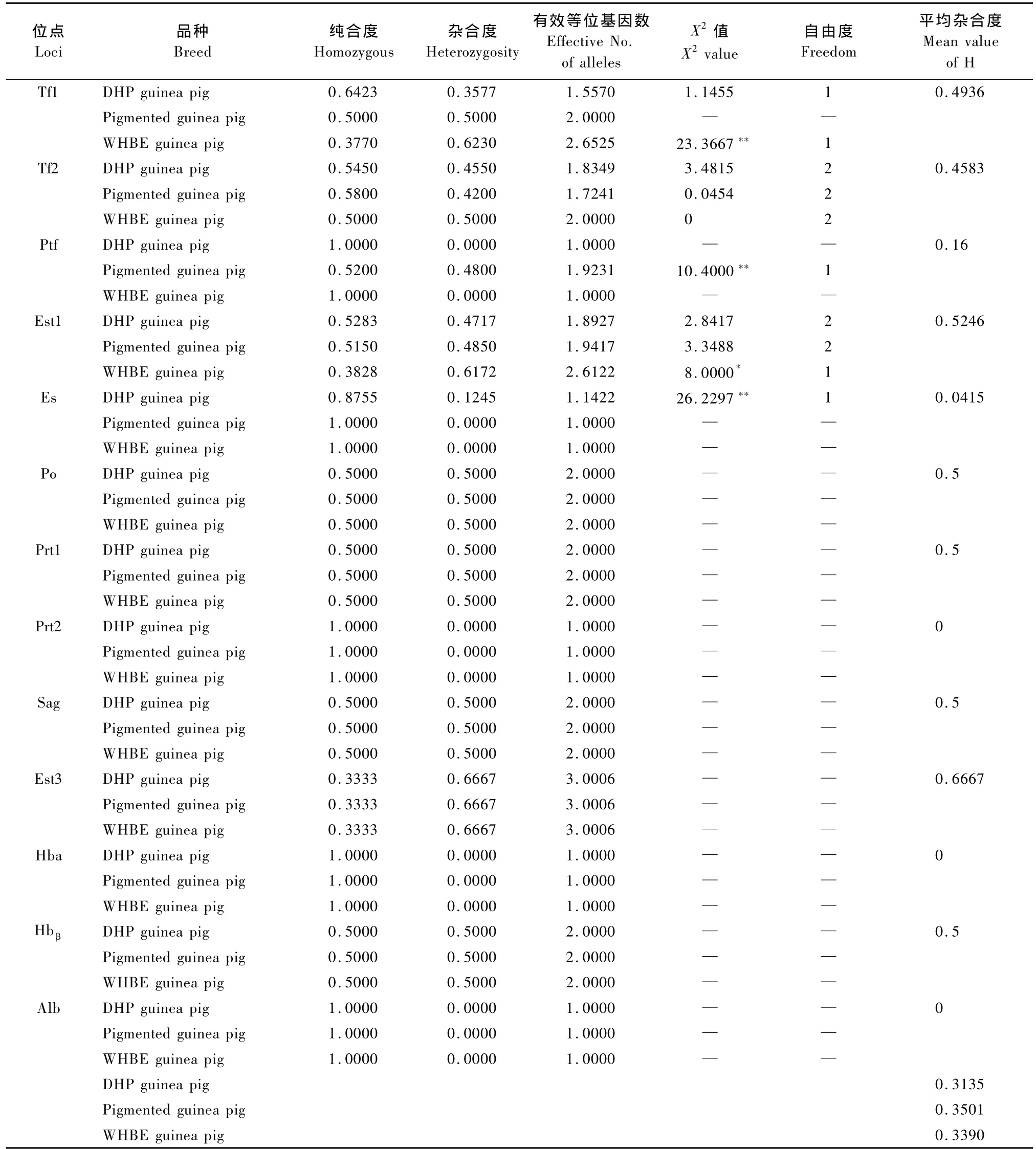
表2 三个豚鼠品种血液蛋白位点的变异程度和Hardy-Weinberg平衡状态的分析Tab.2 The genetic variation and Hardy-Weinberg balance analysis of blood protein loci among the three breeds
3.3 群体遗传变异分析
杂合度和有效等位基因数是反映群体遗传变异大小的有效指标,通过这两个指标可以直观地比较不同种群在同一基因位点的遗传多样性,以及同一群体在不同基因位点的变异程度,平均杂合度是测定基因变异的参数,它反映一个群体各位点变异程度的综合指标,国内外众多的报道皆以平均杂合度来说明[12,13]。基因杂合度大,则有效等位基因数多,说明群体基因型均质度低,表明群体内遗传变异大,反之,杂合度小,则有效等位基因数少,说明群体基因型均质度高,遗传变异性小。从本研究结果来看,在三个豚鼠品种中,所检测的13个蛋白位点的平均杂合度的排列顺序为:花色豚鼠(0.3501)>WHBE豚鼠(0.3390)>DHP豚鼠(0.3135)。这一结果与这些豚鼠的遗传背景相一致,DHP豚鼠是1973年我国从英国实验动物中心引进的封闭群豚鼠,毛色纯白,属于Dunkin-Hartley系,引入我国后先进行了8代兄妹交配,后又进行随机交配,其基因型均质度相对来说比较高,所以平均杂合度最小;花色豚鼠是1919年从日本引入我国东北的英国种封闭群豚鼠,长期以来由于不同毛色品种之间的杂交,毛色多样化,有白与黑等双色或白、棕、黑等三色,群体杂合度相对较高。
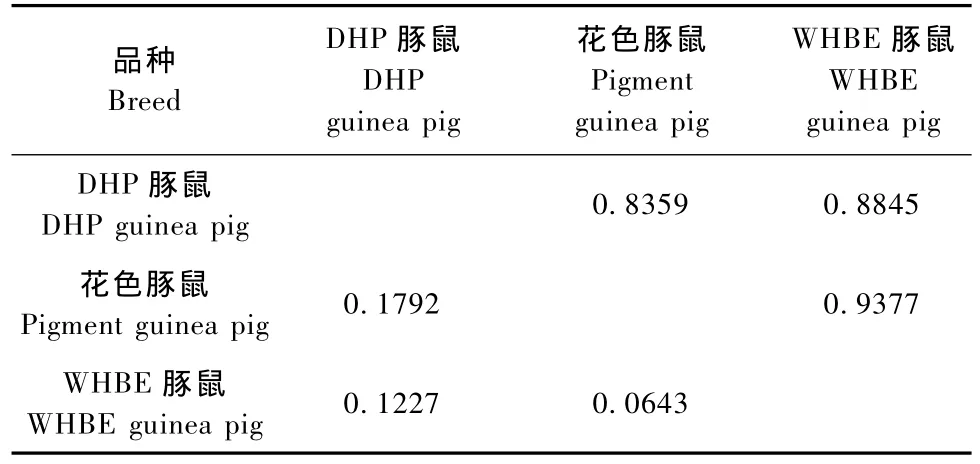
表3 三个豚鼠品种的遗传相似系数矩阵Tab.3 The similarity coefficient matrix of the three guinea pig breeds
在不同豚鼠品种间,各多态蛋白位点的变异程度亦存在差异,在DHP豚鼠中,各多态蛋白位点的杂合度大小顺序为Est1>Tf2>Tf1>Es>Ptf;花色豚鼠杂合度大小的顺序为Tf1>Est1>Ptf>Tf2>Es;WHBE豚鼠杂合度大小的顺序为Tf1>Est1>Tf2>Es=Ptf。这说明不同豚鼠遗传背景不同,各蛋白位点的变异程度也不尽相同。
3.4 豚鼠品种间遗传相似性
遗传相似系数是一项反映群体间亲缘关系的指标,遗传距离也是群体间遗传差异的一种度量。DHP豚鼠是从英国实验动物中心引进的封闭群豚鼠,花色豚鼠是1919年从日本引入我国东北的英国种封闭群豚鼠,而WHBE豚鼠是花色豚鼠和DHP豚鼠杂交选育形成的一个新的种群,所以WHBE豚鼠和花色豚鼠、DHP豚鼠在亲缘关系上都比较接近,而花色豚鼠与DHP豚鼠的亲缘关系相对较远。从本研究结果可知,在三个品种的豚鼠中,花色豚鼠和WHBE豚鼠的遗传相似系数最大(0.9377),遗传距离最近(0.0643),其次是DHP豚鼠和WHBE豚鼠,而DHP豚鼠与花色豚鼠的遗传相似系数最小(0.8359),遗传距离最远(0.1792),这些结果均印证了上述豚鼠的遗传背景。
豚鼠育种群的培育工作存在一定的难度(妊娠期长,产仔数少),尤其表现为WHBE豚鼠的繁殖力低下,所以用于本研究的样品数量有限,特别是WHBE豚鼠,只有16个样品,为了增加结果的可靠性,今后测定应该增加WHBE豚鼠样品的数量。总的来说,利用这些蛋白位点所进行的血液蛋白多态性研究可以有效地反映WHBE豚鼠、DHP豚鼠和花色豚鼠三个品种的遗传多态性概貌。
[1]Sun W,Chang H,Yang ZP,et al.Analysis on the origin and phylogenetic status of Tong Sheep using 12 blood protein and nonprotein markers[J].J Genet Genom,2007,34(12):1097-1105.
[2]周立波,任文陟,张嘉保,等.Vc-獭兔、日本大耳白兔与新西兰白兔血液蛋白多态性研究[J].动物医学进展,2004,25(3):102-105
[3]刘迪文,郭汉身,傅军,等.Zmu-1:DHP豚鼠生化基因位点多态性研究[J].上海实验动物科学,1998,18(3,4):129-132.
[4]傅军.两种豚鼠血清蛋白质的SDS-聚丙烯酰胺凝胶电泳比较[J].科技通报,2000,16(6):490-493.
[5]丁美方.家兔血液蛋白多态性研究[D].中国农业科学研究院硕士研究生论文,2003,9-17.
[6]Grunder AA,Sartore G,Stormont C.Genetic variation in red cell esterases of rabbits[J].Genetics,1965,52(6):1345-1353.
[7]Grunder AA.Inheritance of a heme-binding protein in rabbits[J].Genetics,1966,54(5):1085-1093.
[8]Juneja RK,van de Weghe A,Gahne B.Genetic polymorphism of serum postalbumin(Po)and pretransferrin(Prt)in the laboratory rabbit[J].Hereditas,1984,100(1):11-15.
[9]Arana A,Zaragoza P,Rodellar C,et al.Evidence for transferrin polymorphism in Spanish wild rabbits[J].Anim Genet,1987,18(2):125-132.
[10]Bellen H,van de Weghe A,Bouquet Y,et al.Heterogeneity of Es-1 esterases in the rabbit(Oryctolagus cuniculus)[J]. Biochem Genet,1984,22(9-10):853-870.
[11]Nei M.Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics,1978,89 (3):583-590.
[12]孙杰,赵宗胜,李大全,等.日本大耳白兔、新西兰兔血液蛋白多态性的研究[J].中国畜牧杂志,2002,38(1):7-8.
[13]Nei M.Bottlenecks,genetic polymorphism and speciation[J]. Genetics.2005,170(1):1-4.
Analysis of Blood Protein Polym orphism in WHBE Guinea Pig,DHP Guinea Pig and Pigm ented Guinea Pig
CAI Yue-qin1,ZHAO Wei-chun2,SONG Jian-hui3,CHEN Min-li1,YE Li2,XU Xiao-ping1,WU Wei1,ZHANG Li-zong1
(1.Laboratory Animal Research Center,Zhejiang Chinese Medical University,Hangzhou 310053,China; 2.Biology and Pharmacy Engineering College,Zhejiang Chinese Medical University,Hangzhou 310053; 3.Laboratory Animal Center,School of Medicine,Zhejiang University,Hangzhou 310058)
ObjectiveTo analyze the genetic polymorphism of 13 blood protein loci in WHBE guinea pig,DHP guinea pig and pigmented guinea pig.M ethods Sixty six blood samples were obtained from three populations of guinea pigs.Vertical plate polyacrylam ide gel electrophoresis(PAGE)was used to analyze 13 blood protein loci,including postalbumin(Po),pretransferrin 1(Prt1),pretransferrin 2(Prt2),transferrin 1(Tf1),transferrin 2(Tf2),posttransferrin(Ptf),Slow α globulin(Sag),erythrocyte esterase(ES),serum esterase 1(Est-1),serum esterase 3 (Est-3),hemoglobin α(Hbα),hemoglobin β(Hbβ)and album in(Alb).Gene frequences,average heterozygosity,genetic distance and cluster analysis of the 13 protein loci were calculated according to the electrophoresis pattern.ResultsThe results showed that 8 protein loci(Po,Prt1,Prt2,Sag,Est3,Hbα,Hbβ and Alb)were monomorphic,5 protein loci(Tf1,Tf2,Ptf,Est1 and Es)were polymorphic in the three populations and the locus of Tf1 could be the mark of WHBE guinea pig.The locus of Tf1 laid in extreme Hardy-Weinberg disequilibrium(P<0.01)and Est1 in disequilibrium(0.01<P<0.05)in WHBE guinea pig;the locus of Es laid in extreme Hardy-Weinberg disequilibrium in DHP guinea pig(P<0.01);and the locus of Ptf laid in extreme Hardy-Weinberg disequilibrium in pigmented guinea pig(P<0.01). The average heterozygosity of 13 protein loci was highest in pigmented guinea pig(0.350 1),followed by WHBE guinea pig(0.339 0)and DHP guinea pig(0.313 5).The cluster analysis showed that the genetic distance between WHBE guinea pig and pigment guinea pig was 0.0643,with the closest relationship,and the relationship between DHP guinea pig and pigment guinea pig was the farthest(D=0.179 2).ConlusionThe PAGE-analysis of polymorphic blood protein loci can be used to effectively identify the genetic polymorphism of the WHBE,DHP and pigmented guinea pig populations.
Guinea pig;Blood protein polymorphism;Gene frequences;Heterozygosity;Genetic distance
R394
A
1005-4847(2010)03-0229-07
2009-09-07
浙江省卫生厅项目(编号:2005A074,2008A123);浙江省卫生高层次创新人才培养工程项目资助。
蔡月琴(1982-),女,助理研究员,硕士,研究方向:动物分子生物学。E-mail:cyq810@hotmail.com
陈民利(1963-),女,教授,研究方向:实验动物与比较医学;E-mail:minlichen01@yahoo.com.cn

