医疗器械不良事件监测专家问卷调查结果分析
曲婷婷陈爱民盛洪涛杨兆慧陈建峰
1 大连市药品不良反应监测中心 (大连 116021)
2 新疆建设兵团药品不良反应监测中心 (乌鲁木齐 830002)
3 山东省淄博市药品检验所 (淄博 255086)
4 北京市药品不良反应监测中心 (北京 100024)
5 福建莆田市食品药品监督管理 (莆田 351100)
医疗器械不良事件监测专家问卷调查结果分析
曲婷婷1陈爱民2盛洪涛3杨兆慧4陈建峰5
1 大连市药品不良反应监测中心 (大连 116021)
2 新疆建设兵团药品不良反应监测中心 (乌鲁木齐 830002)
3 山东省淄博市药品检验所 (淄博 255086)
4 北京市药品不良反应监测中心 (北京 100024)
5 福建莆田市食品药品监督管理 (莆田 351100)
目的:研究我国医疗器械不良事件监测工作开展的现状。方法:用Excel对83份调查问卷进行统计分析。结果:接近半数的临床医务人员对医疗器械监督管理的法律、法规、规章制度不太了解;超过40%的临床医务工作者不太了解医疗器械上报的流程;77.11%的临床医务人员没有接受过医疗器械不良事件监测的培训。结论:加大宣传培训力度,普及认识;促进相关法规的出台,制定规范及技术指南是促进监测工作开展的有效措施。
医疗器械不良事件监测 问卷调查 结果分析
Abstract:Objective: Study on the current situation of medical device adverse events monitoring. Method: Using Excel on 83 surveys conducted statistical analysis. Results: Nearly half of the clinical medical staff on the medical device administration and management of the laws, regulations, rules and regulations do not quite understand; More than 40% of clinical medical staff know little about the process of medical device adverse events reported; 77.11% of the clinical medical staff have not received the training of medical device adverse events. Conclusion: Increase awareness training and universal understanding, promote the introduction of relevant laws and regulations, standardize, and develop technical guidelines for monitoring work is effective measures to carried out.
Key words:medical device adverse events(MDAE) montoring, questionnaire, analysis
医疗器械作为近代科学技术的产品已广泛应用于疾病的预防、诊断、治疗、保健和康复过程中,成为现代医学领域中的重要手段。我国是医疗器械生产和使用的大国,据估计每年发生不良事件至少在4万件以上[1]。国内自2002年开展医疗器械不良事件监测工作以来,对医疗器械上市后不良事件的监测和管理,最大限度地控制医疗器械潜在的风险,保证医疗器械安全有效地使用等方面做了很多具体的工作,也面临很多具体问题,本文通过国家药品不良反应监测中心在京组织召开“全国医疗器械不良事件监测专家讲习班”开展问卷调查,为医疗器械监管部门和技术监测机构工作的开展提供依据。
1 对象和方法
1. 1 调查对象
从事骨科临床的副高级以上职称的专业技术人员。
1. 2 调查方法
对参加全国医疗器械不良事件监测专家讲习班的专家进行问卷调查。
1.3 调查问卷
依据统一设计的问卷,调查内容包括对我国医疗器械监管的法律、法规了解程度,医疗器械不良事件的定义,可疑医疗器械的上报、程序、部门管理、培训以及影响报告的因素,促进医疗器械不良事件监测工作开展的有效措施,重点监测品种等。
1.3 统计分析 用Excel 表格录入并进行统计分析。
2 结果
2.1 调查问卷的回收率
共发放调查问卷102份,全部调查完成后, 回收问卷83份,回收率81.37%。
2.2 一般资料
参与问卷调查的人员90.36%为男性,9.64%为女性;其中有57.83%为年龄在40-50岁之间;65.06%的人员来自三级甲等医院(表1) 。
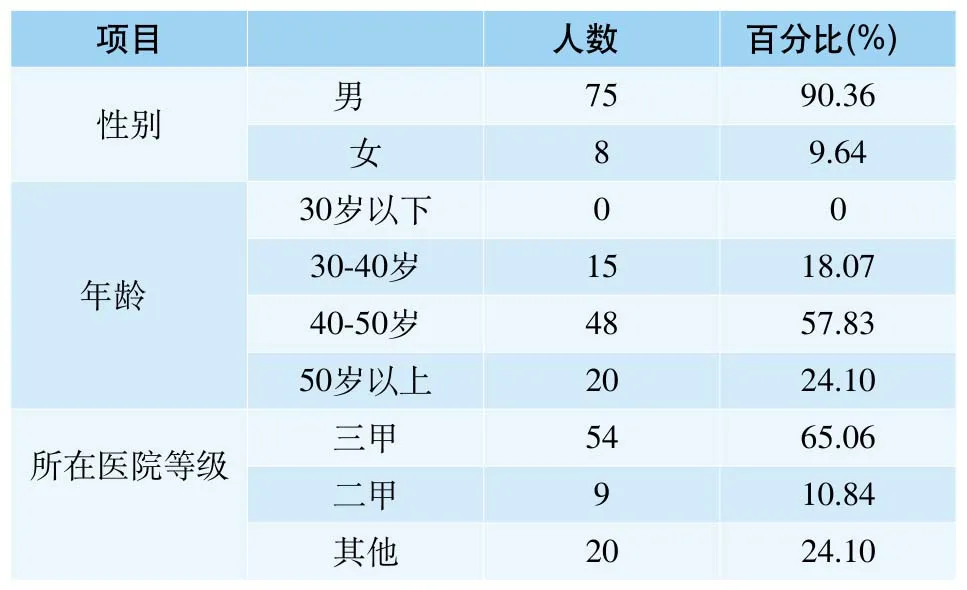
表1
2.3 对我国医疗器械监督管理法律、法规、规章的了解情况
对我国医疗器械监督管理法律、法规、规章比较了解的占50.6%;不太了解的占49.4%(表2)。

表2
2.4 医疗器械不良事件定义
对我国医疗器械不良事件的定义清楚的有89.16%;不完全清楚的占9.64%;不清楚的仅占1.2%(表3)。
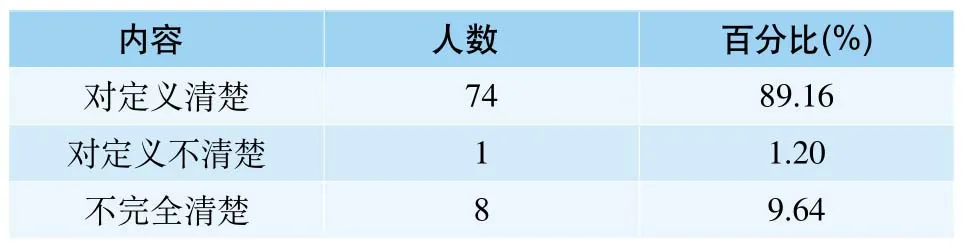
表3
2.5 可疑医疗器械不良事件上报
在对是否上报过医疗器械不良事件的调查中,仅有30.12%的人上报过,而有69.88%的人没有上报过(表4)

表4
2.6 我国医疗器械不良事件的报告程序
在对是否了解我国可疑医疗器械不良事件的报告流程的调查中,清楚的占59.04%,不清楚的占20.48%不完全清楚的占20.48%(表5)。

表5
2.7 医疗器械不良事件监测工作的管理
在对所在单位有无部门负责医疗器械不良事件监测工作的调查中,有部门负责此项工作的单位占53.01%,没有的占36.14%(表6)。

表6
2.8 医疗器械不良事件监测培训
在对以前是否参加过医疗器械不良事件监测培训的调查中,有22.89%的人参加过,而有77.11%的人没有参加过相关的培训(表7)。
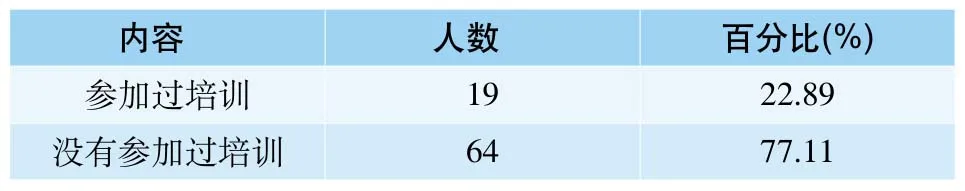
表7
2.9 影响医疗器械不良事件上报因素
在对影响医疗器械不良事件上报的因素的调查中(多选),担心引起医患纠纷的占80.72%;不知道上报途径的占39.76%;不重视,认为没有用的占38.55%(表8)
2.10 促进医疗器械不良事件监测工作开展的措施
在对于认为采取何种措施可以促进医疗器械不良事件监测工作的调查中,85.54%的人认为专业培训,普及认识是相对比较有效的措施,其次就是通过立法,强制上报(表9)。

表8
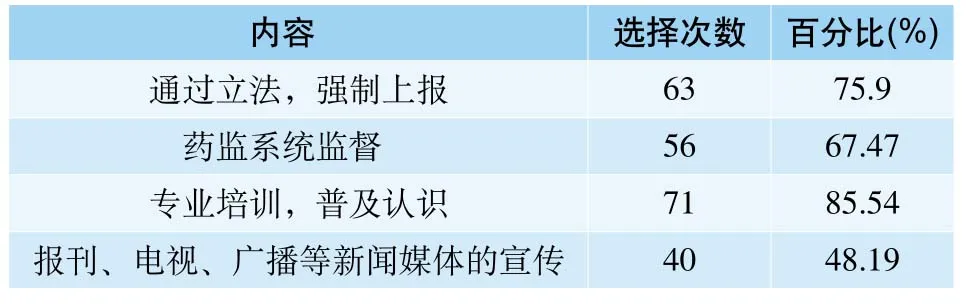
表9
2.11 重点监测品种
对于认为应该重点监测的医疗器械品种中,前3位的是骨科植入物、心血管系统植入物、一次性使用医疗器械;对于骨科临床使用最多的植入类医疗器械前3位是钢板、人工关节、髓内钉。
3 讨论
3.1 开展培训教育工作的必要性
从分析的结果可以看出,目前有接近半数的临床医务人员对医疗器械监督管理的法律、法规、规章制度不太了解;超过40%的临床医务工作者不了解上报的流程;77.11%的临床医务人员没有接受过医疗器械不良事件监测的培训。根据在我国部分地区的医疗器械相关专业人员调查显示有62.6%的人员对医疗器械不良事件认识不太清楚,有30.8%的人员表示对医疗器械不良事件有一定程度的了解,6.5%的人员对此根本不了解。而98.1%的人明确表示需要了解有关方面的知识和信息,没有人声称不需要[2]。这些都告诉我们,要想加速我国医疗器械不良事件监测工作的发展,加强医疗器械不良事件培训工作,提供多渠道的监测知识培训,建立多层次的培训平台是非常必要的。
3.2 建立多种培训机制,推进监测工作发展
虽然我国医疗器械不良事件监测工作开展取得了一定的成绩,但由于起步比较晚,相关体系建设还不完善,还没有建立系统的监测队伍,专业人才比较匮乏,生产、经营企业、使用单位和个人的认知程度严重不足。针对医疗器械安全性监测工作公众的认知度、生产和经营企业的责任意识,专业人员和主管人员业务水平均有待提高的客观要求,结合我国的实际情况,从实际出发,具体问题具体分析,积极探索分层次、分阶段、分类指导的方法和措施,使宣传培训工作达到推进监测发展的目的。
3.3 促进相关法规的出台,制定规范及技术指南
从调查结果中可以看出,促进医疗器械不良事件监测工作开展的有效措施除了展开专业培训,普及认识以外,对于相关法律法规的尽早出台,也是广大医务工作者所期望的。目前我国尚未有医疗器械不良事件监测专项法规。我们应该借鉴发达国家开展医疗器械不良事件监测工作的经验,制定相关的规范及技术指南;借鉴我国开展药品不良反应监测工作的经验,进行监测体系的建设。在相关法律法规的指导和制约下,监测工作的开展也会更加有效,有序。
3.4 消除认识误区,构建和谐、相互信任的医患关系
从研究结果中可以看到,有近90%的临床医务工作者清楚医疗器械不良事件的概念,但临床工作中,只有30%的人上报过可疑医疗器械不良事件报告。对于影响上报的因素的调查中,有80.72%的临床医生担心引起医患纠纷。医患矛盾是长期以来困扰医院精神文明建设的一个掣肘, 而多次调查结果显示, 引发矛盾的因素中相当部分是由于医患沟通不充分不到位造成的[3]。医患关系的协调与否直接影响着整个监测实践活动的展开与良性运转。建立以病人为中心,实施医患沟通,在医院建立起适应当前社会状况的全新的服务模式和思维方式已迫在眉睫。
4 结语
我国医疗器械不良事件监测和评价工作起步较晚、基础薄弱,尚处于初级阶段法规体系尚不完善,器械的研发、临床试验与实际使用环境差别较大;市场监管体系面临诸多问题和考验。需要通过不懈的努力,建立和完善医疗器械监管的法规、规章,制定规范及技术指南,加大宣传培训力度,相信在医疗器械监测系统的共同努力下,一定会为广大人民群众营造一个安全、合理、有效的用械氛围。
[1] 王兰明 关于我国医疗器械不良事件监测系统建设的若干思考[J]中国药业,2004,(05)
[2] 尹娜,赵彬,陈秀琴等 内蒙古自治区医疗器械不良事件监测培训需求的调查研究[J]. 中国全科医学.2005,320
[3] 赵阳 加强医患沟通,减少医疗纠纷[J],国际医药卫生导报,2005,(01)
Analysis on Medical Device Adverse Events(MDAE) Montoring
QU Ting-ting1CHEN Ai-min2SHENG Hong-tao3YANG Zhao-hui4CHEN Jian-feng5
1 Dalian Center for ADR Monitoring (Dalian 116021)
2 Xinjiang produce construction large unit Center ADR Monitoring(Urumchi 8300002)
3 Zibo Institute for Drug Control (Zibo 255086)
4 Beijing Center for ADR Monitoring (Beijing 100024)
5 Putian SFDA (Putian 351100)
1006-6586(2010)02-0046-04
R197
B
2009-09-15
曲婷婷,医学硕士,大连市药品不良反应监测中心医疗器械不良事件监测科

