一株具有拮抗作用的海洋放线菌筛选及其特性
黄惠莉, 肖易, 殷果
(华侨大学化工学院,福建厦门 361021)
一株具有拮抗作用的海洋放线菌筛选及其特性
黄惠莉, 肖易, 殷果
(华侨大学化工学院,福建厦门 361021)
为了探寻对大肠杆菌、金黄色葡萄球菌具有拮抗作用效果的海洋微生物新菌种,作者采用平板稀释方法,经初筛与复筛从海洋淤泥中分离得到一株对大肠杆菌和金黄色葡萄球菌具有较好拮抗作用效果的海洋微生物菌L菌株,并对该菌的生理生化特性、发酵过程参数的变化及抑菌效果进行了研究。结果表明:海洋微生物菌L菌经初步判断属放线菌,L菌适宜的发酵时间为9~10 d,产生的发酵产物对大肠杆菌和金黄色葡萄球菌均有一定的拮抗作用。
海洋微生物;次生代谢产物;抑菌率
近年来海洋微生物活性物质开发研究进展迅速,世界已发现的微生物约有150多万种,其中72 000种存在于陆地,其余都存在于海洋之中。据报道,最近美国科学家发现在一些地方,每平方英尺的海泥上就能找到10多种尚未被人类所认识的海洋微生物,这些海洋微生物有产生多种多样新颖生物活性物质的巨大潜力,是海洋微生物天然药物筛选的重要来源[1-7]。生活环境的不同,不但影响菌群的分布,而且影响微生物代谢产物的合成。海洋微生物独特的生长和代谢方式,有可能产生比陆生微生物结构更新、活性更高、功能更具独特的抗菌活性物质。有关海洋生物产生新的生物活性物质的报道逐渐增多,已经从海洋微生物中发现了许多结构新颖的化合物,这些化合物具有较高的抗肿瘤活性[8]。海洋放线菌是海洋细菌抗肿瘤活性物质的重要来源,最先成为海洋微生物研究的热点。国际最著名的海洋天然产物研究机构——加州大学从放线菌中分离出一系列结构新颖的化合物,这些化合物具有很强的抗癌活性,从报道化合物的结构类型来看,有生物碱、环肽、聚醚类毒素、萜类等[9-12]。海洋放线菌因其代谢途径复杂、代谢产物种类繁多而日益受到研究者的重视。
因此,对海洋微生物的研究已经成为了具有很大发展前景的科研方向,为寻求新的药物或抑菌物质,作者通过对福建泉州海岸微生物中海洋放线菌的筛选、观察、抑菌性研究和发酵参数的测定,来了解海洋放线菌在一定条件下的代谢产物的抑菌率,以便进一步的对其开发研究。
1 材料与方法
1.1 材料
1.1.1 菌种 从福建省泉港海边的海洋淤泥中分离提取。
1.1.2 供试菌 大肠杆菌、金黄色葡萄球菌。
1.2 实验方法
1.2.1 菌种筛选
1)初筛:为寻求对供试菌(大肠杆菌和金黄色葡萄球菌)具有一定拮抗作用的海洋微生物[12],采用微生物稀释法将海泥稀释,接种在选择性培养基(选择性培养基中添加适量重铬酸钾抑制剂)中分离培养,在25℃下倒置培养5~7 d后,挑取单菌落进行纯化、复筛。
2)复筛:以大肠杆菌、金黄色葡萄球菌做为供试菌,将等量的处于对数生长期供试菌(大肠杆菌、金黄色葡萄球菌)与待测菌的发酵液混合培养一定时间,观察其生长情况。选出对供试菌具有一定抑制作用且较为单一的菌落,进行划线分离培养,反复多次纯化,在25℃下倒置培养5~7 d后,挑取单菌落接种斜面保存。
3)菌种形态观察:将筛选出的具有抑菌作用的放线菌L菌进行电镜观察。
1.2.2 抑菌实验 采用浊度法测定抑菌性。将等量的处于对数生长期供试菌与待测菌发酵液混合培养一定时间,测定其浊度为N1,并以加入灭活的等量发酵液后培养相同时间的供试菌菌液做空白,测定其浊度为N2,计算其抑菌率。

1.2.3 生理生化实验 生理生化实验方法参见文献[11,13]。
1.2.4 发酵过程参数的测量
1)还原糖质量浓度测定:采用3,5-二硝基水杨酸比色法测定还原糖质量浓度。
2)蛋白质质量浓度的测定:采用考马斯亮兰法测定蛋白质质量浓度[12]。
3)发酵过程中p H值的测定:直接用p H测试仪测定每瓶发酵液的p H值,记录后绘制p H值变化曲线。
4)细胞干质量的测定:将每天离心后所得的沉淀物取出,进行烘干,烘至恒质量。
2 结果与讨论
2.1 海洋放线菌的筛选与分离
2.1.1 初筛 选择适合于待分离的微生物的生长条件,经涂布法分离初筛得到17种(用A~Q标记)不同的菌落形态微生物,观察到的菌落形态见表1。
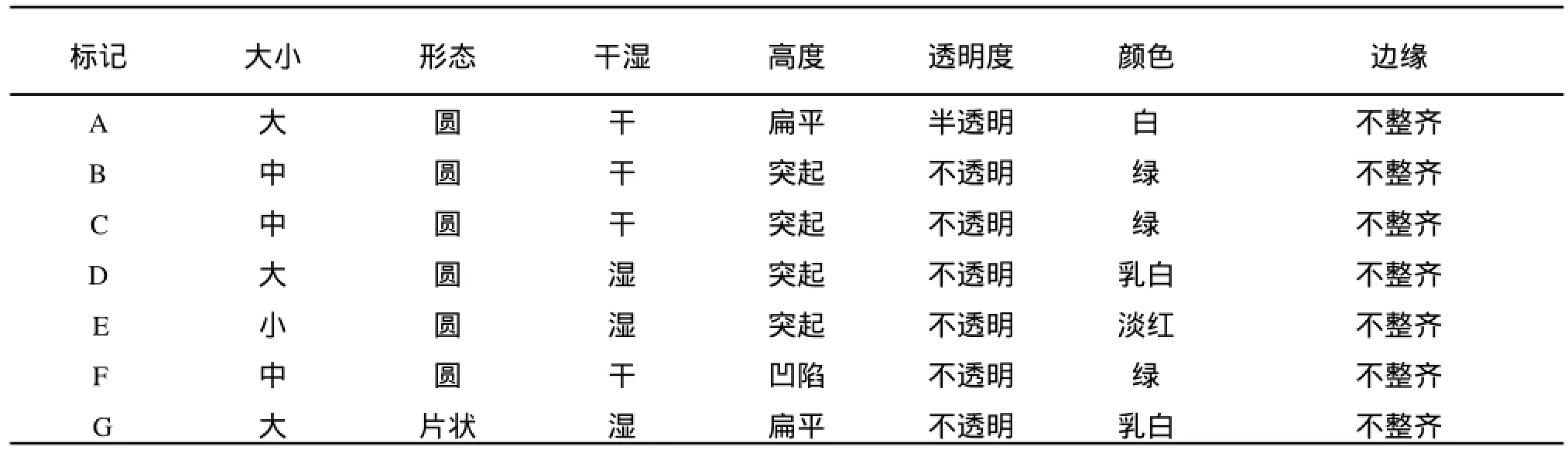
表1 初筛观察到的菌落形态Tab.1 Shape of the screened marine microorganisms

续表1
2.1.2 复筛 依据上述复筛实验方法,将等量的处于对数生长期供试菌(大肠杆菌、金黄色葡萄球菌)与待测菌发酵液混合培养一定时间,测定其浊度计算其抑菌率,结果见表2。
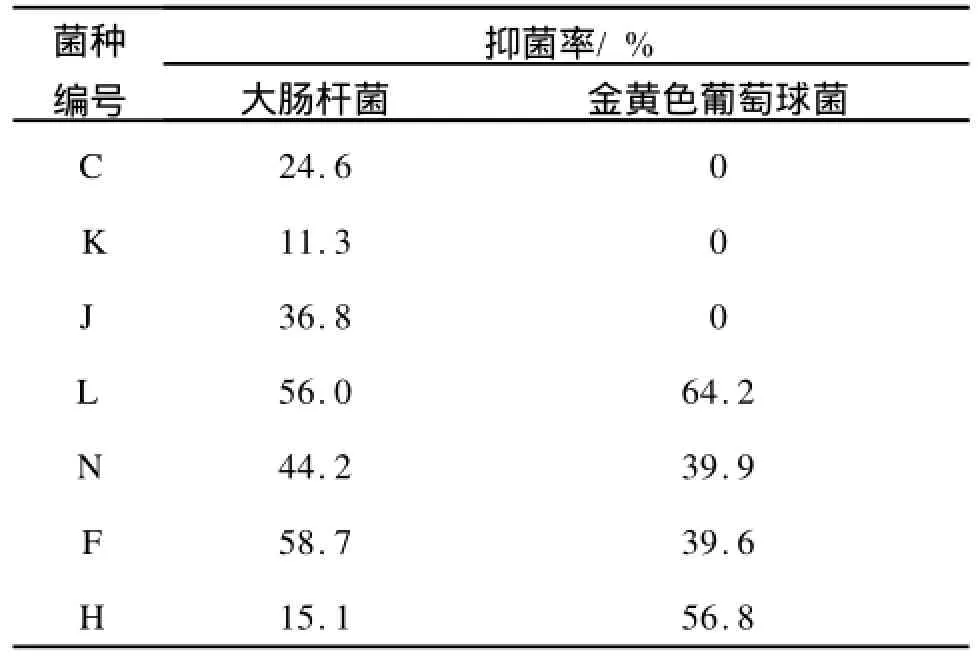
表2 待测菌发酵液对供试菌的抑菌率Tab.2 Anti-microbial ratio of the marine microorganism
所挑选出来的菌种中这7种海洋微生物对大肠杆菌供试菌具有一定的拮抗作用,但是仅4种菌对金黄色葡萄球菌具有拮抗作用。
2.1.3 菌种的电镜观察 在分离纯化的7种有抑菌效果的海洋微生物中,选出了抑菌效果较好的L菌进行电镜观察,结果见图1。
从电镜形态观察可以看出,该菌有菌丝,且错纵复杂。因为有孢子,却无分生孢子梗,初步判断属放线菌。
2.2 海洋微生物菌的生理生化检测
分别对C、J、K、L、N、F、H菌进行生理生化测定,结果见表3。
这些海洋微生物菌的糖酵解试验和明胶液化试验都呈阳性,即都可以消耗糖类,并都可以使明胶液化。而V-P试验、硫化氢试验和三糖铁(TSI)琼脂试验均为阴性,这几种微生物菌产酸产气但不产H2S,在强碱环境下,不能被空气中的氧气氧化为二乙酰。
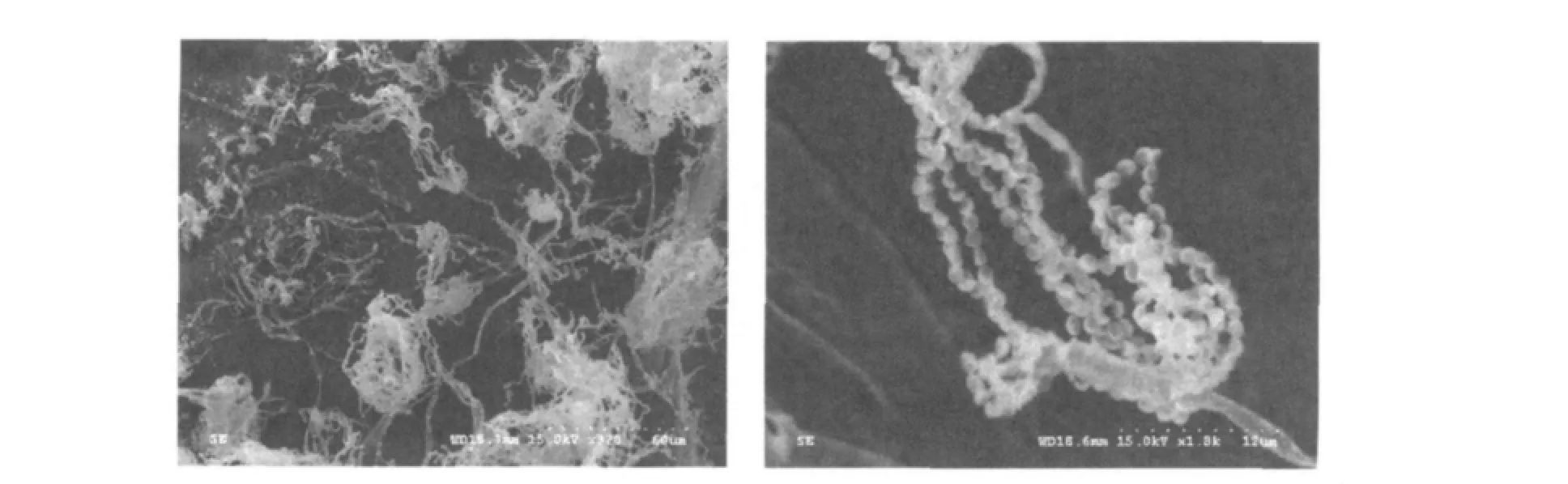
图1 L菌形态与菌孢子形态Fig.1 The shape of marine actinomycete and their spore

表3 海洋微生物菌的生理生化特性Tab.3 Physiological and biochemical characteristic of the screened marine microorganism
2.3 海洋放线菌L菌的发酵参数变化
依据上述1.2.4实验方法,每天取出一瓶发酵过程中的L菌发酵液,冷冻离心分离得到上清液与菌体,将菌体烘干至恒重后称其质量;并测定上清液中的p H值、葡萄糖、蛋白质质量分数,结果见图2。
从图2可知:该菌的菌体干重在摇床培养到第5天时达到相对稳定状态,然后出现波动,这表明菌体经生长旺盛期后达到最高峰并进入平稳期,在持续较长的平稳期生长中,细胞质量变化相对较小。
从图2的葡萄糖质量浓度变化曲线可以看出,该海洋放线菌在摇床发酵培养时是一个消耗葡萄糖的过程,葡萄糖的质量浓度呈下降趋势。在第5天时,培养基中的葡萄糖已经耗尽,此时菌体干重达到最高。

图2 L菌发酵过程中发酵各参数的变化Fig.2 The change of fermentation parameters during fermentation time
从图2可以看出,摇床发酵培养过程中蛋白质质量浓度总体呈上升趋势。前期蛋白质的质量浓度变化有波动但变化不大。根据蛋白质质量浓度的变化,可以确定在第10~14天,L菌的次级代谢产物含蛋白质类物质。
p H值的变化是在前4天有下降趋势,后面稳定上升,到第10天后趋于平稳。说明前4天代谢产物含产酸性物质,到第5天后次生代谢产物含碱性物质,第10天后p H值趋于稳定。
综合p H值、菌体干重、葡萄糖质量浓度和蛋白质质量浓度来看,从第10天开始产生的是蛋白质类的次级代谢产物。
2.4 L菌发酵液对大肠杆菌和金黄色葡萄球菌的抑菌能力
依据上述实验方法,对海洋放线菌L菌在摇床培养中的发酵产物进行抑菌实验,结果见图3。从图3中知:L菌的发酵液从第9天开始,对大肠杆菌和金黄色葡萄球菌均具有较好的抑菌能力。

图3 L菌发酵液的抑菌能力Fig.3 The anti-microbial effect of fermentation product
3 结 语
通过对海洋微生物的分离、抑菌性实验,得到具有较好拮抗作用效果的L菌,了解L菌的发酵过程参数的变化,L菌产生具有拮抗作用的活性物质的适宜发酵时间是9~10 d,该发酵产物对大肠杆菌和金黄色葡萄球菌具有一定的抑菌能力。
对该菌通过发酵调控提高发酵产物活性稳定性、纯化分离其活性物质、确定其具体成分与结构有待进一步研究。
[1]梁静娟,詹萍,庞宗文.具有抗真菌活性的海洋微生物的分离筛选[J].现代食品科技,2006,22(2):92-94.
LIANGJing-juan,ZHAN Ping,PANG Zong-wen.Screening of antifungal marine microbes[J].Modern Food Science and Technology,2006,22(2):92-94.
[2]林敏,宁喜斌.具抑菌活性海洋微生物的筛选[J].微生物学杂志,2005,25(5):23-25.
LIN Min,NING Xi-bin.Screening of marine bacteria with antimicrobial activity[J].Journal of Microbiology,2005,25 (5):23-25.
[3]姜健,杨宝灵,元起,等.海洋共附生微生物的分离和抗菌活性鉴定[J].中国海洋药物,2005,24(3):39-42.
J IANGJian,YANG Bao-ling,YUAN Qi.Isolation and identif ication of marine symbiotic and epiphyte microorganisms with antimicrobial activity[J].Chinese Journal of Marine Drugs,2005,24(3):39-42.
[4]Proksch P,Edrada R A,Ebel R.Drugs from the seas-current status and microbiological implications[J].Appl Microbiol Biotechnol,2002,59:125.
[5]Kin S Lam,Discovery of novel metabolites from marineActinomycetes[J].Current Opinion in Microbiology,2006,9(3): 245-251.
[6]赵焕平,祖国仁,孔繁东,等.海洋细菌B21106生长特性及产胞外多糖研究[J].食品与生物技术学报,2009,28(2):284 -288.
ZHAO Huan-ping,ZU Guo-ren,KONG Fan-dong,et al.Study on the growth characteristic and exopolysaccharide of marine bacteria B21106[J].Journal of Food Science and Biotechnology,2009,28(2):284-288.
[7]陈真,郭青龙,钱之玉.海洋真菌多糖YCP对荷瘤小鼠的抗肿瘤作用[J].食品与生物技术学报,2005,24(5):1-5.
CHEN Zhen,GUO Qing-long,QIAN Zhi-yu.Study on the tumor inhibitory effect of YCP(a marine fugal polysaccharide)[J].Journal of Food Science and Biotechnology,2005,24(5):1-5.
[8]袁献温,杨瑞丽.一株具有抗肿瘤活性的海洋放线菌的分离和鉴定[J].微生物学通报,2009,36(1):78-83.
YUAN Xian-wen,YANG Rui-li.Isolation and identification of one marine actinomycete strain exhibiting antitumor activity[J].Microbiology,2009,36(1):78-83.
[9]谷俊,林亲雄,邢莹莹,等.海洋放线菌M324抗菌物质的发酵优化与性质的初步研究[J].药物生物技术,2006,13(5): 347-350.
GU Jun,LIN Qin-xiong,XING Ying-ying,et al.Fermentation conditions and characteristics of antibiotic active substance from marine actinomycete M324[J].Pharmaceutical Biotechnology,2006,13(5):347-350.
[10]孟繁雯,叶亮,邢莹莹,等,海洋放线菌WBF16的分类鉴定[J].药物生物技术,2008,15(2):124-128. MENG Fan-wen,YE Liang,XING Ying-ying,et al.Taxonomic identif ication of marine actinomyces WBF16[J].Pharmaceutical Biotechnology,2008,15(2):124-128.(in Chinese)
[11]程沁园,叶亮,邢莹莹,等,海洋放线菌WB-F5发酵条件的优化及抑菌活性产物性质的初步研究[J].中国天然药物, 2007,(2):142-145.
CHENG Qin-yuan,YE Liang,XING Ying-ying,et al.Fermentation conditions and characteristics of anti-bacteria active substance by marine actinomycete WB-F5[J].Chin J Nat Med,2007,(2):142-145.(in Chinese)
[12]林亲雄,刘云,奚涛.海洋放线菌N331生物碱活性组分的研究[J].中国海洋药物,2008,27(01):16-49.
LIN Qin-xiong,LIU Yun,XI Tao.Study on bioactive alkaloids ingredient produced by marine acti-nomyces N331[J]. Chinese Journal of Marine Drugs,2008,27(01):16-49.(in Chinese)
[13]路苹,于同泉,王淑英.蛋白质测定方法评价[J].北京农学院学报,2006:21(2):65-69.
LU Ping,YU Tong-quan,WANG Shu-ying.A review on determination of protein[J].Journal of Beijing Agricultural College,2006:21(2):65-69.
[14]王莹.海洋抗菌活性物质产生菌的筛选及系统分类研究[D].杭州:浙江大学,2006.
(责任编辑:李春丽)
Characteristic of Marine Actinomycete Having Antagonistic Effects
HUAN G Hui-li, XIAO Yi, YIN Guo
(Chemical Engineering College,Huaqiao University,Xiamen 361021,China)
The purpose of this manuscript is to screen the marine microorganisms and evaluate the antagonistic effects of those isolated microorganism toEscherichia coliand theStaphylococcus. A isolated marine microorganism L having better antagonism effects was separated from the dilutedmarinemud.Physiologyandbiochemicalcharacteristicsoftheisolatedmarine microorganism,the curve of fermentation control parameters were studied.Antagonism effects of the ferment production were tested with theEscherichia coliand theStaphylococcus.The result shows that marine microorganism L was marine actinomycetes,the suitable fermentation time is 9 to10 days,the secondary metabolite in fermentation broth have certainty the antagonism ability toEscherichia coliandStaphylococcus.
marine microorganism,secondary metabolite,anti-microbial ratio
TQ 920.1
:A
1673-1689(2010)03-0471-05
2009-07-06
福建省自然科学基金重点项目(2007T010)。
黄惠莉(1962-),女,福建诏安人,工学学士,教授,主要从事海洋资源开发与利用、环境生物技术方面的研究。Email:hlhuang@hqu.edu.cn。

