不同时间去势对大鼠CIA发病情况的影响
鞠大宏,赵宏艳,王 燕,肖 诚,查青林,张继东,董鑫鑫吕 诚,刘梅洁,李 艳,刘 红,于 峥,潘贵超,吕爱平
(1.中国中医科学院中医基础理论研究所,北京 100700;2.中日友好医院临床医学研究所,北京 100029;3.江西中医学院,江西南昌 330004;4.天津骨科医院,天津 300211;5.中国中医科学院中医临床基础医学研究所,北京 100700;6.北京市昌平区华一医院,北京 102208)
目前类风湿性关节炎(Rheumatoid arthritis,RA)动物模型主要采用Ⅱ型胶原免疫诱导进行制作,随着人们对RA和胶原诱导性关节炎(collageninduced arthritis,CIA)的深入研究,发现二者存在许多类似之处[1~8],是目前公认的RA最佳动物模型。从中医角度来看,该模型缺乏中医证候属性。中医理论认为,肾虚在痹证(RA)发病中起着重要作用,据此本实验拟在去势的基础上,用CⅡ进行免疫来制作肾虚痹证(RA)病证结合动物模型。主要观察不同程度的肾虚状态对大鼠关节炎发病情况的影响,以及寻找出在去势后的那个时间点进行CⅡ免疫诱导能够制作出发病率高和发病程度重的动物模型,以期为肾虚痹证(RA)病证结合动物模型的制作提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选用6周龄SPF级SD大鼠100只,雌雄各半,由中国药品生物制品检定所提供,动物许可证号SCXK(京)2005-0004。在中国中医科学院中医基础理论研究所清洁级动物室喂养,实验动物室许可证号SYXK(京)2005-0024。
1.1.2 主要试剂与仪器 主要试剂:牛Ⅱ型胶原(CⅡ)、不完全弗氏佐剂(IFA):美国Chondrex公司产品,批号080217;戊巴比妥钠:北京化学试剂有限公司产品,批号020427;大鼠IL-6 ELISA试剂盒:美国 Bender公司产品,批号 BMS625;大鼠 IL-10ELISA试剂盒:美国 Bender公司产品,批号BMS629;大鼠皮质酮(Corticosterone,CORT)ELISA试剂盒:德国DRG公司产品,批号EIA-4164;大鼠抗Ⅱ型胶原ELISA试剂盒:美国Chondrex公司产品,批号2042。
主要仪器:Leica QwinV3图像分析系统,德国Leica公司产品;AS325型切片机:英国SHONDON公司产品;T10 BASIC手持式分散机:德国IKA公司产品;Multiskan Mk3酶标仪、Wellwash 4 Mk2洗板机:美国Thermo公司。
2 方法
2.1 动物分组及处理
将动物随机分为对照CIA组、去势1周CIA组、去势2周 CIA组、去势3周 CIA组、去势4周CIA组5组,每组20只(雌雄各半)。为了保证CⅡ免疫条件的齐同性,各组均在同一时间免疫,以免疫时间为基准点,在免疫前1周行去势手术的即为去势1周CIA组,去势2周CIA组、去势3周CIA组、去势4周CIA组则以此类推。免疫后每7 d称重1次。
按常规方法[9]切除大鼠的双侧睾丸或卵巢。CⅡ免疫的具体方法:取适量Ⅱ型胶原溶液(浓度为2mg/ml)逐滴加入至等容积的不完全弗氏佐剂中,Ⅱ型胶原终浓度为1mg/ml。冰浴中用匀浆器充分乳化,以滴加水中不扩散为度,取乳化后的混合物按0.2ml/只,即200μg CⅡ/只于尾根部皮下注射。7d后按0.1ml/只,即100μg CⅡ/只,于尾根部皮下加强免疫1次。
2.2 取材
于免疫后第35天戊巴比妥钠麻醉下,采用腹主动脉取血,2500 r/min,20 min离心后取血浆,分装后-80℃冰冻备用。开腹立即取出胸腺、脾脏和肾上腺并称重。每只大鼠的胸腺、脾脏和及肾上腺(mg)分别与对应大鼠体重(g)的比值为胸腺系数、脾脏系数及肾上腺系数。取双侧膝、踝关节,在福尔马林中固定备用。
2.3 指标的测定
2.3.1 一般状态观察 观察大鼠一般状态的改变:精神状况,如是否有委靡、嗜睡、蜷缩、扎堆,对声音、触动刺激反应迟钝以及毛松消瘦、失去光泽等。
2.3.2 关节炎指数(Arthritis index,AI)评分方法 造模后开始观察并记录关节病变程度,每7d 1次。参照5级评分法评价[10、11],将2只后踝关节的病变程度累计积分,计算出关节炎指数,每个动物最大为8分。
0分:无关节炎;1分:小趾关节轻度肿胀;2分:小趾关节和足跖肿胀;3分:踝关节以下的足爪肿胀;4分:包括踝关节在内全部关节肿胀。
2.3.3 关节切片及光镜下关节破坏半定量分析方法 关节在福尔马林固定1周后,5%HNO3脱钙1周,酒精逐级脱水,二甲苯透明,石蜡包理,切片,常规HE染色。光镜下观察滑膜、软骨、骨的病理改变,并进行关节病理损伤半定量分析[12]。
0分:关节结构正常,关节间隙均匀,软骨、骨无损伤,滑膜组织无炎症、增生等;1分:关节结构基本正常,有滑膜增生,血管数量增加,可见少量炎细胞浸润,软骨表层轻度破坏;2分:关节软骨有明显的侵蚀破坏,血管翳形成,炎细胞浸润明显,无骨破坏,关节间隙基本正常;3分:有大量的血管翳形成,可见广泛的软骨的侵蚀破坏,可见骨破坏,关节结构遭破坏。
2.3.4 血浆CORT、抗Ⅱ型胶原抗体、IL-6、IL-10的检测 采用ELISA方法,按照所附说明书测定血浆中CORT、抗Ⅱ型胶原抗体、IL-6、IL-10含量。
2.4 统计学处理
3 结果
3.1 CⅡ免疫诱导对不同时间去势大鼠脾脏、胸腺及肾上腺系数的影响
表1、2显示,胸腺系数:与对照CIA组相比,去势1周、2周、3周CIA组大鼠胸腺系数明显升高(P<0.05,0.01),去势4周 CIA组与对照 CIA组相比,无显著性差异。脾脏系数:去势1周、2周CIA雌性大鼠脾脏系数与对照CIA组相比明显升高(P<0.05),去势2周CIA雄性大鼠脾脏系数与对照CIA组相亦比明显升高(P<0.05),其余各组与对照CIA组相比,无显著性差异。肾上腺系数:去势3周雄性大鼠与对照CIA组大鼠相比,肾上腺系数明显增高(P<0.05);其余各组与对照CIA组相比,无显著性差异。
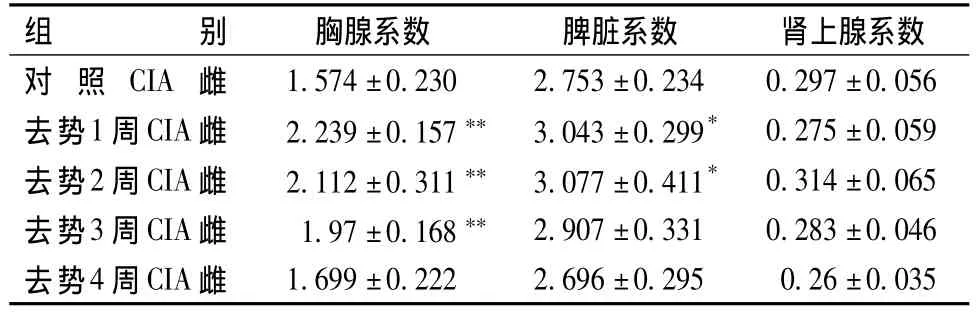
表1 各组雌性大鼠脾脏、胸腺及肾上腺系数的变化(mg/g)

表2 各组雄性大鼠脾脏、胸腺及肾上腺系数的变化(mg/g)
3.2 CⅡ免疫诱导对不同时间去势大鼠关节炎发病率的影响
对不同去势时间关节炎发病情况数据进行动态分析,发现对照CIA组大鼠与CIA去势组大鼠,或者不同去势时间CIA大鼠发病率影响没有显著性差异(P=0.9159)。

表3 CⅡ免疫诱导的SD大鼠对不同时间去势关节炎发病情况边际数比较
大鼠从14d开始发病然后一直持续到观察结束仍然处于疾病状态则视为有效发病,不同去势时间有效发病率见表4。
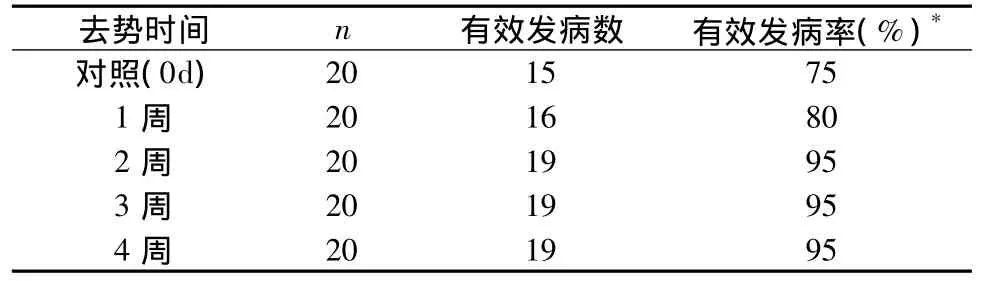
表4 不同时间去势造模大鼠有效发病率情况
3.3 CⅡ免疫诱导对不同时间去势大鼠关节炎指数的比较

图1 不同时间去势CIA模型关节炎指数随时间变化曲线图
3.4 CⅡ免疫诱导对不同时间去势大鼠膝、踝关节病理积分的影响
光镜下观察结果显示,各组膝、踝关节可见明显的滑膜细胞增生,排列紊乱,滑膜组织充血水肿,毛细血管增生,并可见炎细胞浸润;增生的滑膜组织形成绒毛状,可伸向关节腔深处,或向软骨面爬行形成血管翳。在血管翳覆盖下的软骨表层可见明显的软骨表层组织的变性、坏死。关节软骨面剥脱,可见关节腔内有脱剥的关节软骨及滑膜组织。
3.5 CⅡ免疫诱导对不同时间去势大鼠血浆中CORT含量的影响
双因素方差分析统计结果显示,性别对CORT影响有显著性(P<0.0001)。数据显示,性别和分组之间有交互作用(P<0.05),所以按性别做分层分析可以了解不同性别分组之间的差异。结果显示,去势后不同性别大鼠对CORT的反应变化相反,即与未去势CIA组比较,雌性去势CIA组大鼠血浆CORT水平明显降低(P<0.01,P<0.05),除去势1周组外,雄性大鼠CORT均显著升高(P<0.01,P<0.05),且与去势时间呈正相关,大鼠去势3周血浆CORT与去势4周相比,无显著性差异。

图2 不同时间去势关节病理积分比较图
3.6 CⅡ免疫诱导对不同时间去势大鼠血浆中抗CⅡ抗体含量的影响

图3 不同时间去势CIA大鼠血浆CORT变化

图4 不同时间去势CIA大鼠血浆抗CⅡ抗体变化
双因素方差分析统计显示性别对抗Ⅱ型胶原抗体影响无显著性(P=0.384),去势时间对抗Ⅱ型胶原抗体影响有显著性差异(P<0.0001),LSD法两两比较显示,随着去势时间增加,抗Ⅱ型胶原抗体明显升高,与对照CIA组比较,去势2、3、4周 CIA组大鼠血清抗Ⅱ型胶原抗体水平明显升高(P<0.05),去势1~4周CIA组大鼠血清抗Ⅱ型胶原抗体水平有显著性差异(P<0.05)。
3.7 CⅡ免疫诱导对不同时间去势大鼠血浆中IL-6含量的影响
双因素方差分析统计结果显示,性别对IL-6影响有显著性(P=0.0034),数据显示性别和分组之间无交互作用(P=0.3356),去势时间对IL-6影响有显著性差异(P<0.0001),两两比较采用LSD法检验,结果显示,与对照 CIA组比较,去势2周、3周、4周CIA组大鼠IL-6水平明显升高(P<0.05),去势1周、2周、3周、4周CIA组大鼠血清IL-6水平亦有显著性差异(P<0.05),随着去势时间增加,明显升高。
3.8 CⅡ免疫诱导对不同时间去势大鼠血浆中IL-10含量的影响

图5 不同时间去势CIA大鼠血浆IL-6变化

图6 不同时间去势CIA大鼠血浆IL-10变化
双因素方差分析结果显示,性别对IL-10影响有显著性(P<0.0001)。数据显示,性别和分组之间无交互作用(P=0.3356),去势时间对IL-10影响有显著性差异(P<0.0001);两两比较采用LSD法检验,结果显示,各组CIA组大鼠血清IL-10水平随去势时间增加,明显升高,均有显著性差异(P<0.05)。
3.9 动物行为学评定
图1、2显示,去势2周后,大鼠无明显行为形态异常;去势3周后,出现活动减少、弓背蜷缩、畏寒喜暖、体毛枯疏、扎堆及饮食减少、肛周污秽等一系列与临床贴近的肾虚证候。
4 讨论
中医理论认为,肾虚在RA发生发展中起着重要作用,选择恰当的肾虚模型是研究肾虚型病证结合动物模型的关键。目前有多种制作肾虚动物模型的方法[13~16],而去势法应用较为成熟和稳定。现代研究表明,“下丘脑-垂体-靶腺”轴不同环节、不同程度的功能紊乱是肾虚证的主要病理基础。下丘脑-垂体-肾上腺轴(HPA)是神经内分泌的重要组成部分,糖皮质激素(人类主要为皮质醇,大鼠主要为CORT)是该轴的终末激素。实验检测了大鼠血浆CORT含量,发现睾丸切除后大鼠的CORT升高,且与去势时间成正相关,而卵巢切除后大鼠的CORT水平下降。该结果说明性激素对肾上腺皮质激素有调节作用,且这种调节作用存在性别差异,有关其机制有待进一步研究。
CⅡ主要分布于软骨和眼的玻璃体中,机体在正常的情况下,CⅡ是一种与免疫系统隔绝的蛋白,但在某些病理条件下却可作为一种自身抗原呈现出来,诱导机体产生抗 CⅡ抗体,诱发关节炎的发生[17]。实验结果表明,CIA大鼠含有大量抗CⅡ抗体,去势后即肾虚条件下制作的CIA模型,抗CⅡ抗体水平明显升高,表明抗CⅡ抗体在CIA的发病过程中起着重要的作用。细胞因子在RA的病理过程中亦是极为重要的介质。IL-6是一种具有活化T细胞、B细胞、巨噬细胞和破骨细胞等多种功能的细胞因子[18]。实验结果表明,随着去势时间的延长,即肾虚程度的加重,IL-6的含量明显增加。IL-10主要由Th2细胞产生,是一种具有很强免疫抑制及免疫调控作用的细胞因子,几种不同的RA动物模型实验证实IL-10具有治疗作用,能抑制CIA的进展,减轻关节肿胀和软骨破坏[19]。但实验结果可见,去势CIA大鼠血清中IL-10水平较对照CIA组显著升高。随着去势时间的延长,即肾虚程度的加重,IL-10的含量明显增加。有研究证实,虽然RA患者血清和关节滑液中IL-10水平高于正常,但是仍然处于相对缺乏的状态[30]。所以CIA大鼠血浆中IL-10的升高可以视为补偿性增加。
本实验所制作的肾虚型类风湿性关节炎病证结合动物模型与人类肾虚型RA相比,有许多相似之处,具体表现在以下几个方面:(1)动物行为学特征表现出肾虚证状态,主要为活动减少、弓背蜷缩、体毛枯疏、扎堆及饮食减少、肛周污秽等。肾虚相关因子血浆CORT的变化与人类肾虚时皮质醇的变化相似;(2)该模型病理形态学改变主要以滑膜病变为主,与人类肾虚型RA病变亦相似;(3)抗CⅡ抗体在该动物模型上能够明显检出;(4)随着去势时间的延长,即肾虚程度加重,CIA发病率和发病程度亦随之增加。这与临床上肾虚痹证病人类风湿性关节炎发病年龄有向更大年龄移动的趋势相一致[20~22]。由此可见,本实验制作的肾虚型RA模型既有明显的肾虚症状,又有明显的关节炎的外部表现,说明是一个成功的病证结合动物模型。实验结果表明,随着去势时间的延长,即肾虚程度加重,CIA有效发病率和发病程度亦随之增加,在去势4周后其有效发病率就可达到95%,且发病程度明显高于同期未去势大鼠。在有效发病率和发病程度上,雌雄之间并无明显差异。因此,在制作肾虚痹证(类风湿性关节炎)病证结合动物模型时,在大鼠去势4周时就可用CⅡ进行免疫诱导。
[1]Cook A D,Rowley M J,Wines B D,et al.Antibodies to the collagen-like region of C1q and typeⅡcollagen are independent populations in systemic lupus erythematosus and rheumatoid arthritis[J].J Autoimmun,1994,(3):369-378.
[2]Choi E K,Gatenby P A,Bateman J F,et al.Antibodies to typeⅡcollagen in SLE:a role in the pathogenesis of deforming arthristis[J].Immunol Cell Biol,1990,68(Pt1):27.
[3]Cutolo M,Accuado S.Sex hormones,HLA and rheumatoid arthritis[J].J Clin Exp Rheumatol,1991,9:641.
[4]艾景录,吕爱平.性腺功能异常型肾虚痹证发生机理的实验研究[J].中国中医基础医学杂志,1995,(2):142.
[5]Ostensen M,Veiby O P,Raiss R,et al.Reponses of normal and rheumatoid human anticular chondrocyte cultured nuder various experimental conditions in agarose[J].Scand J Rheumatol,1991,20:172.
[6]吕爱平,王安民,曾哓莲.益肾蠲痹丸对大鼠实验性痹证影响的病理学研究[J].中医杂志,1989;29(6):49-51.
[7]Clague R B,Moore L J.IgG and IgM antibody to native typeⅡcollagen in rheumatoid arthritis serum and synovial fluid[J].Arthritis Rheum,1984,27:1370-1376.
[8]Shinmei M,Masuda K,Kikuchi T,et al.Produtions of cytokines by chondrocytes and its role in proteoglycan degradation[J].J Rheumatol supl,1991,27:89.
[9]鞠大宏,于福禄,张丽坤,等.滋阴补肾法对卵巢切除所致骨质疏松大鼠成骨细胞COX-2蛋白和 mRNA表达的影响[J].中国中医基础医学杂志,2006,14:44-46.
[10]Holmdahl R,Jansson L,Andersson M,et al.Immunogenetics of typeⅡcollagen autoimmunity and susceptibility to collagen arthritis[J].Immunology,1988,65(2):305.
[11]张钧田.现代药理实验方法[M].北京:北京医科大学中国协和医科大学联合出版社,1998:1383.
[12]C.Schneider,Y.Matsumoto.Experimental autoimmunr myositis in the Lewis rat:lack of spontaneous T2 cell apoptosis and therapeutic response to glucocorticosteroid application[J].Journal of Neuroimmunology,2000,(107):83-87.
[13]吕爱平,朱碗华,徐世杰,等.类风湿性关节炎中西医结合应用基础研究[M].北京:中医古籍出版社,1999:92-166.
[14]吕爱平,王安民,艾景录,等.肾虚痹证发病机理研究[J].中医杂志,1995,(8):492.
[15]高岗,杨根金,娄子洋.肾虚证大鼠尿液的核磁共振谱代谢组学研究[J].第二军医大学学报,2009;30:565-568.
[16]陈小野,邹世洁,王震,吕爱平,艾景录.大鼠肾上腺次全切除肾阳虚模型胃、舌病理观察[J].中国中医基础医学杂志,1999,5:20.
[17]Takagishi K,Hotokebuchi T,Arai,et al.Collagen arthritis in rats:the importance of humoral immunity in the initiation of the disease and perpetuation of the disease by suppressor T cell[J].Intern Ren Immunol,1998,4:35-48.
[18]Choy E.Clinical experience with inhibition of interleukin-6[J].RheumDis Clin North Am,2004,30:405-415.
[19]Joosten LA,Lubberts E,Durez P,et al.Role of interleukin-4 and interleukin-10 in murine collagen-induced arthritis;protective effect of interleukin-4 and interleukin-10 treatment on cartilage destruction[J].Arthritis Rheum,1997,40:249-260.
[20]Kaipiainen-Seppanen O,Aho K,Laakso M.Shift in the incidence of rheumatoid arthritis toward elderly patients in Finland during 1975-1990[J].Clin Exp Rheumatol,1996,14:537-542.
[21]Doran MF,Pond GR,Crowson CS,et al.Trends in incidence and mortality in rheumatoid arthritis in Rochester,Minnesota,over a forty-year period[J].Arthritis Rheum,2002,46:625-631.
[22]Imanaka T,Shichikawa K,Inoue K,et al.Increase in age at onset of rheumatoid arthritis in Japan over a 30 year period[J].Ann Rheum Dis,1997,56:313-336.

