葛根素抑制脂多糖诱导RAW264.7巨噬细胞表达诱导型一氧化氮合酶
俞建,胡文志,季玲,孙烈
近年的研究表明,动脉粥样硬化是一种慢性炎症性疾病[1]。巨噬细胞参与动脉粥样硬化(AS)的形成、发展的全过程,而其表达的诱导型一氧化氮合酶(iNOS)与之密切相关[2]。研究发现,黄酮类药物具有抗炎抗氧化应激的作用[3],葛根素(Puerarin,Pue)是目前临床应用较多的黄酮类药物,对其抗炎作用机制的相关研究较少[4]。本研究通过体外细胞培养,应用葛根素作用巨噬细胞,观察葛根素对内毒素诱导巨噬细胞表达iNOS的影响。
1 材料和方法
1.1 主要试剂 RPMI 1640培养粉、TRIzol试剂盒:GIBCO公司;葛根素:SIGMA公司;各种半定量逆转录多聚酶链式反应(RT-PCR)试剂和DNA marker:Takara生物公司,引物由上海博新生物公司合成。抗iNOS抗体、HRP标记的羊抗兔IgG抗体:Santa Cruz公司。
1.2 主要仪器 BCM-1000型超净工作台:中国苏州;BB16型CO2培养箱:Heracus公司;CK40倒置相差显微镜:Olympus公司;GL-20B型低温离心机:上海安亭科学仪器厂;PC2400扩增仪:Perkin Elmer公司;各种电泳仪、UVP凝胶图像扫描系统等。
1.3 细胞培养 小鼠巨噬细胞株RAW264.7,购自中国科学院上海细胞研究所。用RPMI 1640完全培养液(10%胎牛血清,100 U/ml青霉素及 100 μ g/ml链霉素)在37℃、5%CO2培养箱中传代培养3代,取对数生长期细胞用于实验。
1.4 iNOS蛋白的测定 取对数生长期细胞,调整细胞密度为5×106/ml,接种于6孔板,2 ml/孔。18~20 h换含0.5%胎牛血清的RPMI 1640培养液,继续培养20~24 h使细胞同步化后,预先2 h加入10、20、40 μ mol/L 葛根素,再用1 μ g/ml LPS刺激细胞18 h。用冰冷的PBS洗涤细胞2次,弃上清液。采用非变性裂解缓冲液提取细胞总蛋白,测定蛋白浓度后,分装于-80 ℃保存待用。取蛋白样品40 μ g,加入5×SDS蛋白上样缓冲液,煮沸5 min后,以10%SDS-聚丙烯酰胺凝胶电泳分离;分离的蛋白用湿转法转移到PVDF膜,含5%脱脂奶粉 TBST 4℃封闭过夜;加入 1∶1000稀释的一抗(兔抗iNOS),室温震荡孵育 2 h,TBST洗涤3次,每次10 min,加入相应二抗(HRP标记的羊抗兔 IgG,1∶10000),室温震荡孵育 1 h,TBST洗涤4次,每次10 min。化学发光法显色拍照。以β-tubulin作为内参。
1.5 iNOS mRNA的测定 预先2 h加入同上浓度的葛根素,1 μ g/ml LPS刺激7 h。用冰冷的PBS洗涤细胞2次,弃上清液。按TRIzol试剂说明进行细胞总mRNA提取。细胞总mRNA溶于无Rnase水中,采用紫外分光光度计测定其浓度。引物序列为:上游引物 :5′-CCC TTC CGA AGT TTC TGG CAG C-3′,下游引物:5′-GGC TGT CAG AGC CTC GTG GCT T-3′;GAPDH 作为内参 ,上游引物 :5′-TGA AGG TCG GTG TGA ACG GAT TTG GC-3′,下 游引物:5′-CAT GTA GGC CAT GAG GTC CAC CA C-3′。根据一步法RT-PCR试剂盒提供的说明书进行RT-PCR反应。RT-PCR反应产物用1.5%琼脂糖凝胶电泳,溴化乙锭染色。电泳条带用数字成像系统进行分析和拍照。以GAPDH光密度值进行标准校正,计算iNOS产物的相对量。
1.6 统计学方法 所有实验结果重复3次,取平均值。计量资料结果用(±s)表示,多组间差异比较用单因素方差分析,显著性水平α=0.01。
2 结果
2.1 iNOS蛋白质表达 随着葛根素浓度的增加,iNOS蛋白质表达逐渐减少。见图1。
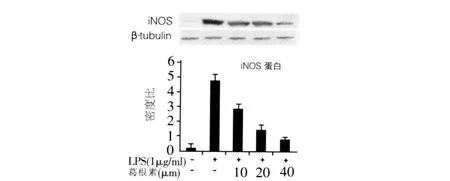
图 1 各组 RAW264.7细胞 iNOS蛋白质表达
2.2 iNOS mRNA表达 随着葛根素的浓度的增加,iNOS mRNA表达逐渐减少。见图2。
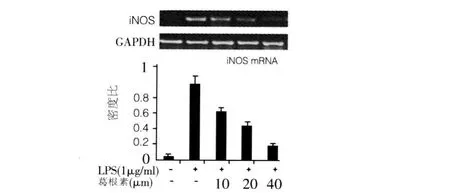
图2 各组RAW264.7细胞 iNOS mRNA表达
3 讨论
一氧化氮(NO)是由NOS催化左旋精氨酸(LArg)生成瓜氨酸的同时释放出来的。NOS主要有两种类型:结构型(cNOS)和诱导型(iNOS)。iNOS主要存在于巨噬细胞内,当内皮细胞受损时也可分泌。现有研究资料显示,在人和动物的AS斑块中,iNOS主要在巨噬细胞和平滑肌细胞中表达,iNOS产生的大量一氧化氮与过氧化物结合生成氧化性很强的过氧亚硝酸盐化合物,后者能使低密度脂蛋白发生氧化,或其产生的活性自由基产物引起酪氨酸硝基化或其他修饰,阻断磷酸化和脱磷酸化,干扰细胞正常的信号通路[5]。还有研究显示,iNOS在AS斑块深部表达,是血管壁损害及细胞变性、坏死的诱因之一[6-7]。
实验研究表明,黄酮类化合物能有效抑制巨噬细胞中iNOS的表达[8]。葛根素是野生植物葛根中异黄酮的主要有效成分之一,其化学名为4'7-二羟基-8-D-葡萄糖基异黄酮,一些基础研究表明,葛根素具有多种生理和药理活性,例如降低胆固醇[9]、抗氧化应激[10]、抗肿瘤[11]、改善胰岛素抵抗等[11]。其能否调节巨噬细胞表达iNOS无相关研究和报道。
我们发现,葛根素对 LPS诱导巨噬细胞 iNOS mRNA及其蛋白质表达抑制作用呈浓度依赖性,随着葛根素浓度的增加,iNOS mRNA及其蛋白质表达逐渐减少,基因表达和蛋白质表达相一致。因此我们推测,葛根素能作用于巨噬细胞,通过下调iNOS mRNA的表达,减少巨噬细胞表达iNOS蛋白质,从而达到抗炎、抗动脉粥样硬化的作用。
[1]Yan ZQ,Hansson GK.Innate immunity,macrophage activation,and atherosclerosis[J].Immunol Rev,2007,21(9):187-203.
[2]Upmacis RK,Crabtree MJ,Deeb RS,et al.Profound biopterin oxidation and protein tyrosine nitration in tissues of ApoE-null mice on an atherogenic diet:contribution of inducible nitric oxide synthase[J].Am JPhy siol Heart Circ Physiol,2007,293(5):H2878-2887.
[3]Park KH,Park YD,Han JM,et al.Anti-atherosclerotic and antiinflammatory activities of catecholic xanthones and flavonoids isolated from Cudrania tricuspidata[J].Bioorgan Med Chem Lett,2006,16(21):5580-5583.
[4]Xu X,Zheng X.Potential involvement of calcium and nitric oxide in protective effects of puerarin on oxygen-glucose deprivation in cultured hippocampal neurons[J].JEthnopharmacol,2007,113(3):421-426.
[5]Murakami A,Ohigashi H.Targeting NOX,INOS and COX-2 in inflammatory cells:chemoprevention using food phytochemicals[J].Inter JCancer,2007,121(11):2357-2363.
[6]Palombo F,Shen H,Benguigui LE,et al.Micro AT R-FTIR spectroscopic imaging of atherosclerosis:an investigation of the contribution of inducible nitric oxide synthase to lesion composition in ApoE-null mice[J].Analyst,2009,134(6):1107-1118.
[7]Perrotta I,Brunelli E,Sciangula A,et al.Inducible and endothelial nitric oxide synthase expression in human atherogenesis:an immunohistochemical and ultrastructural study[J].Cardiovasc Pathol,2009,18(6):361-368.
[8]Kim HK,Cheon BS,Kim YH,et al.Effects of naturally occurring flavonoids on nitric oxide production in the macrophage cell line RAW 264.7 and their structure-activity relationships[J].Biochem Pharmacol,1999,58(5):759-765.
[9]Chung MJ,Sung NJ,Park CS,et al.Antioxidative and hypocholesterolemic activities of water-soluble puerarin glycosides in HepG2 cells and in C57 BL/6J mice[J].Eur JPharmacol,2008,578(2-3):159-170.
[10]Hwang YP,Jeong HG.Mechanism of phytoestrogen puerarin-mediated cy toprotection following oxidative injury:estrogen receptordependent up-regulation of PI3K/Akt and HO-1[J].Toxicol Appl Pharmacol,2008,233(3):371-381.
[11]Yu Z,Li W.Induction of apoptosis by puerarin in colon cancer HT-29 cells[J].Cancer Lett,2006,238(1):53-60.

