我国部分地区牛支原体肺炎和关节炎的病原体诊断
冉智光,谢建华,骆 璐,杨泽林,凌洪权,苏承忠,熊仲良,范伟兴,米自由*
(1.重庆市动物疫病预防控制中心,重庆渝北401120;2.中国动物卫生与流行病学中心,山东青岛266032)
2009年4月以来,重庆等省市从省外引进的肉用牛群发生以呼吸道症状为主的传染病,主要表现为体温升高(39℃~40.5℃),咳嗽,气喘,鼻流粘液性或粘液脓性分泌物,关节肿大,跛行或不能站立。气管、支气管内有干酪样分泌物或乳白色泡沫,胸腔、心包积液,纤维蛋白性渗出,胸肺、膈肺粘连,肺脏质地变硬,表面有大小不等灰白(黄)色干酪样或化脓性坏死灶,切面呈干酪状,偶见白色脓肿。发病率20%~80%以上,死亡率5%~23.5%;在不治疗的情况下,死亡率可达50%以上。我们进行了一系列实验室检测,诊断该病是以牛支原体(Mycoplasma bovis)感染为主引起的疾病。现将结果报告如下。
1 材料和方法
1.1 样 品 采集自4个省市5个肉牛场表现较重呼吸道和关节炎症状病牛的肺、肝、脾、肾、淋巴结及渗出液等。
1.2 培养基 PPLO、血清肉汤、血清大豆胰酶肉汤、马丁肉汤、营养平板、血清平板、血清TSB、鲜血平板、麦康凯、EMB、HE、DHL、SS、TSI等培养基分别购自BD公司和杭州天和公司的冻干粉,按说明书或常规方法配制而成。
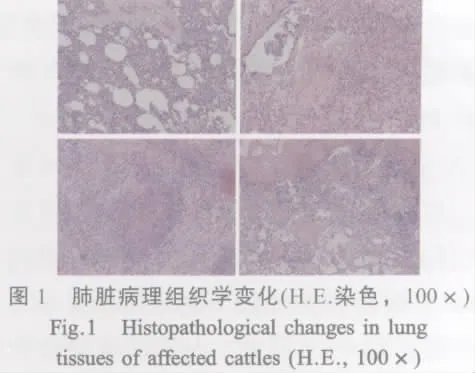
1.3 病理组织学检查 以多聚甲醛固定肺组织24 h~48 h,石蜡切片,H.E.染色,显微镜检。
1.4 病料直接PCR检测 将肺脏常规处理后,提取DNA,分别以丝状支原体丝状亚种[1]、牛支原体[2]、多杀性巴氏杆菌[3]、牛结核分枝杆菌[4]特异性引物进行PCR扩增。
1.5 细菌分离鉴定 取肺、肝、脾、肾、淋巴结及渗出液常规方法无菌接种各种增菌培养基、分离培养基和鉴别培养基于37℃自然空气或5%CO2培养,挑纯培养单菌落进行革兰氏染色、镜检。
1.6 真菌分离培养 取病料无菌接种沙堡琼脂平板37℃培养1 d~5 d,蘸取少量菌落与生理盐水制成涂片,显微镜检。
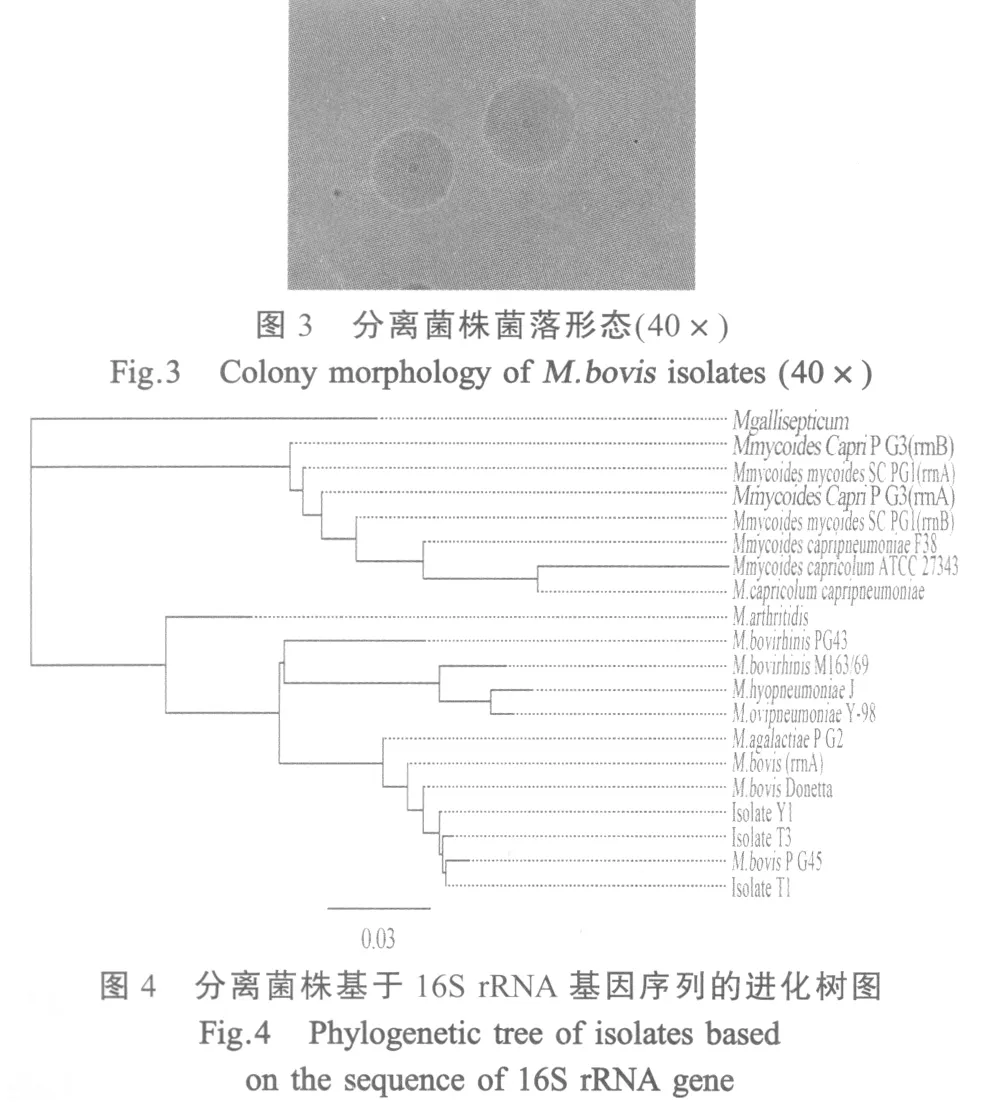
1.7 支原体分离鉴定 取肺等组织无菌接种以PPLO为基础的支原体液体筛选培养基和固体培养基,37℃5%CO2培养3 d~5 d,每天观察液体培养基的颜色变化,放大镜或显微镜下观察固体培养基上的菌落生长情况。对培养物以牛支原体特异性引物[2]和16S rRNA基因引物[5]进行PCR扩增,并进行序列测定和分析。
2 结果
2.1 病理组织学检查结果 肺脏的组织学变化主要表现为间质增生,肺泡间隔增宽和结构破坏,细支气管内炎性渗出;干酪样坏死灶内含大量嗜酸性细胞碎屑,周围淋巴细胞以及少量嗜中性粒细胞和单核细胞浸润,结缔组织增生形成纤维化(图1),呈卡他性支气管炎、坏死性化脓性支气管肺炎和纤维素性坏死性肺炎的特征。
2.2 PCR检测结果 5个牛场的肺组织,仅有牛支原体特异性引物扩增出预期大小(1912 bp)的片段(图2);丝状支原体丝状亚种、多杀性巴氏杆菌和牛分枝杆菌特异性引物的扩增结果均为阴性。

2.3 细菌分离结果 从肺脏等组织中分离到大肠杆菌(E.coli)、沙门氏菌(Salmonella)、葡萄球菌(Streptococcus)、链球菌(Staphylococcus)(表1),所有病料中均未分离到巴氏杆菌。

表1 细菌分离结果Table 1 The bacteria isolation from affected cattles
2.4 真菌分离结果 从1例肺脏分离到真菌,其菌落生长迅速,呈绒状或絮状,培养时间长后,中间呈暗烟绿色。挑培养物少许与生理盐水制成涂片、镜检,可见大量球形孢子,分生孢子头呈短柱状。经菌落特征和显微形态比对判断为烟曲霉。
2.5 支原体分离结果 肺组织无菌接种后96 h左右,液体培养基变黄,轻微浑浊;固体培养基长出细小菌落,显微镜下呈“煎蛋样”(图3)。3个分离株(Y1、T1、T3)16S rRNA全基因序列BLAST结果显示与GenBank中登录的牛支原体的同源性为99%~100%,与无乳支原体的同源性为98%~99%,与丝状支原体的同源性只有81%左右,而3个分离株之间的同源性达到99.83%。将3个分离株16S rRNA全基因序列与部分常见支原体代表菌株作遗传进化图,结果(图4)显示与牛支原体代表株PG45亲缘关系最近,与鸡毒支原体最远,与丝状支原体代表菌株PG1和PG3位于两个完全不同的分支上。16S rRNA全基因序列分析表明分离株不可能是丝状支原体,应为牛支原体或无乳支原体。以牛支原体特异性引物检测,从4个分离株中都扩增到牛支原体oppD/F基因特异性片段,测序结果显示与牛支原体的同源性达到99%以上,与无乳支原体的同源性接近或等于90%,结果证实所分离菌株为牛支原体。
3 讨论
牛支原体于1961年从患乳房炎病牛中首次分离到[6],可以引起牛的肺炎、关节炎、乳房炎、角膜结膜炎[7]。研究证明牛支原体是牛呼吸道疾病的主要病因,已成为欧洲和北美牛群中呼吸道疾病和多发性关节炎的重要病原,而且牛支原体感染后可明显增加其他病原的继发感染,对养牛业危害比较严重[2,7-8]。重庆等4省市5个发病牛群以肺炎和关节炎为主要临床特点,其卡他性支气管肺炎、坏死性化脓性支气管炎和纤维素性坏死性肺炎组织学变化也与牛支原体肺炎基本一致[9-10]。从5个牛场病牛肺组织中均检测到牛支原体特异性DNA片段;从4个场的病牛肺组织中都分离到支原体(1#场因肺组织严重腐败而未分离到)。经16S rRNA基因和oppD/F基因序列分析,从分子水平上鉴定分离株为牛支原体(M.bovis)。综上所述,我们认为4省市5个牛场“疑似牛肺疫”的疫情主要是由牛支原体感染而引起的牛支原体肺炎,部分病牛同时伴随关节炎,而并非丝状支原体丝状亚种(Mycoplasma mycoidessubsp.mycoides)所致的牛传染性胸膜肺炎(牛肺疫)。长途运输、饥渴、拥挤、混群、环境突变是几起疫情发生的主要诱因,大肠杆菌、沙门氏菌、链球菌、葡萄球菌和真菌等继发感产生了协同作用,进一步加重了病情,加之用药不合理,导致较高的死亡率。
我国已于1996年宣布消灭了牛肺疫,由于牛支原体肺炎在临床症状上与牛传染性胸膜肺炎牛肺疫有相似之处,在基层诊断工作中可能引起误解。因此对牛支原体实施及时和正确的诊断,对排除牛肺疫、并尽早得到OIE对我国无牛肺疫的认证具有十分重要的意义。在牛支原体肺炎和牛肺疫的诊断上,仅仅分离培养还不能将牛支原体与牛肺疫病原体(丝状支原体丝状亚种)以及无乳支原体区别开。目前最简单、快速和准确的方法是PCR方法。16S rRNA基因在进化过程中相对保守,在细菌学分类上具有重要意义。针对16S rRNA基因的PCR可以将牛支原体与丝状支原体区别开,但是牛支原体与无乳支原体曾同属一个种,两者亲缘关系很近,16S rRNA基因同源性很高,即使测序可能区分不开。序列比较显示编码牛支原体和无乳支原体寡肽膜透酶(OPP)的基因差异较大。本研究使用牛支原体oppD/F基因特异性引物只能扩增出牛支原体的特异片段,不但可以与丝状支原体丝状亚种鉴别,也可以用于牛支原体与无乳支原体的鉴别[2]。
近年来,我国多个省市已出现类似病例,个别省已证实牛支原体肺炎的存在[5,11]。随着我国奶业和肉牛产业的较快发展,牛群调运将会日益频繁,该病传播扩散的风险也将增高,应引起各级兽医部门的重视,提高对牛支原体肺炎的认识。该病的预防主要靠加强饲养管理,保证营养,做好日常保健,提高机体抵抗力,降低其它病原的感染机会,尽量减少长途运输、极端天气、拥挤、饥渴、混群等应激因素或降低其造成的影响。该病发生后,在早期使用针对性药物如泰乐菌素、土拉霉素、长效土霉素、林可霉素、泰妙菌素、氧氟沙星等抗生素,辅以黄芪多糖等免疫增强剂治疗可以获得较好的疗效,但是使用剂量要足,并保证足够的疗程。
致谢:感谢辛九庆博士的支持和建议。
[1]辛九庆.牛传染性胸膜肺炎诊断技术与分子流行病学研究[D].长春:吉林农业大学,2007.
[2]Rifatbegovic M,Assuncao P,Poveda J B,et al.Isolation ofMycoplasma bovisfrom the respiratory tract of cattle in Bosnia and Herzegovina[J].Vet Rec,2007,160:484-485.
[3]Townsend K M,Frost A J,Lee C W,et al.Development of PCR assay for species and type-specific identification ofPasteurella multocidaisolates[J].J Clin Microbiol,1998,36(4):1096-1100.
[4]刘思国,王春来,宫强,等.牛分枝杆菌特异性PCR检测方法的建立及初步应用[J].中国预防兽医学报,2006,28(1):80-83.
[5]辛九庆,李媛,郭丹,等.国内首次从患肺炎牛肺脏中分离到牛支原体[J].中国预防兽医学报,2008,30(9):661-664.
[6]Hale H H,Helmboldt C F,Plastridge W N,et a1.Bovine mastitis caused byMycoplasma species[J].Cornell Vet,1962,52:582-591.
[7]Caswell J L,Archambault M.Mycoplasma bovispneumonia in cattle[J].Animal Health Res Rev,2008,8(2):161-186.
[8]Nicholas R A J,Ayling R D.Mycoplasma bovis:disease,diagnosis,and control[J].Vet Science,2003,74:105-112.
[9]Adegboye D S,Hailbur P G,Cavanaugh D L,et al.Immunohistochemical and pathological study ofMycoplasma bovis-associated lung abscesses in calves[J].J Vet Diagnostic Invest,1995,7:333-337.
[10]Radaelli E,Luini M,Loria G R,et al.Bacteriological,serological,pathological and immunohistochemical studies ofMycoplasma bovisrespiratory infection in veal calves and adult cattle at slaughter[J].Res Vet Science,2008,85:282-290.
[11]石磊,龚瑞,尹争艳,等.肉牛传染性牛支原体肺炎流行的诊断[J].华中农业大学学报,2008,27(5):629-633.

