染料木素的药代动力学研究
赵绿英(综述) 黄红林(审校)
南华大学药物药理研究所(421001)
染料木素(genistein,GEN)又称金雀异黄素、5,7,4′-三羟基异黄酮、染料木黄酮、5,4'-三羟基异黄酮、染料木因,以染料木苷(genistein-7-glucoside,genistin,GEN-glu)广泛存在于大豆、三叶草、葛根、槐花、槐角、染料木(金雀花)和广豆根等豆科植物和谷物中;是一种强效、特异蛋白酪氨酸激酶抑制剂[1]。
染料木素分子式(图1):C15H10O5,相对分子质量为270.23;雌二醇分子式(图2):C18H24O2,相对分子质量272.39。
GEN是一种天然存在的异黄酮、酚类、带芳香A-环的三苯基化合物,在分子的相对两极带有两个酚羟基,其结构与雌二醇(estradiol,ER)类似,特别是它的4′-和7-羟基基团的间距及酚环与ER的结构相似;分子量与ER近似,且能低亲和地结合雌激素受体和性激素蛋白,从而使GEN发挥雌激素样作用和抗雌激素作用,后者主要与ER受体竞争性结合产生,因此又称为植物雌激素[2]。GEN具有多种生物活性和药理作用,能抑制雌激素相关肿瘤、影响骨代谢、抗炎、抗氧化、降血脂、维持正常脉管反应性等作用[2,3];现已广泛应用于医药、保健食品(营养制品和功能性食品)等领域。临床研究表明,GEN对乳腺癌和前列腺癌、心血管疾病和绝经后综合症等具有很好的防治作用。
GEN在胃肠道吸收迅速,由于肝肠循环而具有较高的生物利用度,在组织中分布有显著的剂量依赖性及靶向性,其吸收、代谢与排泄存在着性别和个体差异,主要在肝内代谢,经肾脏随尿排泄。GEN的药代动力学研究已成为当今研究热点。进一步归纳整理其在动物和人体内的吸收、组织分布、代谢、排泄等药动学研究资料十分必要,对指导临床合理用药等具有重要意义。
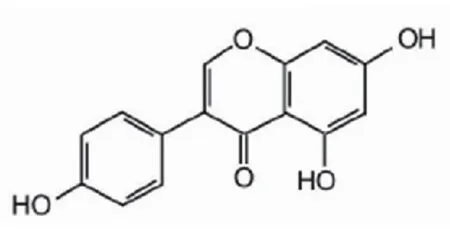
图1 染料木素的化学结构
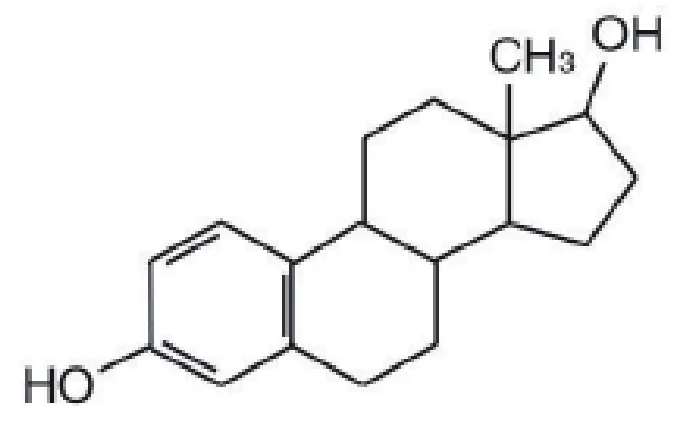
图2 雌二醇的化学结构
1 动物体内的药代动力学
1.1 吸收动力学研究与吸收模型选择
GEN在豆科植物中通常以无活性的糖苷形式存在,只有经肠道菌群的葡萄糖苷酶分解后,形成非糖苷型才具有生物活性。未被肠道菌群分解的结合型GEN 不易被吸收,直接从胆汁分泌入肠道排出体外;去糖苷型的GEN经肝肠循环,可与糖苷重新结合形成无活性的化合物。研究表明乳糖酶与小肠GEN-glu的吸收有关,同时大肠内细菌去糖甲基化作用弥补了GEN吸收的减少[4]。GEN比GEN-glu相差一个葡萄糖基,但二者在胃肠道中的吸收速度和程度却不同。
大鼠和人体小肠内有相似的药物吸收表型和转运表达方式,而两个物种肠道代谢酶(如CYP3A4/CYP3A9与UDPG)的表达水平和方式不同;大鼠模型可预测口服药物在人体小肠内的吸收情况,但不能预测人体药物代谢和生物利用度[5]。
1.1.1 大鼠在体及离体
King等[6]首次采用大鼠在体模型研究了GEN吸收药代动力学发现GEN与GEN-glu在大鼠体内吸收程度相似;Kwon等[7]研究表明,GEN是以GEN-glu形式吸收,GEN与GEN-glu在小肠上皮细胞均以被动转运方式稳定吸收。Wang等[8]研究发现,GEN大鼠体内存在肝肠循环,且吸收与性别有关,雌性大鼠吸收量大于雄性大鼠。Zhou等[9]采用非房室药物代谢动力学分析方法,发现大鼠灌胃给予不同剂量GEN后,吸收迅速,观察到明显的吸收双峰现象,第2主峰明显比第一主峰低。随剂量增加而其最大血药浓度Cmax与曲线下面积AUC0-t也呈非线性、剂量依赖性方式增加。
Andlauer等[10]在大鼠离体小肠吸收灌流模型观察到GEN在肠腔吸收良好,生物利用性高,GEN葡萄糖醛酸化作用在小肠壁;与Sfakianos等使用大鼠翻转肠囊模型观察的结果一致;而在小肠没有观察到GEN的硫酸盐结合物,却与文献发现大鼠在体胆汁和尿道的代谢产物中能观察到硫酸盐结合物不符[7,11,12];故认为其硫酸酯化作用可能在肝脏,而不在小肠;GEN总回收率高达99.8%,表明在小肠壁没有微生物的降解作用。大鼠在体肠灌流模型结果表明GEN在小肠上段快速吸收并进行广泛的II相代谢(最高达40%)即葡萄苷酸化和硫酸化作用,GEN口服生物利用度低的主要原因不是吸收差,而是小肠内广泛的Ⅱ相代谢所致[13]。
1.1.2 猫、Beagle犬、猪在体
Cave等[14]使用GEN给猫灌胃后,采用非房室模型分析发现GEN口服吸收差且结合率高。Beagle犬灌胃给予单剂量GEN后吸收迅速,在Beagle犬体内过程符合一室开放模型[15];Beagle犬灌胃给予不同剂量GEN后,首过代谢突出,血浆中GEN主要以GEN-glu形式存在;在一定范围内随给药剂量增加,母体药物的吸收量趋于饱和。在Beagle犬体内过程符合二室开放模型[16]。Walsh等[17]首次采用幼猪在体回肠插管模型,发现在猪肠道内的GEN-glu须转化为GEN后才被广泛重吸收,发生了相对有效的微生物代谢作用,故在研究GEN代谢产物的吸收性代谢时,选择猪模型可能有其独特的作用。
1.1.3 Caco-2细胞模型
Liu等[13]在Caco-2细胞模型中发现:GEN的渗透性比其苷大5倍(P<0.05);GEN能从Caco-2单层细胞(基)底外侧快速吸收到顶侧;GEN透过Caco-2细胞单层膜具有明显的剂量依赖性、温度依赖性和可饱和性[18],结果表明染料木素跨膜转运是载体介导的主动转运过程。
1.2 分布
GEN在大鼠体内组织分布浓度呈现明显的靶向性,尤其在生殖器官中分布较高,原因可能与生殖器官中雌激素受体或相关结合蛋白如性激素结合球蛋白和白蛋白浓度相对较高有关;同时还存在性别差异:♀大鼠相应器官中含量高于♂大鼠 ,尤以♀大鼠肝中含量最高,♂大鼠脑中含量最低[19]。而Wang等[8]采用♀♂大鼠灌胃给予GEN(9mg/kg)后发现在性器官中的分布具有显著差异:但其他组织器官内的分布未观测到明显的雌雄差异。
妊娠期大鼠经口给予内含GEN食物,发现在胎盘组织中分布的GEN浓度比其两结合型浓度均高,认为妊娠期胎盘是GEN有效作用的靶器官[20]。
1.3 代谢
在体内外及不同组织器官中,GEN的生物转化有多种形式,主要转化途径为葡糖醛酸化、硫酸酯化等代谢;不同文献所报道的代谢产物不尽相同。
1.3.1 大鼠在体
据文献报道:在GEN大鼠的尿液或胆汁中分离出最主要的3种主要产物分别为GEN-7-O-β-D-glu、GEN-4′-O-sulfate、GEN-4′-O-sulfate -7-O-β-D- glu;在大鼠和人体体外肝微粒体实验已经鉴定出8-OH-GEN、6-OH-GEN 和3′-OH-GE,而在肝细胞鉴定GEN-4'-O-glu或sulfate、GEN-4'-O-sulfate-7-O-glu、GEN-7 -O-glu or sulfate;研究表明,♀♂大鼠体内代谢产物、子宫和前列腺的放射性存留物分别是以GEN-glu和4-羟苯基-2-丙酸(4-Hydroxyphenyl-2-propanoic acid)为主,微量的母体化合物(P<0.05)[7]。而Poulsen等[21]发现GEN在去卵巢大鼠体内的主要代谢产物是4-乙苯酚(p-ethylphenol,对乙苯酚)。
1.4 排泄
GEN主要经肾脏随尿排泄,其次随胆汁经消化道排泄。
1.4.1 大鼠在体
Zhou等[9]以不同剂量(6.25、12.5、50mg/kg)GEN大鼠灌胃后,发现大鼠胆汁和尿液的排泄产物均以GEN-glu为主,且排泄量均呈现明显的非线性剂量依赖性特征,但尿液与胆汁排泄相比,尿液中GEN及GEN-glu排泄物量比胆汁多;这与文献[11]结论一致。因此服用GEN药物或富含GEN的保健品时,剂量不宜过高,以达到最高生物利用度为佳。
1.4.2 Beagle犬
Zhou等[15]在Beagle犬灌喂给予GEN后的血浆、尿及粪便中未检测到GEN-glu,GEN主要以原型经尿和粪便排出体外,而且在Beagle犬体内的代谢过程明显存在个体差异,体内过程符合一室开放模型。
1.4.3 Caco-2细胞模型
Chen等[12]在Caco-2细胞模型中检测GEN的主要代谢产物是GEN-glu,GEN-glu多在基底外侧排泄;而GEN-sulfate排泄后则进入顶面;GEN结合型极化排泄物是通过多药抗药相关蛋白(multidrug resistance-related protein,MRP)抑制剂白三烯和有机阴离子转运载体(organic anion transporter,OAT)抑制剂雌酮硫酸盐结合完成;认为GEN的肠道处置存在结构依赖性、极化性和MRP、OAT介导的特性。
1.4.4 PBPK模型
由于GEN胆汁排泄的复查性,且具有浓度依赖抑制作用,Zager等[22]精心设计了生理药物代谢动力学(physiologically based pharmacokinetic,PBPK)数学模型,用一个状态依赖性延迟的非线性微分方程系统描述GEN的胆汁排泄,同时还发现GEN暴露程度与靶组织剂量有关。
2 人体内的药代动力学
富含GEN营养补充剂或新药已广泛进入Ⅰ期临床研究,陆续揭示了许多有关GEN人体药动学数据,为染料木素防治激素相关肿瘤、心血管疾病等合理用药提供有价值的参考信息。
2.1 吸收
研究表明,人体食用富含GEN的大豆食品后,血浆浓度在1h、5~8h先后出现明显的GEN吸收双峰现象,主要是GEN-glu的肝肠循环引起;在健康成年人体内GEN比GEN-glu不但吸收快,而且能较长时间维持较高血浆浓度;健康绝经前妇女摄入较高剂量[(13)C]GEN后,体内[(13)C]GEN吸收速率受到限制,且具有可饱和性[23]。Gardner等[24]在健康成年人体内比较两个富含GEN的不同剂量大豆异黄酮片剂的药代动力学特征,发现GEN在高剂量时血药浓度呈现饱和状态。说明在人体内GEN跨膜转运也是载体介导的主动转运过程。
Walsh等[25]采用回肠造瘘术研究GEN在人体小肠吸收和代谢,发现回肠造瘘术受试者与对照组吸收GEN-glu程度一致,小肠能有效降解糖苷。
2.2 分布
GEN在人体内分布报道甚少。Guy等[26]采用LC -ESI-MS/MS方法,从良性前列腺肿瘤患者服用富含GEN的Evestrel®胶囊后的血液和前列腺检测出:前列腺组织的GEN浓度比血浆低;而动物实验中GEN在雄性动物组织前列腺中分布浓度较其他组织高[19],以及有限的人体内实验研究也表明前列腺组织富集的GEN浓度比血浆浓度高如4倍[27]等。
GEN在美容外科手术者乳腺组织匀浆中的分布浓度极低,比血浆、尿液样品浓度相应地低100倍左右,所以GEN的血浆浓度不能衡量暴露的精确测定浓度,而必须检测摄入GEN后有关组织的分布浓度[28]。Bolca 等[29]用LC/MS检测给予健康妇女富含GEN的营养补充剂,并检测她们外科美容复位手术后收集的血液和乳腺活组织的GEN浓度,发现GEN在有危及健康影响的乳腺组织中已达到暴露浓度。而另研究[30]表明,采用健康、足孕单胎胎盘的双重循环离体灌流模型,发现GEN在浓度适宜时能通过胎盘,同时胎盘代谢酶能使少数GEN结合从而失去雌激素活性的GEN-glu或GEN- sulfate。
2.3 代谢
Guy等[26]从良性前列腺肿瘤患者服用富含GEN的Evestrel®胶囊后的血液和前列腺中检测出代谢产物均是2-单葡萄糖醛酸化合物和GEN-2-单葡萄糖醛酸化合物;首次认为GEN在人体前列腺组织主要以其葡萄糖醛酸苷形式存在。
4-乙苯酚是大鼠体内GEN给药后的主要代谢产物[21],然而4-乙苯酚是否为人体的主要代谢产物还有待更深入研究。
2.4 排泄
健康人体内单次食用富含GEN食物后检测到GEN餐后的尿平均排泄率为(62 ± 6)%;在健康男性中单剂量给予GEN纯净的大豆异黄酮等后,发现GEN能快速从血浆中清除并随尿排泄;用MS法从健康人群(绝经前的妇女)服用[(13)C]GEN标记的食物后的尿中测得[(13)C]GEN平均回收率为摄入剂量的9%,说明尿中GEN浓度与血浆Cmax相关性差[23]。
3 结 语
GEN是一种存在于植物中的内分泌干扰物质,毒性低、药理活性较强,对人体健康既有利也有弊;因此,GEN药代动力学研究将对GEN的营养学、药理学、治疗学及开发研究等方面提供实验和理论依据,对未来进行全面的临床药物试验、完成快速准确的GEN个体化给药打下了良好的基础;而GEN药物制剂在人体内的药代动力学研究、GEN与其他药物的药代动力学相互作用研究等尚未涉及,有待进一步探讨和研究,为制订科学、合理的联合用药方案提供依据。
[1]Akiyama T,Ishida J,Nakagawa S,et al.Genistein,a specific inhibitor of tyrosine-specific protein kinases[J].J Biol Chem,1987,262(12):5592–5595.
[2]Dixon RA,Ferreira D. Genistein [J].Phytochemistry,2002,60(3):205-211.
[3]Si H,Liu D.Phytochemical genistein in the regulation of vascular function:new insights[J]. Curr Med Chem,2007,4(24):2581-2589.
[4]Tamura A,Shiomi T,Hachiya S,et al.Low activities of intestinal lactase suppress the early phase absorption of soy isoflavones in Japanes adults [J].Clin Nutr,2008,27(2): 248-253.
[5]Cao X,Gibbs ST,Fang L,et al.Why is it Challenging to Predict Intestinal Drug Absorption and Oral Bioavailability in Human Using Rat Model[J].Pharm Res,2006,23(8):1675-1686.
[6]King RA,Broadbent JL,Head RJ.Absorption and excretion of the soy isoflavone genistein in rats[J]. J Nutr,1996,126(1):176-182.
[7]Kwon SH,Kang MJ,Huh JS,et al.Comparison of oral bioavailability of genistein and genistin in rats [J]. Int J Pharm,2007,337(1/2):148-154.
[8]Wang R,Zhou S,Mei Q,et al.Study on gender-based differences in pharmacokinetics of genistein[J].Chin Pharm J,2005,40(20):1575-1578.
[9]Zhou S,Hu Y,Zhang B,et al.Dose-dependent absorption,metabolis m,and excretion of genistein in rats [J].J Agric Food Chem,2008,56(18):8354-8359.
[10]Andlauer W,Kolb J,Fürst P.Absorption and metabolism of genistein in isolated rat small intestine [J]. J Nutr,2000,130(4):843-846.
[11]Bursztyka J,Perdu E,Tulliez J. Comparison of genistein metabolism in rats and human using liver microsomes and hepatocytes[J]. Food ChemToxicol,2008,46(3):939-948.
[12]Chen J,Lin H,Hu M.Absorption and metabolism of genistein and its five isoflavone analogs in the human intestinal Caco-2 model[J].Cancer Chemother Pharmacol,2005,55(2):159-169.
[13]Liu Y,Hu M. Absorption and metabolism of flavonoids in the Caco-2 cell culture model and a perused rat intestinal model[J].Drug Metab Dispos,2002,30(4):370-377.
[14]Cave NJ,Backus RC,Marks SL,et al. The bioavailability and disposition kinetics of genistein in cats[J]. J Vet Pharmacol Ther,2007,30(4): 327-35.
[15]Zhou SY,Mei QB,Yang XB,et al.Pharmacokinetics of genistein in Beagle dogs [J].Acta Pharmaceutia Sinica,2003,38(9):646-649.
[16]Zhou SY,Mei QB,Wang RT,et al.Dose-dependent pharmacokinetic study of genistein in Beagle dogs [J].Acta Pharmaceutica Sinica,2005,40(6): 553-556.
[17]Walsh KR,Haak SJ,Fastinger ND,et al.Gastrointestinal absorption and metabolism of soy isoflavonoids in ileal-canulated swine[J].Mol Nutr Food Res,2009,53(2):277-286.
[18]Oitate M,Nakaki R,Koyabu N,et al.Transcellular transport of genistein,a soybean-derived isoflavone,across human colon carcinoma a cell line (Caco-2) [J].Biopharm Drug Dispos,2001,22(1): 23-29.
[19]Chang HC,Churchwell MI,Delclos KB,et al.Mass spectrometric determination of Genistein tissue distribution in diet-exposed Sprague-Dawley rats[J]. J Nutr,2000,130(8):1963-1970.
[20]Soucy NV,Parkinson HD,Sochaski MA,et al. Kinetics of genistein and its conjugated metabolites in pregnant Sprague-Dawley rats following single and repeated genistein administration [J].Toxicol Sci,2006,90(1):230-240.
[21]Poulsen RC,Loots du T,Moughan PJ,et al.Ileal and faecal digestibility of daidzein and genistein and plasma bioavailability of these isoflavones and their bioactive metabolites in the ovariectomised rat[J]. Mol Nutr Food Res,2009,53(1):27-35.
[22]Zager MG,Schlosser PM,Tran HT.Delayed Nonlinear PBPK Model for Genistein Dosimetry in Rats[J].Bull Mathem Biol,2007,69(1):93–117.
[23]Nielsen IL,Williamson G. Review of the factors affecting bioavailability of soy isoflavones in humans[J].Nutr Cancer,2007,57(1):1-10.
[24]Gardner CD,Chatterjee LM,Franke AA. Effects of isoflavone supplements vs. soy foods on blood concentrations of genistein and daidzein in adults[J]. J Nutr Biochem,2009,20(3):227-234.
[25]Walsh KR,Haak SJ,Bohn T,et al.Isoflavonoid glucosides are deconjugated and absorbed in the small intestine of human subjects with ileostomies[J].Am J Clin Nutr,2007,85(4):1050-6.
[26]Guy L,Védrine N,Urpi-Sarda M,et al.Orally administered isoflavones are present as glucuronides in the human prostate[J].Nutr Cancer,2008,60(4):461-468.
[27]Gardner CD,Oelrich B,Liu JP,et al. Prostatic soy isoflavone concentrations exceed serum levels after dietary supplementation[J]. Prostate,2009,69(7):719-726.
[28]Maubach J,Depypere HT,Goeman J,et al. Distribution of soyderived phytoestrogens in human breast tissue and biological fluids[J].Obstet Gynecol,2004,103(5):892-898.
[29]Bolca S,Urpi-Sarda M,Blondeel P,et al.Disposition of soy isoflavones in normal human breast tissue[J]. Am J Clin Nutr,2010,91(4):976-984.
[30]Balakrishnan B,Thorstensen EB,Ponnampalam AP,Mitchell MD.Transplacental Transfer and Biotransformation of Genistein in Human Placenta[J]. Placenta,2010,31(6):506-511.

