重组人生长激素对大鼠胆道梗阻-再通的防治作用
齐庆安,祝建勇,王锦波
梗阻性黄疸(obstructive jaundice,OJ)是临床上各种原因引起的肝外胆管阻塞后所发生的胆汁瘀积症,由于胆汁瘀积,常可导致复杂而严重的全身性病理生理改变。传统的围手术期治疗方法疗效欠佳,而重组人生长激素(recombinant human growth hormone,rhGH)在OJ时对肝损害的防治作用的研究报道很少。本研究采用胆道梗阻-再通大鼠模型,观察应用重组人生长激素后动物血生化和血清TNF-α的变化,现报告如下。
1 材料与方法
1.1 实验动物与分组 6~8周龄Spragure-Dawley大鼠,雌雄不限,体重180~220 g,随机将大鼠分为3组。A组:假手术组(sham operation),只游离出胆总管但不结扎,7 d后再次开腹分离粘连后关腹;B组:胆道梗阻(common bile duct ligation,CBDL)-再通(bile duct reconstruction,BDR)组,开腹游离出胆总管,3-0号丝线双重结扎,术后第7天再次开腹,行内引流术,同时,从术后第1天开始,每日皮下注射等体积的0.9%NaCl;C组:胆道梗阻-再通-rhGH注射组,手术方式同B组,从术后第1天开始,给予rhGH(瑞士Serono大药厂生产Saizen,4U/支)0.5U/kg皮下注射,1次/d,直至动物被处死。分别在A、B、C 组大鼠第一次手术后 1、3、7、10、14 d 5 个时相点(每个时相点保证有6只动物),于下腔静脉穿刺取血4~5 ml,4℃,3 000×g 离心 15 min,取上清置于-70℃冰箱保存待测。采血后,经门静脉灌注0.9%NaCl注射液冲去血液,取肝组织,在10%甲醛水溶液中固定12~24 h再修剪成1.0 cm×0.5 cm×0.5 cm组织块;另在3%戊二醛水溶液中修剪成0.5mm×0.5mm×0.5 mm的组织块,固定2~4 h,备电镜检查。
1.2 生化检测 采用北京中山公司提供的谷丙转氨酶检测试剂盒(赖氏法)检测ALT的变化,总胆红素检测试剂盒(重氮法)检测TBIL的变化,采用上海长征医学科技有限公司提供的总胆汁酸检测试剂盒(循环酶法)检测TBA的变化,采用解放军总医院科技开发中心放免所提供的肿瘤坏死因子α检测试剂盒(放免法)检测TNF-α的变化。
1.3 统计学处理 计数资料采用χ2检验。计量资料求出±s,应用SPSS 11.5软件进行统计学分析,组间均数的比较采用双因素方差分析。
2 结 果
2.1 SD大鼠术后一般情况 B组术后7 d存活率为88.0%(88/100),死亡的12只动物中因麻醉意外死亡1只,胆漏2只,全身衰竭9只;胆道再通术后7 d存活率为69.2%(36/52),死亡的16只中麻醉意外3只,全身衰竭4只,出血4只,术后胆漏继发腹腔内感染5只。B组术后14 d大鼠累积死亡率为41.9%(13/31),与C组的累积死亡率14.3%(3/21)相比,具有统计学差异(P<0.05)。
2.2 血清ALT、TBIL及TBA水平变化 B、C组CBDL术后 ALT、TBIL、TBA 水平显著升高(P<0.01),BDR术后上述指标逐步好转,至术后14 d时接近但仍显著高于A组水平(P<0.05);给予rhGH的C组大鼠各项指标的改善明显优于0.9%NaCl注射的B组,随用药天数的增加,效果更趋明显,特别是在术后14 d ALT水平已回落至A组水平,并显著低于B组(P<0.05)。
2.3 血清TNF-α的水平变化 B、C组CBDL术后TNF-α浓度上升,随梗阻时间的延长,与A组逐渐出现非常显著的差异(P<0.01)。BDR术后TNF-α逐渐下降,C组下降更为显著(P<0.05),于术后7 d达到A组水平,且与B组具有统计学差异(P<0.05)。见表1。
表1 各组大鼠术后不同时间血清TNF-α水平(ng/ml,±s)
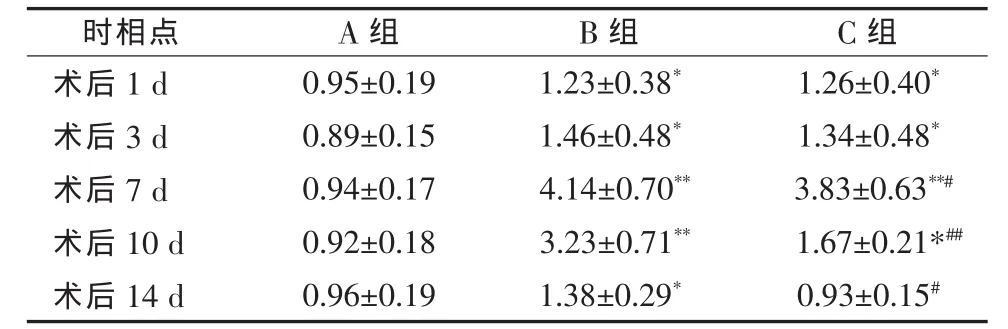
表1 各组大鼠术后不同时间血清TNF-α水平(ng/ml,±s)
与 A 组比较,*P<0.05,**P<0.01;与 B 组比较,#P<0.05,##P<0.01
时相点 A组 B组 C组术后 1 d 0.95±0.19 1.23±0.38* 1.26±0.40*术后 3 d 0.89±0.15 1.46±0.48* 1.34±0.48*术后 7 d 0.94±0.17 4.14±0.70** 3.83±0.63**#术后 10 d 0.92±0.18 3.23±0.71** 1.67±0.21*##术后 14 d 0.96±0.19 1.38±0.29* 0.93±0.15#
2.4 胆道梗阻-再通术后肝脏病理形态学改变 A组大鼠呈正常肝小叶结构。B、C组大鼠CBDL术后肝小叶结构尚完整,肝细胞淤胆,中央静脉周围肝细胞内可见无折光性、棕褐色胆色素颗粒沉积,随梗阻时间的延长,肝细胞内色素颗粒增大更加显著,部分肝细胞浊肿变性、坏死,部分肝细胞脂肪变性。汇管区明显炎性细胞浸润,小胆管增生,胆栓形成(图1)。胆道再通术后,汇管区仍有较多炎性细胞浸润,肝细胞坏死少见,总体上解除梗阻后病理改变明显减轻(图2)。
透射电镜观察显示,A组肝细胞形态正常。B、C组CBDL术后肝细胞胞质疏松,核圆缩,线粒体明显肿胀,嵴断裂、减少,基质透明性变,以致线粒体呈空泡状,内质网扩张,毛细胆管管径增加(图3)。BDR术后肝细胞线粒体仍显著肿胀,微绒毛数量增加,毛细胆管腔内可见散在微绒毛膜泡。C组肝细胞线粒体肿胀、毛细胆管扩张以及单位面积微绒毛数量减少均较B组减轻,至术后14d时,肝细胞及毛细胆管形态恢复较好,微绒毛数量明显增加(图4)。
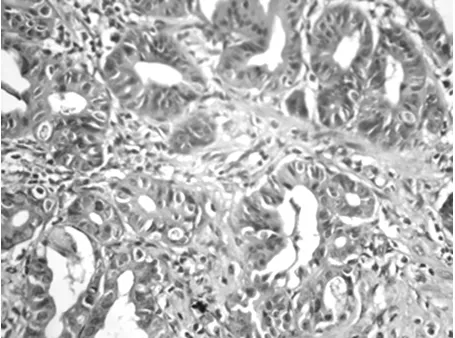
图1 CBDL术后7 d肝组织学改变(HE×400)汇管区见中性粒细胞浸润,小胆管增生
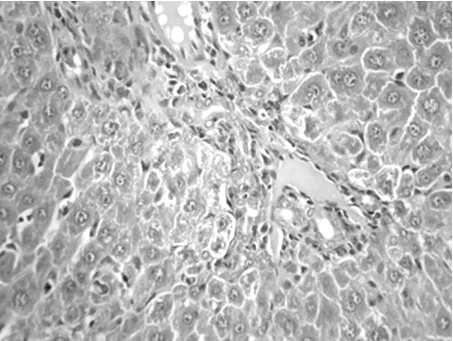
图2 BDR术后7 d肝组织学改变(HE×400)肝细胞排列紊乱,细胞质疏松,汇管区见中性粒细胞浸润,小胆管增生,肝细胞坏死减少
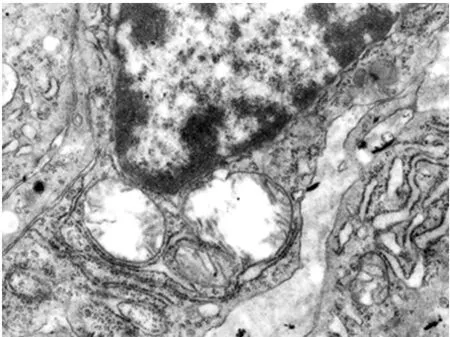
图3 B组胆道梗阻术后7 d超微结构改变(×10 000)肝细胞线粒体肿胀,基质密度减低呈空泡状,嵴断裂减少
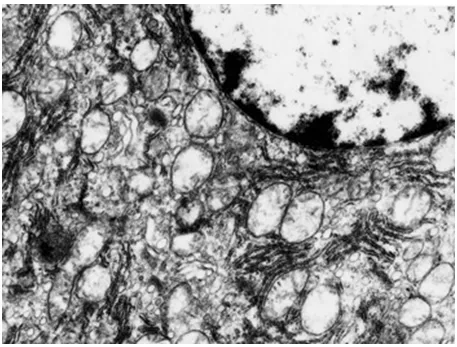
图4 C组胆道再通术后7 d超微结构改变(×7 000)肝细胞线粒体肿胀减轻,基质密度稍低
3 讨 论
梗阻性黄疸是临床上常见的疾病,患者术后容易发生急性胃黏膜病变、急性肾功能衰竭、免疫功能障碍乃至全身炎症反应综合征、凝血机制紊乱甚至弥散性血管内凝血等严重并发症,病死率亦居高不下。生长激素是脑垂体前叶分泌的一种蛋白质,由191个氨基酸残基组成的多肽,其主要作用是促进生长发育和影响代谢,既往主要用于儿童生长激素缺乏症的治疗,近年来随着临床研究的深入,发现生长激素具有促进肝细胞、胃肠黏膜上皮细胞、烧伤后残存上皮细胞和软骨细胞等多种细胞增殖的能力[1]。目前已经在肠瘘、慢性消耗性疾病及全胃肠外营养支持治疗中得到广泛应用,但在梗阻性黄疸中的研究尚缺乏[2~4]。
梗阻性黄疸常伴随内毒素血症,而TNF-α是其毒性的主要执行者。TNF-α可激活细胞因子的级联反应,诱发白细胞介素(interleukin,IL)-1、IL-6、IL-8、 血小板活化因子(platelet activating factor,PAF)、前列腺素和白三烯等的分泌,激发炎症连锁反应,导致所谓 “瀑布效应”[5~7]。 本文结果显示,TNF-α在CBDL术后1d即有明显上升(P<0.05),并随梗阻时间的延长而逐步升高,与假手术组逐渐出现非常显著的差异(P<0.01),至术后第7天时B组TNF-α的水平为A组的4.4倍;同时其对肝脏的负面影响也逐渐加重,表现为ALT、TBIL、TBA的显著升高,至术后第7天时分别增高为A组的3.2、34.3、18.4倍。rhGH的应用降低了梗阻性黄疸时大鼠血清的TNF-α水平,减轻了肝组织损害,但直至术后第7天始显著低于B组(P<0.05)。与此同时,rhGH部分改善了胆道再通术前大鼠的肝功能,血清 ALT、TBIL、TBA 水平均显著低于 B 组(P<0.05),尤其后者更为显著(P<0.01)。王向昱等[8]通过皮下注射rhGH治疗重症急性胰腺炎患者40例,亦发现rhGH能显著降低急性坏死性胰腺炎胃肠黏膜组织炎性细胞因子、粘附分子与趋化因子的转录,从而发挥其胃肠道局部抗炎作用。笔者认为,此种“有益效应”主要与rhGH能保护肠黏膜屏障,减少细菌移位和内毒素吸收等有关。然而,rhGH并不能扭转OJ时严重的病理生理改变,C组大鼠肝功能仍呈持续恶化趋势,说明解除胆道梗阻是首要因素。梗阻解除后,C组大鼠肝功能指标以及TNF-α水平明显低于同时相点的B组大鼠(P<0.05),至术后第14天时虽然TBIL与TBA仍显著高于A组,但是ALT与TNF-α已恢复为正常水平,说明rhGH能促进OJ大鼠在BDR术后的恢复。
本实验还发现,在52只行BDR手术的OJ大鼠中,有13只术前一般情况很差,黄疸严重,BDR术后7d内死亡8只,死亡率高达61.5%,占全部术后死亡的50.0%(8/16),且大多数是未应用rhGH的B组大鼠(6/8),说明在影响OJ大鼠手术危险性的因素中,TBIL以及TBA是重要的参考指标,而rhGH能显著降低OJ大鼠在胆道再通术前的TBIL、TBA水平,并显著降低术后第14天大鼠累积死亡率(P<0.05),说明rhGH能增强OJ大鼠的手术耐受性、提高安全性。Ram等[9]认为rhGH可能通过JAK/STAT5通路上调淤胆时钠-牛磺胆酸盐共转运多肽(Na+-dependent taurocholate cotransporting polypeptide,Ntcp)的表达,从而起到“利胆”作用,但 rhGH对其它转运子,特别是对肝细胞毛细胆管面转运子的调节机制尚不清楚。
此外,笔者曾对重度OJ和淤胆性肝炎患者在用常规治疗无法使黄疸减轻时,试用过rhGH治疗,发现其具有较明显的“利胆”作用。Sklar等[10]通过361例恶性肿瘤幸存患者接受rhGH治疗后肿瘤复发情况的研究发现,肿瘤的复发率仅为0.83%,继发性肿瘤的发生率为3.21%,rhGH治疗与患者的病死率也没有明显联系。因此,对于长期重度OJ,在解除梗阻的原则下,rhGH“利胆”、改善肝功能的作用可用于部分重症患者的围手术期处理。
[1]Penisi P,KopchickJ,Thorgeirsson S,et al.Role of growth hormone(GH)in liver regeneration.Endocrinology,2004,145(10):4748.
[2]Gomez DS,Aguilera MJ,Codesal J,et al.Comparative effects of growth hormone in large and small bowel resection in the rat.Surg Res,1996,62(1):5.
[3]张奇东,伍世绩,梁 跃,等.生长激素在肝硬化门静脉高压低蛋白血症患者手术前的应用.中国普通外科杂志,2004,13(9):708.
[4]王贵和,赵铁军.生长激素强化肠外营养对胃肠道恶性肿瘤患者蛋白代谢及免疫功能的影响.中国普通外科杂志,2001,10(6):567.
[5]Tilg H.Cytokines and liver diseases.Gastroenterol,2001,15(10):661.
[6]Eduardo F,Victor P,Victor T,et al.Chronic bile duct obstruction induces changes in plasma and hepatic levels of cytokines and nitric oxide in the rat[J].Experimental and Toxicologic Pathology,2006,58(1):49.
[7]Scopa CD,Koureleas S,Tsamandas A,et al.Beneficial effects of growth hormone and insulin-like growth factorⅠon intestinal translocation,endotoxemia,and apoptosis in experimentally jaundiced rats.Cell Surg,2000,190(4):423.
[8]王向昱,郑志强,李春明,等.生长激素与生长抑素联合治疗重症急性胰腺炎.中国临床药理学杂志,2003,19(2):100.
[9]Ramp A,Park SH,Choi HK,et al.Growth hormone activation of Stat 1,Stat 3,and Stat 5 in rat liver.Differential kinetics of hormone desensitization and growth hormone stimulation of both tyrosine phosphorylation and serine/threonine phosphorylation.Biol Chem,1996,271(10):5929.
[10]Sklar CA.Growth hormone treatment:cancer risk.Horm Res,2004,62(suppl.3):30.

