Real-time PCR方法检测肉品中的沙门氏菌
方 平,杨永莉,杨 宝,王晓闻
(山西农业大学食品科学与工程学院,山西太谷030801)
在我国,沙门氏菌污染引起的食物中毒占食源性疾病中细菌食物中毒病例的70%~80%[1],且WHO已将沙门氏菌列入具有严重为害和中等为害的食物传播性病原[2]。而沙门氏菌常规检测方法和普通PCR方法的灵敏度及检测所需要的时间还有待于进一步提高。
本研究用普通PCR方法检测引物对沙门氏菌的特异性,并用SYBR Green I作为荧光染料,拟用Real-time PCR方法检测熟制牛肉和香肠中沙门氏菌,以建立一种检测肉品中沙门氏菌速度快、灵敏度高的方法。
1 材料和方法
1.1 主要材料与试剂
试验样品:熟制牛肉(市售)、香肠(市售)。
试验菌株:沙门氏菌和非沙门氏菌标准菌株各10株(表1)。
SYBR Green I,dNTP,buffer,Taq 酶等均购自宝生物工程(大连)有限公司;DNA Ladder购自天根生物(北京)有限公司。
1.2 主要仪器与设备
DYY-6C电泳仪(北京市六一仪器厂),Mx3000P荧光定量PCR仪(Stratagene公司,美国),Scientz-04无菌匀浆器(宁波新芝生物科技股份有限公司),WFH-201BJ紫外可见透射反射仪(上海精科实业有限公司)。
1.3 引物的选择与合成
本试验选用Wang等[3]报道的fimI基因序列中的1对引物,其序列如下。
上游引物为 5′-CCTTT CTCCA TCGTC CTGAA-3′;下游引物为5′-TGGTG TTATC TGCCT GACC-3′。这对引物可扩增沙门氏菌fimI基因中1段大小为85 bp的序列,引物由北 京奥科生物技术有限公司合成。

表1 试验所用菌株
1.4 样品的前处理
取过夜培养的鼠伤寒沙门氏菌的营养肉汤增菌液,按10倍梯度进行稀释,分别取10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8,10-9,10-10的 稀释液1 mL于25 g无菌操作剪碎的肉沫中,同时选3个稀释梯度的稀释液,吸取1 mL进行沙门氏菌的菌落记数,分别作3个平行样品,同时作空白对照组,并用常规检测沙门氏菌的方法检测原肉品作对照。将已加菌液的肉沫加入225 mL的无菌生理盐水,置于500 mL的三角瓶中,进行无菌操作匀浆,然后分别吸取1 mL匀浆液进行菌落记数,同时吸取1 mL用于提取DNA。将剩余的菌液置于37℃下振荡培养,每隔1 h吸取1 mL匀浆液提取DNA。如此操作,每个稀释梯度的样品进行6次DNA的提取试验。
1.5 反应模板的制备
关于沙门氏菌DNA的制备方法有许多介绍[4],本试验依据《分子生物学实验指导》中的经典分子生物学细菌总DNA提取方法[5]进行。
提取熟制牛肉中的沙门氏菌DNA的步骤如下[6-7]。(1)将沙门氏菌标准菌株接种于营养肉汤培养基中,37℃培养18 h,取细菌培养液1 mL于Eppendorf管中离心,弃去上清液。(2)沉淀中加入567 μL TE缓冲液,用吸管反复吹打沉淀,使之重新悬浮;加入30 μL10%SDS和3 μL20 mg/mL的蛋白酶K溶液,混匀,37℃温育1 h。(3)取上清液加等体积氯仿/异戊醇混合液(体积比为24∶1)摇匀,冰浴 10 min,14 000 r/min离心5 min。取上清液,加等体积酚/氯仿/异戊醇混合液(体积比为25∶24∶1)摇匀,冰浴10 min,14 000 r/min离心5 min,取上清液。(4)将上清液转移到另一新的离心管中(约200 μL),加入2倍体积预冷的无水乙醇(400 μL),置于-20℃冰冻1 h或过夜。(5)14 000 r/min低温高速离心15 min,弃去上清液,离心管倒置,风干,用30 μLTE缓冲液溶解,于-20℃冰箱放置备用。
以牛肉中的沙门氏菌DNA的提取方法为基础提取香肠中沙门氏菌DNA时,由于香肠中加入了许多淀粉、调味料等多种成分配料,使得DNA模板的提取难度增加。在1.5中(1)~(3)步骤后,如果上清液不能顺利地完成,可以再重复步骤(3)的操作,同时,在步骤(3)后,再加一步丙三醇清洗来提高DNA模板的沉淀。
1.6 PCR反应体系和参数[8]
Real-time PCR反应体系的总体积为25 μL,包括 SYBR Premix Ex TaqTM(2×)12.5 μL,Rox Reference Dye Ⅱ 0.5 μL,上下游引物(10 μmol/L)各 0.7 μL,DNA 模板 5.0 μL,ddH2O 5.6 μL。并按此顺序加样。用5 μL的ddH2O代替DNA模板作空白对照组。
Real-time PCR反应的条件为:95℃预变性30 s;95 ℃变性 5 s,55 ℃退火 15 s,72 ℃延伸10 s,40 个循环;72 ℃保温 1 min。
2 结果与分析
2.1 沙门氏菌引物的特异性试验
分别吸取沙门氏菌和非沙门氏菌标准菌株的DNA提取液6 μL作为模板,进行PCR扩增,

2.2 食品样品中沙门氏菌的检测
对经国标(GB/T 4789.4—2003)和普通PCR方法检测都确认是沙门氏菌阴性的食品样品,再用Real-time PCR方法进行检测,记录扩增曲线和熔解曲线。同时,用鼠伤寒沙门氏菌的增菌液吸取扩增产物5 μL进行电泳。由图1,2可知,引物对沙门氏菌扩增产物的条带清晰明亮,没有拖尾和非特异性带,而对非沙门氏菌扩增产物无条带,与空白对照组效果一样。因此,引物对沙门氏菌具有较强的特异性。按1.4的步骤作阳性对照。

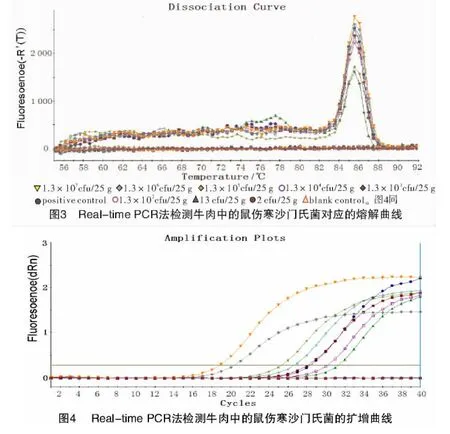
2.2.1 市售熟制牛肉中沙门氏菌的检测 对人工加入不同稀释度菌液的牛肉进行平板计数及Real-time PCR检测,结果如图3,4所示。
图3的熔解曲线中,阳性对照为鼠伤寒沙门氏菌。从图3可以看出,牛肉中沙门氏菌浓度从1.3×107cfu/25 g到13 cfu/25 g均呈现一个典型的熔解峰,并且其熔解峰与阳性对照一致,扩增目标基因的熔点值Tm为85.602℃,说明Realtime PCR方法检出的是沙门氏菌而非其他菌株,检测结果为沙门氏菌阳性。同时,空白对照和沙门氏菌量少到2 cfu/25 g时,均未出现特异性的熔解峰,检测结果为阴性。
扩增曲线如图4所示,曲线拐点清楚,标准的基线平直,无明显的上扬趋势,表明各反应管的扩增效率相近,扩增比较好。由图4可知,牛肉中沙门氏菌浓度从1.3×107cfu/25 g依次减少至13 cfu/25 g,扩增曲线的Ct值依次增加且都小于40,而2 cfu/25 g和空白对照组的扩增曲线与标准基线重复,即Ct值均为0,可见SYBR Green I Real-time PCR方法检测牛肉中的沙门氏菌的检出限为13 cfu/25 g。
由表2可知,用常规PCR方法检测市售熟制牛肉中沙门氏菌的灵敏度为128 cfu/25 g,而用Real-time PCR方法检测的灵敏度为13 cfu/25 g,灵敏度明显高于常规PCR检测方法。
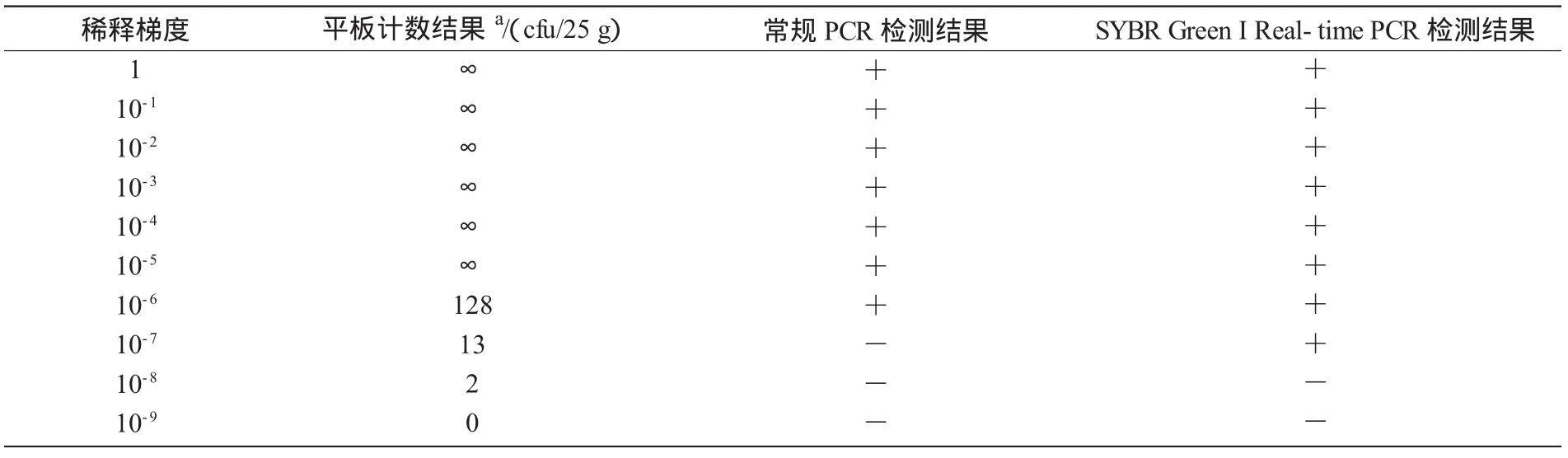
表2 SYBR GreenⅠReal-time PCR与常规PCR的比较
2.2.2 市售香肠中沙门氏菌的检测 对人工加入不同稀释度菌液的香肠同时进行平板计数及Real-time PCR检测。结果如图5,6所示。
图5的熔解曲线中,阳性对照为鼠伤寒沙门氏菌。从图5可以看出,香肠中的沙门氏菌浓度从1.2×107cfu/25 g到12 cfu/25 g均呈现出一个明显的熔解峰,并且其熔解峰与阳性对照一致,扩增目标基因的熔点值Tm为85.602℃,说明SYBR Green I Real-time PCR方法检出的是沙门氏菌而非其他菌株,检测结果为沙门氏菌阳性,其特异性比较强。同时,空白对照和鼠伤寒沙门氏菌量少到1 cfu/25 g时,均未出现特异性的熔解峰,说明检测结果为阴性。
扩增曲线(图6)中,样品曲线与阳性对照的曲线整体平行性较好,曲线拐点清楚,标准的基线平直,无上扬趋势,说明各反应管的平等性好,扩增效果比较好。由图6可知,香肠中的鼠伤寒沙门氏菌浓度从1.2×107cfu/25 g依次减少至12 cfu/25 g,扩增曲线的Ct值逐渐增加且都小于40,而1 cfu/25 g和空白对照组的Ct值均为0,所以SYBR Green I Real-time PCR方法检测香肠中的沙门氏菌的检出限为12 cfu/25 g。
从表3可以看出,用常规PCR方法检测市售香肠中沙门氏菌的灵敏度为116 cfu/25 g,而用Real-time PCR方法检测市售香肠中沙门氏菌的灵敏度为12 cfu/25 g,灵敏度明显高于常规PCR检测方法。
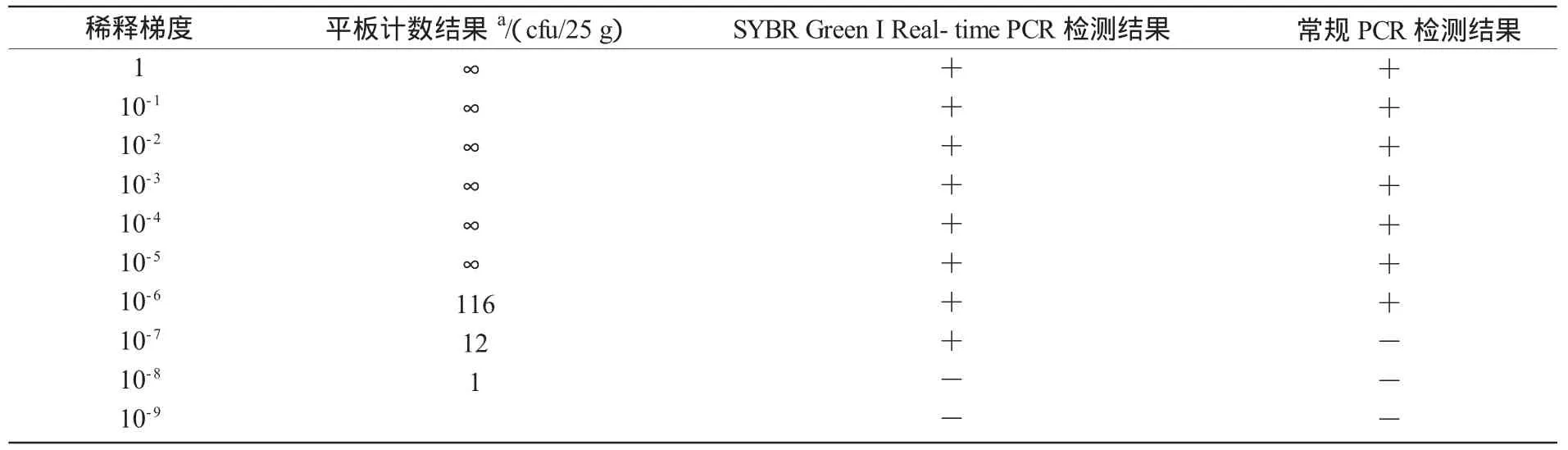
表3 SYBR Green I Real-time PCR与常规PCR的比较
2.3 可重复性试验
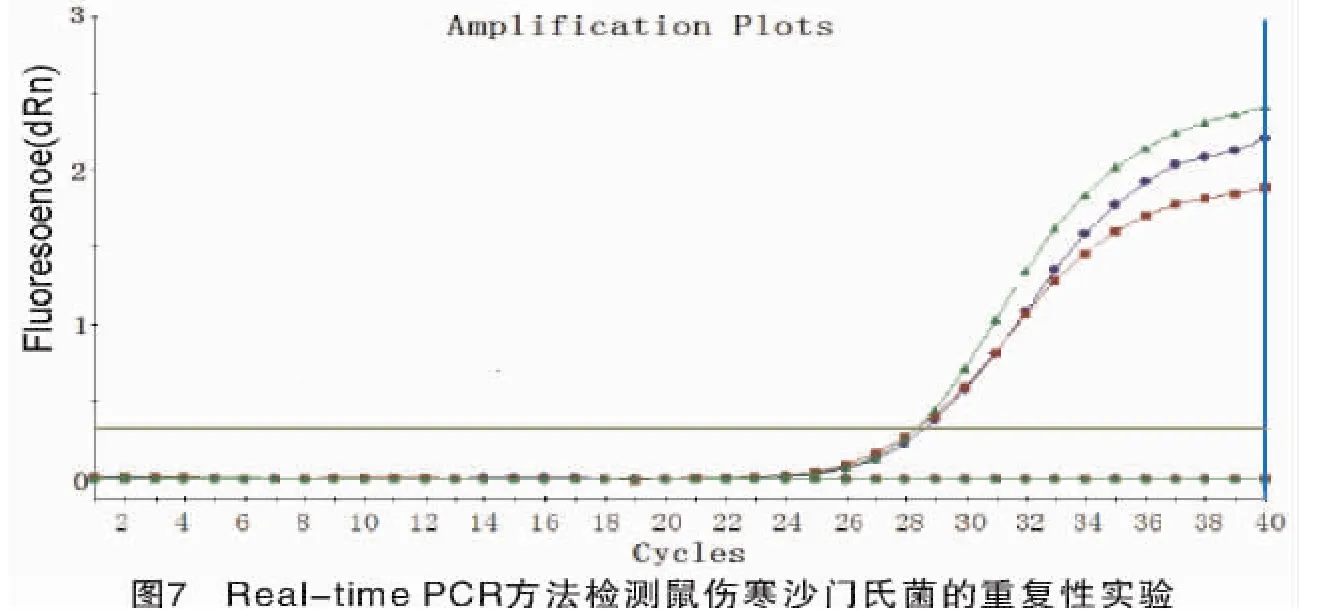
为验证Real-time PCR方法的可重复性,以同一浓度的鼠伤寒沙门氏菌DNA为模板,做3个重复,分别进行同条件的扩增。结果(图7)显示,3个样品的扩增曲线基本吻合,3次扩增曲线的 Ct值分别为 28.56,28.39,28.41。经计算,3 次扩增曲线Ct值的标准差为0.093,变异系数CV(coefficient of variation)为0.33%。而一般荧光PCR仪的Ct值重复性误差在CV≤2.1%范围内就可以[9],可见,本试验所研究的Real-time PCR方法具有较高的可重复性,从而保证了不同样品间检测结果的可靠性和稳定性。
2.4 抗干扰性试验
在食品样品中接种少量的鼠伤寒沙门氏菌菌液,再分别接种大肠埃希氏菌、变形杆菌、金黄色葡萄球菌等(接种量大于沙门氏菌),另外,作一组只接种相同量的沙门氏菌样品为对照,用Real-time PCR方法进行检测。经试验,接种杂菌的待检样品中的沙门氏菌含量达到Real-time PCR方法的检测灵敏度,因此,该方法不受其他杂菌的影响。
3 讨论
Real-time PCR方法在普通PCR基础上,增加了SYBR Green I荧光染料,在PCR扩增的同时检测其荧光强度,可大大提高检测的灵敏度。Real-time PCR方法采用完全封闭的管和荧光染料同步检测,省略了PCR产物的电泳和紫外灯下观测等步骤,简化了检测过程,节省了检测时间。Real-time PCR方法还比较安全,整个体系中不包含EB等有毒物质,对环境的污染和人体的危害很小。本试验建立了针对沙门氏菌的Realtime PCR检测方法,其检测时间(不包括增菌和前处理)仅需1.5 h。因此,该检测方法快速、灵敏、稳定,且操作简便,易于掌握[10-11]。
Real-time PCR具有上述诸多优点的同时,也存在一些不足之处。如Real-time PCR方法运用了封闭的检测,减少了扩增后电泳的检测步骤,因此也就不能监测扩增产物的大小[12](本试验先用普通PCR检测,知道其扩增产物的大小,再用Real-time PCR方法提高其检测的灵敏度,避免了这一不足之处);荧光PCR仪价格较昂贵,从而限制了其广泛的应用;荧光染料见光易分解,需要避光保存等。另外,它的特异性完全依赖于引物,并不比常规的PCR具有更高的特异性;荧光信号的强弱依赖于双链DNA的质量而不是分子数[13]。在扩增效率相同的情况下,长扩增产物的信号要强于短扩增产物。如果扩增效率不同,那么定量会更不准确。从长远看,尤其是对于检测工作来说,荧光PCR技术将越来越得到广泛的应用,成为病原菌检测的主要技术之一。
[1]马立农.食品沙门氏菌PCR快速检测试剂盒简介[J].深圳职业技术学院学报,2005,4(2):189-192.
[2]卢强,陈贵连,林万明.PCR扩增invA基因特异性检测沙门氏菌[J].中国兽医学报,1994,14(3):251-255.
[3]Wang X W,Narayanan Jothikumar,Mansel W G.Enrichment and DNAExtraction Protocols for the Simultaneous Detection of Salmonella and Listeria monocytogenes in Raw Sausage Meat with Multiplex Real-Time PCR[J].Journal of Food Protection,2004,76(1):189-192.
[4]薛俊龙,王采先,詹丽娥,等.两种物理方法破碎大肠杆菌比较试验[J].山西农业科学,2005,33(4):77-79.
[5]刘进元.分子生物学实验指导[M].北京:清华大学出版社,2002.
[6]李景鹏,李成梅,丁乃峥,等.应用聚合酶反应快速检测沙门氏菌[J].东北农业大学学报,1997,28(1):79-83.
[7]石晓路.沙门氏菌荧光PCR快速检测方法的建立与应用[D].武汉:华中农业大学,2003.
[8]温立斌,何孔旺,杨汉春,等.SYBR GreenⅠ荧光定量PCR检测类猪圆环病毒因子P1[J].华北农学报,2009,24(4):31-35.
[9]张文超.聚合酶链反应(PCR)技术与基因扩增分析仪器(PCR 仪)[J].生命科学仪器,2005(3):14-20.
[10]Eyigor A,Carli K T,Unal C B.Implementation of real-time PCR to tetrathionate broth enrichment step of Salmonella detection in poultry [J].Letters in Applied Microbiology,2002,34(1):37-41.
[11]Hiroshi Fukushima,Yoshie Tsunomori,Ryotaro Seki.Duplex Real-Time SYBR Green PCR Assays for Detection of 17 Species of Food or Waterborne Pathogens in Stools[J].Journal ofClinical Microbiology,2003,11:5134-5146.
[12]张华,许叔祥.定量聚合酶链反应的研究进展与临床应用[J].中华检验医学杂志,2000,23(2):120-121.
[13]蒋春燕,王泰健,王琴,等.实时荧光定量PCR技术[J].动物医学进展,2005,26(12):97-100.

