γ-聚谷氨酸天冬氨酸-顺铂复合物的制备及其生物活性
李文娟,冯震,薛晓敏,黄静,吴自荣
γ-聚谷氨酸天冬氨酸-顺铂复合物的制备及其生物活性
李文娟,冯震,薛晓敏,黄静,吴自荣
200062 上海,华东师范大学生命科学学院
研究一种低毒性的顺铂复合物:γ-聚谷氨酸天冬氨酸-顺铂复合物(γ-PGAasp-CDDP),考察其体外性质和体内毒性,并探讨可能的作用机制。
γ-聚谷氨酸与天冬氨酸发生酰胺化反应制备 γ-聚谷氨酸-天冬氨酸复合物,核磁共振对其结构进行表征;化学法制备 γ-聚谷氨酸天冬氨酸-顺铂复合物;常规方法检测该复合物稳定性;透析法研究药物缓释效果;MTT 法检测复合物体外抗肿瘤细胞活性;流式细胞仪检测其对细胞凋亡的作用;小鼠体内实验检测其体内毒性。
成功制备γ-聚谷氨酸天冬氨酸-顺铂复合物,顺铂的有效结合率达 30%;该复合物在常温中性环境下稳定;30 h 时顺铂的累计释放率达到 30%;细胞实验表明复合物对 Bcap-37(人乳腺癌细胞)和 BEL7404(人肝癌细胞)具有显著的杀伤作用,小鼠体内实验表明该复合物的毒性比游离顺铂低。
γ-聚谷氨酸天冬氨酸-顺铂复合物仍然保留了游离顺铂的生物活性,在杀伤肿瘤细胞、引起细胞凋亡的同时,大大降低了体内毒副作用,其作用机制可能与实体瘤组织的高通透性、滞留效应(EPR 效应)以及药物缓释作用有关,因此该复合物具有潜在的临床应用价值。
药物载体; 药物释放系统; 顺铂; γ-聚谷氨酸-天冬氨酸
恶性肿瘤是当前严重影响人类健康的主要疾病之一,顺铂[cis-dichlorodiammineplatinum(II),CDDP]类配合物是目前应用最为广泛的抗肿瘤药物,但因其具有严重的毒副作用,限制了临床应用[1]。将抗肿瘤药物载于高分子载体上,靶向性输送到肿瘤组织(即被动靶向)[2],极大地提高了药物的生物利用率,有效地降低药物的毒副作用并提高用药剂量,是目前药物释放领域研究的热点之一,国外报道的有微球体、纳米微粒、脂质体和微型胶囊等[3-7]。本实验室曾以γ-聚谷氨酸作为载体连接顺铂,制备聚谷氨酸-顺铂复合物,并取得较好的结果[8]。但是仅以小分子γ-聚谷氨酸作为载体还存在载药量低和载体用量大的缺点,本文采用了一种连接效率更高的新型药物载体:γ-聚谷氨酸-天冬氨酸,利用其活性基团羧基连接顺铂,制备γ-聚谷氨酸天冬氨酸-顺铂复合物,并对其体内外性质进行研究。
1 材料与方法
1.1 材料
1.1.1 主要试剂 H-Asp(OtBu)-OtBu·HCl(Asp,Mr 296.8)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDAC)购自吉尔生化(上海)有限公司;γ-聚谷氨酸标准品、顺铂(CDDP,纯度 > 99.9%)、噻唑蓝(MTT)、碘化丙啶(PI)购自美国 Sigma 公司;三氟乙酸(TFA)、邻苯二胺(OPDA)购自上海化学试剂公司。
1.1.2 主要仪器 ELx800 酶标仪为美国 Bio-Tek公司产品;FACScan 流式细胞仪为美国 Becton Dickinson 公司产品;Avance 500 MHz 核磁共振仪为德国 Bruker 公司产品。
1.1.3 细胞系 枯草芽孢杆菌(.)由本实验室筛选并保存;Bcap-37 细胞(人乳腺癌细胞)、BEL7404 细胞(人肝癌细胞)购自中国科学院上海细胞研究所;DMEM 培养基(Gibco)(含 10%小牛血清)购自吉尔生化(上海)有限公司。
1.1.4 实验动物 昆明小白鼠,雌性,5 周龄,体重 18 ~ 20 g,购自上海斯莱克实验动物有限公司,质量合格证号:SCXK(沪)2007-0005。
1.2 方法
1.2.1 γ-聚谷氨酸-天冬氨酸聚合物的合成及结构表征 由枯草芽孢杆菌发酵得γ-聚谷氨酸[9],利用温和降解法[10],调 pH 至4.0,80 ℃水浴 165 min后冰浴冷却,调 pH 至中性,透析纯化,冷冻干燥得小分子γ-聚谷氨酸(sγ-PGA)。将 sγ-PGA、Asp 及 EDAC 按摩尔比 4:2:3 以蒸馏水充分溶解,搅拌 4 h,离心收集白色沉淀,加 TFA,37 ℃振荡反应 2 h 后,加入 10 倍体积的无水乙醚,离心收集白色沉淀。将得到的固体溶于蒸馏水中,调pH 至 7.0,透析纯化 48 h,冷冻干燥,即得载体γ-聚谷氨酸-天冬氨酸(γ-PGA-asp)。0.8% 的琼脂糖凝胶电泳测定其分子量[11](以下称电泳法)。
γ-PGA-asp 结构表征:将 15 mg 样品溶于 500 μl D2O 中,利用Avance 500 MHz 核磁共振仪进行核磁共振 H 谱(1H NMR)检测。
1.2.2 γ-聚谷氨酸天冬氨酸-顺铂复合物的制备及分子量测定 将γ-PGA-asp、CDDP 以摩尔比 5:1 混合,去离子水溶解,调 pH 至 7.0,密封,避光 37 ℃温育 48 h。透析纯化 48 h 后,收集样品,OPDA 法进行 CDDP 定量[8],定量后样品冷冻干燥,得到白色絮状产物,即γ-PGAasp-CDDP 复合物。电泳法测定其分子量。
有效结合率 =(检测到的顺铂质量/参加反应的顺铂总质量)× 100%。
1.2.3 γ-聚谷氨酸天冬氨酸-顺铂复合物稳定性实验
1.2.3.1 不同温度对 γ-PGAasp-CDDP 复合物的影响 γ-PGAasp-CDDP 复合物样品 500 μl /管分装,分别置于 4、37、60 ℃水浴。分别在第 0、10 天取样,电泳法检测其载体变化,OPDA 法检测药物稳定性[8]。
1.2.3.2 不同 pH 值对 γ-PGAasp-CDDP 复合物的影响 γ-PGAasp-CDDP 复合物样品分别调 pH 至 6.0、7.0、8.0、9.0、10.0,37 ℃水浴,检测方法同 1.2.3.1。
1.2.4 γ-聚谷氨酸天冬氨酸-顺铂复合物对顺铂的缓释作用 将 γ-PGAasp-CDDP 复合物溶液(已知 CDDP 浓度 1 mg/ml)加入透析袋中放入 37 ℃磷酸缓冲液(PBS,pH 7.4)中透析 48 h,每隔 1 h 从透析液中取 1 ml 样品,同时再加入 1 ml 新 PBS 溶液,每隔 10 h 取样,用 OPDA 法检测 CDDP 的量,并计算其累计释放率。
1.2.5 γ-聚谷氨酸天冬氨酸-顺铂复合物对肿瘤细胞的影响
1.2.5.1 γ-PGAasp-CDDP 复合物抑制细胞增殖作用 将 Bcap-37 和 BEL7404 细胞分别在 96 孔(l × 104个细胞/孔)细胞培养板中培养 24 h,待细胞贴壁去除培养基,再加入含不同浓度游离 CDDP、γ-PGAasp-CDDP 复合物的新鲜培养基 200 μl /孔,每个浓度做 4 个复孔,置于 37 ℃,5% CO2培养箱中分别培养 24、48、72 h。每孔加入 20 μl 浓度为 5 mg/ml 的 MTT,继续培养 4 h。吸去培养液,加入 200 μl DMSO,充分振荡,于酶标仪波长570 nm 处测定吸光值,并计算 IC50值。
1.2.5.2 γ-PGAasp-CDDP 复合物对细胞凋亡的影响 于 25 cm2的细胞培养瓶中分别培养 Bcap-37 和 BEL7404 细胞,待细胞长至 80% 时加 20 μg/ml的药物作用 24 h,分别设定对照组(游离 CDDP),实验组(γ-PGAasp-CDDP 复合物),处理样品[11],流式细胞仪检测细胞凋亡情况。
1.2.6 γ-聚谷氨酸天冬氨酸-顺铂复合物在正常小鼠体内的毒性实验 昆明雌鼠按体重分为 3 组:PBS 组、游离 CDDP 组及 γ-PGAasp-CDDP 复合物组,每组 10 只。分别于第1、4、7 天以腹腔注射给药,注射剂量为 4 mg/kg(以 CDDP 计量)。每天记录小鼠的存活和体重变化情况。
2 结果
2.1 药物载体γ-聚谷氨酸-天冬氨酸的制备及结构表征
由枯草芽孢杆菌发酵得大分子 γ-聚谷氨酸(γ-PGA),利用温和降解法制备得小分子聚谷氨酸(sγ-PGA),sγ-PGA、Asp 在 EDAC 催化作用下,发生酰胺化反应,形成复合物 γ-PGA-asp。透析纯化后,冷冻干燥得 γ-PGA-asp,氨基酸分析得 γ- PGA-asp 中γ-PGA:Asp 约为 2 ~ 3:1(摩尔比,数据未显示),合成路线及模式图见图 1。
γ-PGA-asp 结构表征1H-NMR(D2O)结果见图 2。其中,δ1.95、1.9 ppm 处为 γ-PGA 的 β-CH2-峰,δ2.3 ppm 处为 γ-PGA 的 γ-CH2- 峰,δ4.25、4.41 ppm 分别为 γ-PGA 和 Asp 的 α-CH- 峰,δ2.95 ppm 为 Asp 的 β-CH2- 峰,δ8.06、8.35 ppm 处为 γ-PGA 和 Asp 的 -NH- 峰。该结果说明 γ-PGA 与 Asp 已连接。
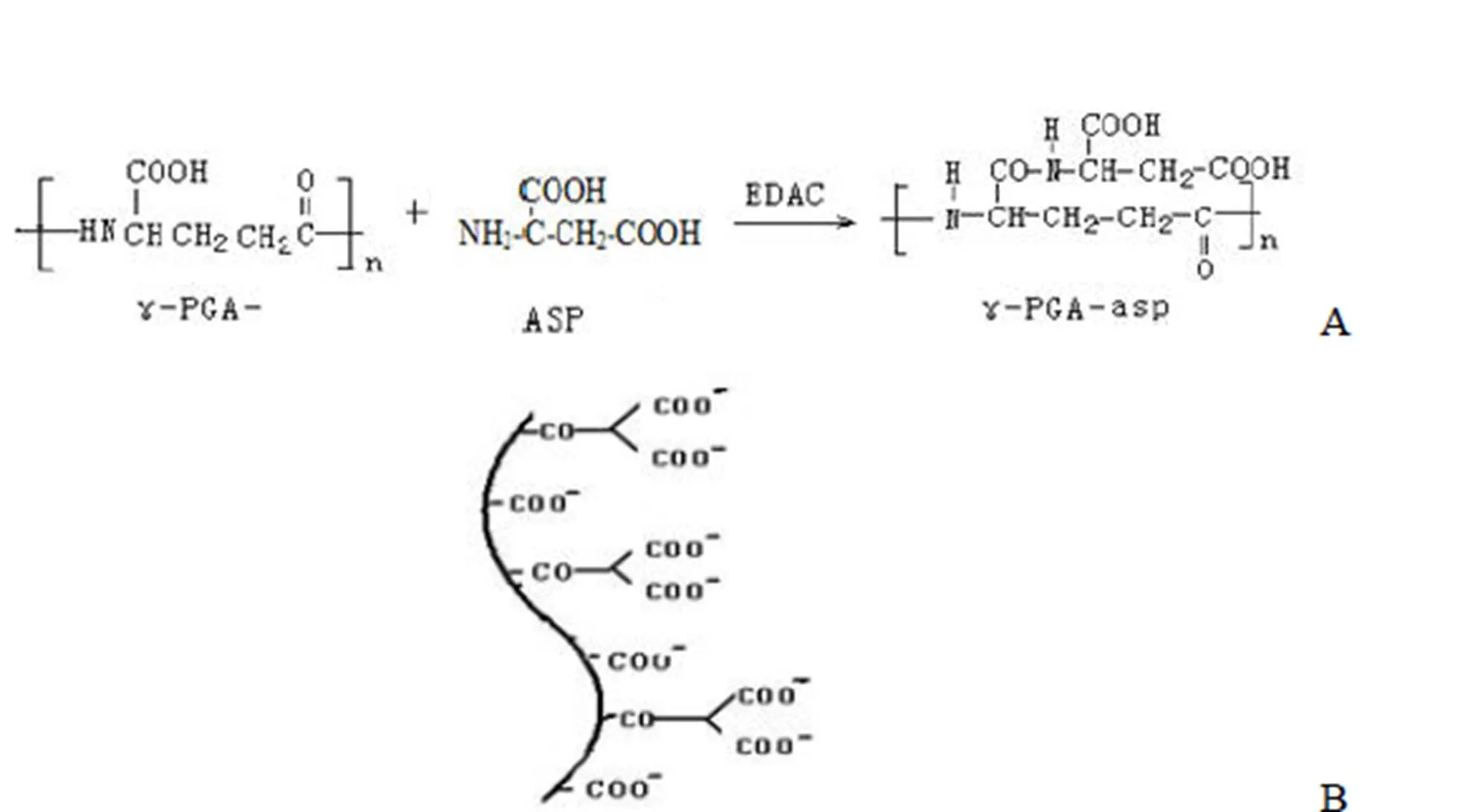
图 1 γ-聚谷氨酸-天冬氨酸合成路线及其模式图
Figure 1 The synthesis route of γ-PGA-asp and its ideograph
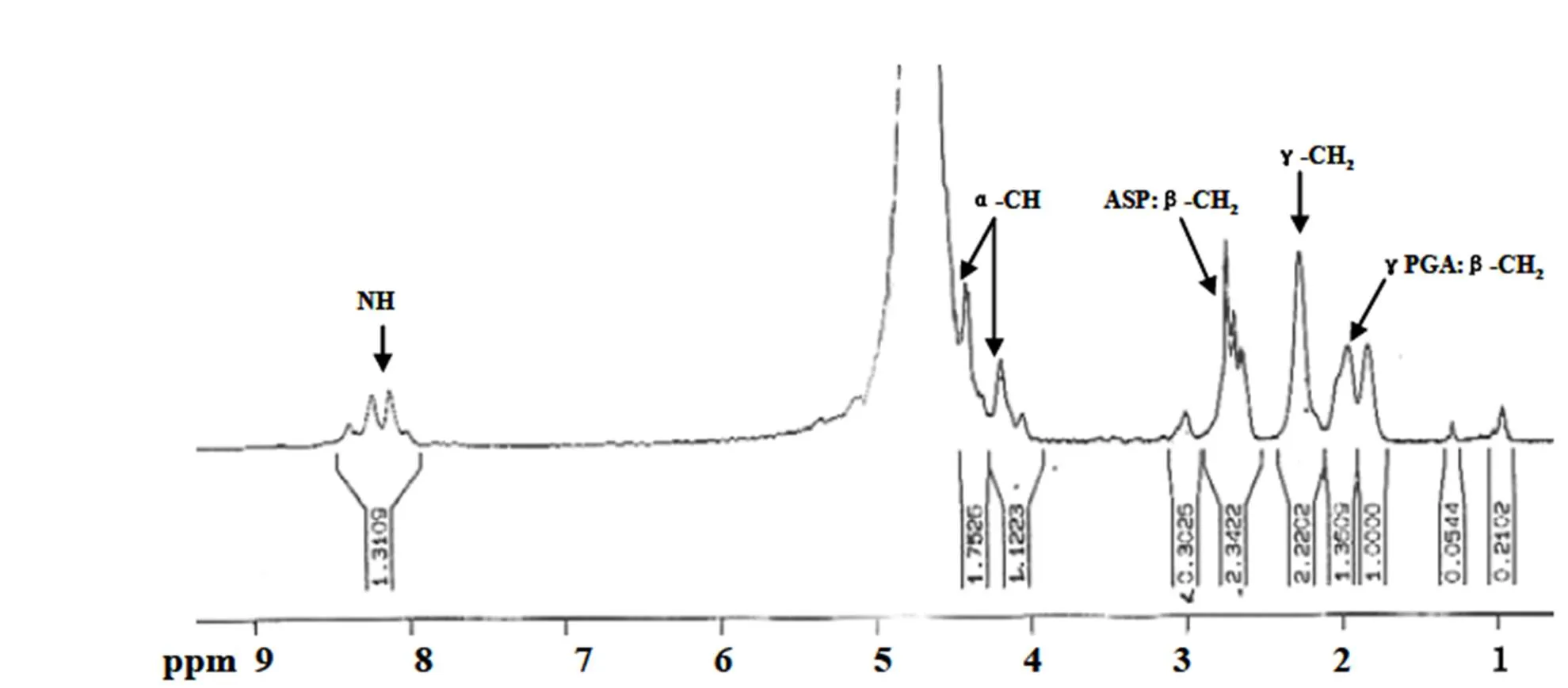
图 2 γ-聚谷氨酸-天冬氨酸的核磁共振 H 谱
Figure 21H NMR of the γ-PGA-asp
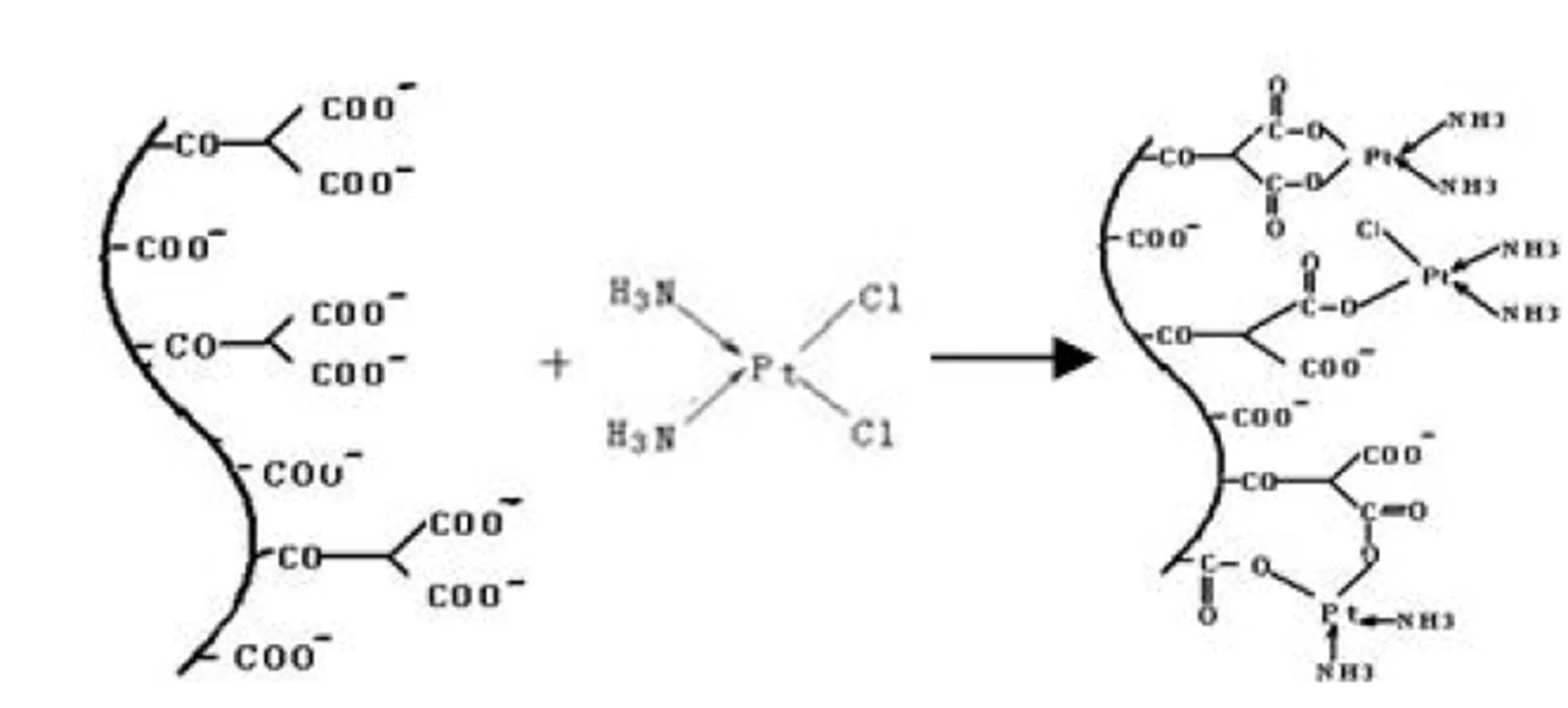
图 3 γ-聚谷氨酸天冬氨酸-顺铂复合物的合成路线模式图
Figure 3 The synthesis route ideograph ofthe γ-PGAasp-CDDP
2.2 γ-聚谷氨酸天冬氨酸-顺铂复合物的制备及分子量测定
CDDP 通过其上的 Cl 原子与载体侧链上的活性基团羧基反应,形成化学键获得 γ-PGAasp-CDDP 复合物,CDDP 与载体有多种结合方式,图 3 模式图为其中三种类型。OPDA 法检测 γ-PGAasp-CDDP 复合物中可逆结合的 CDDP 的量,有效结合率达 30%。
电泳法测定复合物的分子量,结果如图 4所示:泳道 4 为载体 γ-PGA-asp,分子量约为 20 ~ 60 kD;泳道 5 为 γ-PGAasp-CDDP 复合物,说明载体 γ-PGA-asp 连接上 CDDP 以后分子量变大,约为 30 ~ 60 kD。
2.3 γ-聚谷氨酸天冬氨酸-顺铂复合物的稳定性
2.3.1 不同温度对 γ-PGAasp-CDDP 复合物稳定性的影响 图 5A 显示,γ-PGAasp-CDDP 复合物在 4 和 37 ℃下处理 10 d 后,其结构稳定无降解(泳道 6、7),而在 60 ℃高温下有所降解(泳道 5)。且 60 ℃处理的样品颜色由无色变为淡黄色,说明 γ-PGA-asp 受高温影响发生降解,CDDP从复合物中析出。利用 OPDA 测定 CDDP 的量,结果见图 5B,4 和 37 ℃处理 10 d 后 CDDP 的量与未处理前比基本不变,60 ℃处理 10 d 后 CDDP 的量比未处理前降低约 50%。

1 ~ 3:γ-PGA 标准品,分子量分别为 1.45、2.05、6.4 kD;4:γ-PGA-asp,分子量约为 20 ~ 60 kD;5:γ-PGAasp-CDDP 复合物,分子量约为 30 ~60 kD
1 - 3: Standard γ-PGA with molecular weight 1.45, 2.05, 6.4 kD respectively; 4: The γ-PGA-asp with molecular weight 20 - 60 kD; 5: The γ-PGAasp- CDDP conjugate with molecular weight 30 - 60 kD.
图 4 γ-PGA-asp 和 γ-PGAasp-CDDP 复合物的琼脂糖电泳图
Figure 4 Agarose gel electrophoresis profile of γ-PGA-asp and γ-PGAasp-CDDP conjugate
2.3.2 不同 pH 值对 γ-PGAasp-CDDP 复合物稳定性的影响 图 6A 显示,γ-PGAasp-CDDP 复合物在不同 pH 条件下处理 10 d 后,中性条件下基本没有降解(泳道 5、6、7),pH 9.0 和 10.0 条件下出现降解(泳道 8、9)。图 6B 显示,在中性条件下 CDDP 量无明显变化,而 pH 9.0 和 10.0 条件下与未处理前相比含量明显降低。
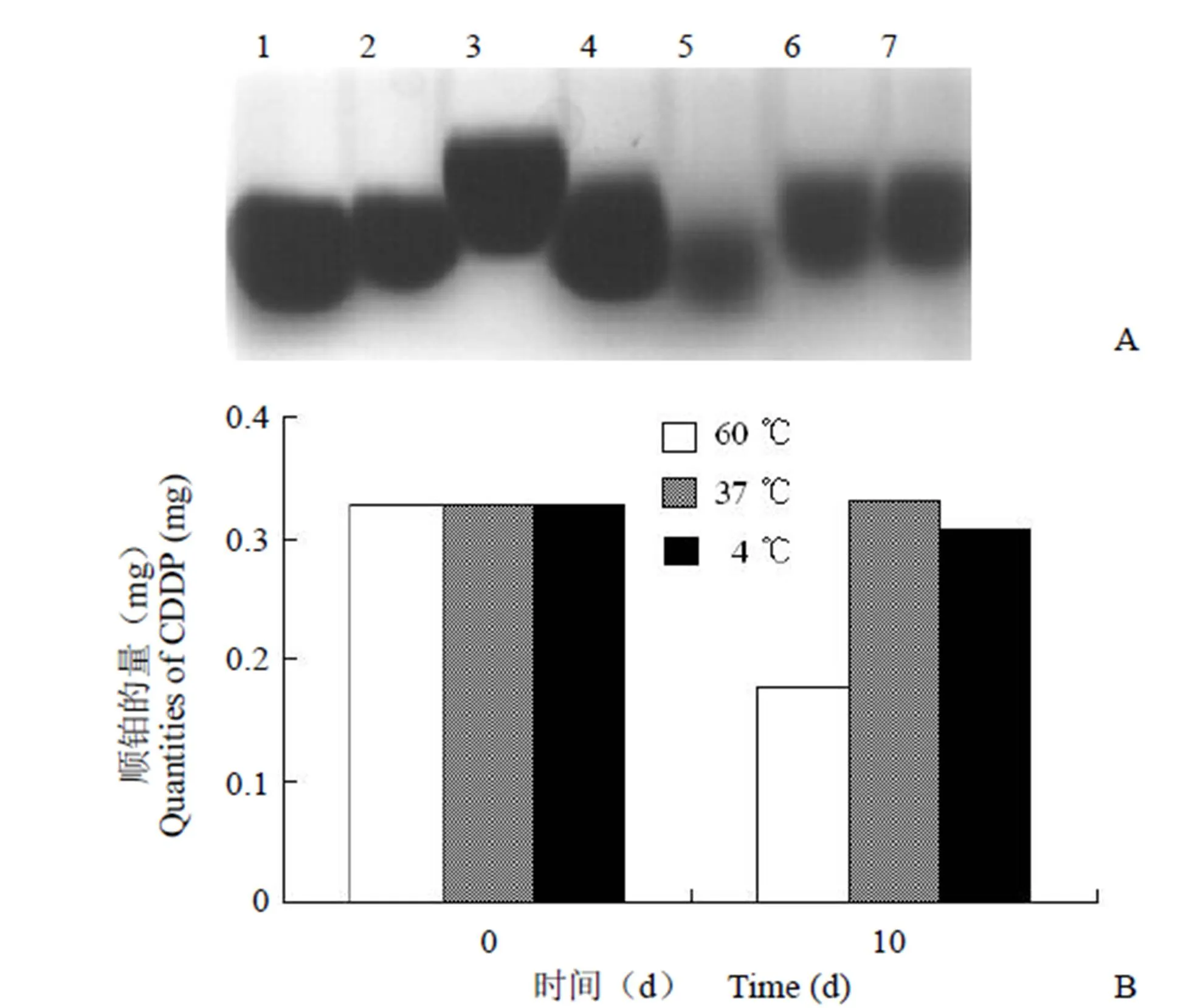
1 ~ 3:γ-PGA标准品;4:γ-PGA-asp;5 ~ 7:分别在 60、37、4 ℃处理 10 d 后的 γ-PGAasp-CDDP 复合物
Figure 5 A: Agarose gel electrophoresis profile of γ-PGAasp- CDDP conjugate influenced by different temperatures for ten days; B: The quantities of CDDP in γ-PGAasp-CDDP conjugate influenced by different temperatures

1 ~ 3:标准品 γ-PGA;4:γ-PGAasp;5 ~ 9:分别在 pH 6.0、7.0、8.0、9.0、10.0 条件下处理 10 d 的 γ-PGAasp-CDDP 复合物
Figure 6 A: Agarose gel electrophoresis profile of γ-PGAasp- CDDP conjugate influenced by different pH treatmens in water bath for ten days; B: The quantities of CDDP in γ-PGAasp- CDDP influenced by different pH value
2.4 γ-聚谷氨酸天冬氨酸-顺铂复合物的缓释特征
γ-PGAasp-CDDP 复合物在去离子水中十分稳定,放置一个月不降解、不沉淀,而在含有 Cl–的溶液中,由于 Cl–和 γ-PGA-asp 上的羧基之间发生交换反应,CDDP 从γ-PGAasp-CDDP 复合物释放出来,缓释曲线(图 7)表明:在前 20 h γ-PGAasp-CDDP 复合物对 CDDP 有突释现象,之后释放趋于平缓,30 h 时累计释放率已达30%。证明载体连接 CDDP 后的复合物具有缓释效果,并且有着较好的释放率。

图 7 γ-PGAasp-CDDP 复合物在 37 ℃下 PBS 中对 CDDP 的缓释曲线
Figure 7 Release profiles of CDDP from the γ-PGAasp- CDDP conjugate in PBS at 37 ℃
2.5 γ-聚谷氨酸天冬氨酸-顺铂复合物的体外细胞毒性实验
2.5.1 MTT 法检测 γ-PGAasp-CDDP 复合物对细胞的毒性 γ-PGAasp-CDDP 复合物对 Bcap-37 及 BEL7404 细胞毒性结果见图 8。由图可知,药物作用 24、48、72 h 后,细胞存活率均随药物浓度的增大而减小,且成剂量相关性,但是 γ-PGAasp-CDDP 复合物处理的细胞存活率均比相同浓度游离 CDDP 处理的细胞存活率高。此外,表1为药物对两种肿瘤细胞分别作用 24、48、72 h后的 IC50值。从表中可以看出经 γ-PGAasp-CDDP 复合物处理的 IC50值普遍高于游离 CDDP 组,高约 2 ~ 3 倍,可见 CDDP 结合到 γ-PGA-asp 上之后,仍然保留细胞杀伤作用,但其在细胞内的毒性显著降低。
2.5.2 FCM 法检测 γ-PGAasp-CDDP 对细胞的凋亡作用 20 μg/ml 的 γ-PGAasp-CDDP 复合物对 Bcap-37 和 BEL7404 细胞作用 24 h,利用FCM 法检测其对细胞凋亡的影响,见图 9,结果显示两种细胞经药物处理后有不同程度的凋亡峰出现,处于四倍体细胞明显减少,大部分细胞都被抑制在二倍体期,说明 γ-PGAasp-CDDP 复合物通过抑制 DNA 复制引起细胞凋亡,CDDP 结合到 γ-PGA-asp 上以后,其原有的生物学活性并未丧失,但与 CDDP 相比复合物对细胞凋亡作用相对较弱(数据未显示)。

图 8 游离 CDDP 和 γ-PGAasp-CDDP 复合物处理不同时间后细胞的存活率曲线(A:Bcap-37 细胞;B:BEL7404 细胞)
Figure 8 Cells were treated with free CDDP and γ-PGAasp- CDDP conjugate respectively for different time (A: Bcap-37 cell; B:BEL7404 cell)

表 1 游离 CDDP 和γ-PGAasp-CDDP 复合物对 Bcap-37 和 BEL7404 细胞的体外毒性
2.6 γ-聚谷氨酸天冬氨酸-顺铂复合物的体内毒性
图 10A 是从正常小鼠体重变化角度来考察药物的体内毒性,研究发现,游离 CDDP 组小鼠体重在给药后明显减低,而 γ-PGAasp-CDDP 复合物组与生理盐水组小鼠体重均逐渐增加,表明该复合物毒性很低。图 10B 显示游离 CDDP 对正常小鼠毒性非常大,给药后 10 d 时小鼠的死亡率为 70%,而 γ-PGAasp-CDDP复合物对小鼠基本没有毒性,20 d 后存活率仍为 100%。

图 9 FCM 法检测细胞周期图(A:Bcap-37 细胞;B:BEL7404 细胞)
Figure 9 The results of apoptosis assay (A: Bcap-37cell line; B: BEL7404 cell line)

图 10 游离 CDDP 和 γ-PGAasp-CDDP 复合物对昆明雌鼠内毒性的考察(A:体重变化;B:存活率)
igure 10 The in vivo toxicity of free CDDP and γ-PGAasp- CDDP conjugate in normal KM female mice (A: Body weight change; B: Survival )
3 讨论
以微生物发酵合成的 γ-PGA 作为药物载体,本实验室曾成功合成一种半衰期长、毒性低、具有被动靶向和缓释效果的顺铂复合物:γ-PGA-CDDP 复合物[8]。但是仅以 sγ-PGA 为载体存在载药量低和载体用量大的缺点,CDDP 在 γ-PGA 上的载药量仅能达到12%。而本研究研制的 γ-PGA-asp 可提高载药量和降低载体用量,为临床应用提供便利。其作为药物载体具有以下特点:⑴Asp 的氨基与 γ-PGA 侧链的羧基发生酰胺化反应,组成简单,结构明确;⑵保持了天然 γ-PGA 安全无毒、生物可降解性和水溶性的特点,提高了药物的溶解度;⑶具有数目更多的活性基团羧基,且利于药物与载体的结合,由于 γ-PGA 上的羧基离主链较近,空间位阻较大,不利于 CDDP 的链接,而 γ-PGA- asp 在多出 1/3 的羧基的同时,其距离主链较远,空间位阻变小,更有利于 CDDP 与载体的结合。最终得到的 γ-PGAasp-CDDP 复合物中 CDDP 的有效结合率可达 30%,有利于解决临床上载体用量大的问题。
γ-PGAasp-CDDP 不仅保留了顺铂的生物活性,并且有自身的优点,其主要表现是:⑴细胞实验结果证明该复合物与 CDDP 均具有抗肿瘤细胞生长效果,但是其毒性明显低于游离 CDDP 的毒性;⑵小鼠体内毒性实验进一步证实了 γ-PGAasp- CDDP 毒性低的特点;⑶该复合物比游离 CDDP 易溶于水,解决了药物难溶性问题。
本实验需进一步研究 γ-PGAasp-CDDP 在荷瘤小鼠体内的抑瘤效果,我们预测该复合物会有良好的体内抗肿瘤活性,主要原因有以下两点:一方面,EPR 效应在肿瘤选择靶向治疗方面发挥着重要的作用[12],由于实体瘤组织中血管丰富、血管壁间隙较宽、结构完整性差,淋巴回流缺失,造成大分子类物质具有选择性、高通透性和滞留性,相比正常组织而言,分子量为 30 ~ 60 kD 的 γ-PGAasp- CDDP 复合物,更容易在恶性肿瘤组织处积累,这种被动靶向作用可以在有效地抑制肿瘤增长的同时也降低毒副作用;另一方面,当 γ-PGAasp-CDDP复合物进入肿瘤组织后,随着载体 γ-PGA-asp 的生物降解,CDDP 逐渐从 γ-PGAasp-CDDP 复合物中释放出来,这种缓慢的释放过程不但可以有效地抑制肿瘤组织生长而且延长了药物在体内的半衰期,为高剂量注射药物提供了可能性,具有潜在地临床应用价值。
[1] Ponzani V, Bressolle F, Haug IJ, et a1. Cisplatin-induced renal toxicity and toxicity-modulating strategies: a review. Cancer Chemother Pharmacol, 1994, 35(1):1-9.
[2] Lu MF, Cheng YQ, Li LJ, et a1. Progress of study on passive targeting of drug delivery system. Mater Rev, 2005, 19(9):108-110. (in Chinese)
逯敏飞, 程永清, 李丽君, 等. 被动靶向药物载体的研究进展. 材料导报, 2005, 19(9):108-110.
[3] Barroug A, Kuhn LT, Gerstenfeld LC, et a1. Interactions of cisplatin with calcium phosphate nanoparticles: in vitro controlled adsorption and release. J Orthop Res, 2004, 22(4):703-708.
[4] Lee SJ, Park K, Oh YK, et al. Tumor specificity and therapeutic efficacy of photosensitizer-encapsulated glycol chitosan-based nanoparticles in tumor-bearing mice. Biomaterials, 2009, 30(15): 2929-2939.
[5] Lee CM, Tanaka T, Murai T, et a1. Novel condroitin sulfate-binding cationic liposomes loaded with cisplatin efficiently suppress the local growth and liver metastasis of tumor cells in vivo. Cancer Res, 2002, 62(15):4282-4288.
[6] Parka JH, Leeb S, Kim JH, et al. Polymeric nanomedicine for cancer therapy. Prog Polymer Sci, 2008, 33(1):113-137.
[7] Nishiyama N, Kato Y, Sugiyama Y, et a1. Cisplatin-loaded polymer-metal complex micelle with time-modulated decaying property as a novel drug delivery system. Pharm Res, 2001, 18(7): 1035-1041.
[8] Ye H, Jin L, Hu R, et a1. Poly(gamma, L-glutamic acid)-cisplatin conjugate effectively inhibits human breast tumor xenografted in nude mice. Biomaterials, 2006, (7):5958-5965.
[9] Hu RZ, Ye HF, Jin L, et a1. Screening and optimizing fermentation conditions of Bacillus strain with high productive poly-gamma- glutamic-acid. China Biotechnol, 2005, 25(12):62-65. (in Chinese)
胡荣章, 叶海峰, 金丽, 等. gamma-聚谷氨酸高产菌株筛选及发酵条件优化.中国生物工程杂志, 2005, 25(12):62-65.
[10] Tong M, Xu H, Wang J. Influence effects and performance of gamma-PGA degradability. JNanjing Univ Technol (Nat Sci Ed), 2006, 28(1):50-53. (in Chinese)
佟盟, 徐虹, 王军. gamma-聚谷氨酸降解影响因素及其生物降解性能的研究. 南京工业大学学报(自然科学版), 2006, 28(1):50-53.
[11] Jin L, Ye HF, Huang J, et a1. Preparation and biological activity of poly(gamma-glutamic acid)-cisplatin conjugate. Acta Pharm Sinica, 2007, 42(6):611-617. (in Chinese)
金丽, 叶海峰, 黄静, 等. 聚谷氨酸-顺铂复合物的制备及其生物活性. 药学学报, 2007, 42(6):611-617.
[12] Maeda H, Bharate GY, Daruwalla J. Polymeric drugs for efficient tumor-targeted drug delivery based on EPR-effect. Eur J Pharm Biopharm, 2009, 71(3):409-419.
Preparation and biological activity of poly(γ-glutamic acid)asp-cisplatin conjugate
LI Wen-juan, FENG Zhen, XUE Xiao-min, HUANG Jing, WU Zi-rong
Author Affiliation:School of Life Sciences, East China Normal University, Shanghai 200062, China
To prepare a poly(γ-glutamic acid)-Aspartate-Cisplatin conjugate (γ-PGAasp-CDDP). Both properties in vitro and in vivo were investigated and the possible mechanism of action is under discussion.
γ-PGA-asp conjugate was synthesized by amidate reaction between poly-γ-glutamic acids and H-Asp(OtBu)-OtBu·HCl. The characterization of γ-PGA-asp was identified by1H NMR. γ-PGAasp-CDDP conjugate was later prepared by conjugating γ-PGA-asp with Cisplatin. The stability of γ-PGAasp-CDDP was studied by common method, released profile was tested by dialysis, in vitro anti-tumor efficiency was detected by MTT assay, cell apoptosis was investigated by FCM assay and in vivo toxicity was performed in normal mice.
The γ-PGAasp-CDDP conjugate has been successfully synthesized and the active CDDP in the conjugate is up to 30%. γ-PGAasp-CDDP conjugate is solvable and stable in room temperature and neutral environment. CDDP can be gradually released from the resulting conjugate in PBS at 37 ℃ and the accumulative released rate is 30% at 30 h. In vitro, γ-PGAasp-CDDP conjugate performs remarkable anti-tumor effect and induces cell apoptosis on Bcap-37 and BEl7407 cell lines. The in vivo toxicity of γ-PGAasp-CDDP conjugate is significantly lower than free CDDP.
The γ-PGAasp-CDDP conjugate has effective anti-tumor activity, while it strikingly decreases side effects in vivo. The possible mechanism of action may be related to the EPR effect (enhanced permeability and retention effect) and control release function. Therefore γ-PGAasp-CDDP conjugate may have a potential application in clinical treatment.
Drug carriers; Drug delivery systems; Cisplatin; γ-PGA-asp conjugate
10.3969/cmba.j.issn.1673-713X.2010.02.004
WU Zi-rong, Email: zrwu@bio.ecnu.edu.cn
上海市科委 2008 年度重点科技攻关专项(08431902400)
吴自荣,Email:zrwu@bio.ecnu.edu.cn
2009-12-02
中国医药生物技术

