散血明目片对兔视网膜静脉阻塞热休克蛋白70表达的影响
彭清华 ,叶群如 ,张波涛 ,姚小磊 ,谭涵宇 ,曾志成 ,韩 琦
(1.湖南中医药大学第一附属医院眼科学重点学科,湖南 长沙 410007;2.湖南省桂阳县人民医院眼科,湖南 桂阳 424400;3.辽宁省沈阳市第一人民医院眼科,辽宁 沈阳 110041)
视网膜静脉阻塞(retinal vein occlusion,RVO)是最常见的视网膜血管疾病[1]。由于其发病的多因性,目前尚无针对病因的确切有效的治疗方法。散血明目片有活血通脉利水明目之功效,以往研究证实其对玻璃体积血等眼底出血患者有较好的临床疗效[2-3]。本研究采用激光造模法致兔视网膜静脉阻塞,同时用活血通脉利水明目之散血明目片混悬液灌胃,然后采用免疫组织化学染色法检测兔视网膜组织中热休克蛋白70(HSP70)含量,并对其保护机制进行初步探讨。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 有色家兔36只(72只眼),由湖南中医药大学动物实验中心提供,雌雄不限,体质量2.0~2.5 kg。
1.1.2 药物 散血明目片:由三七、酒大黄、蒲黄、猪苓、防己、地龙、白茅根、泽泻等活血通脉利水明目中药按现代制剂制备工艺制成,0.3 g/片,选用同一批号药物,批号:020624。由湖南中医药大学第一附属医院药剂科提供。使用时研成粉末,温开水混合,浓度为100 mL含散血明目片12 g的混悬液。
1.1.3 试剂 HSP70免疫组化试剂盒,由武汉博士德生物工程有限公司提供。
1.1.4 仪器 SL-1E裂隙灯显微镜,日本托普康公司生产;直接检眼镜,英国Keeler公司生产;YZ13三面镜,苏州医疗器械厂生产;莱特眼底激光治疗仪,法国光太公司生产。
1.2 方法
1.2.1 分组方法及RVO动物模型的建立 将36只家兔(72只眼)随机分为3组,每组12只(24只眼)。分别为:健康空白组、模型组、散血明目片组。模型组和散血明目片组两组实验兔术前12 h禁食禁水,造模前每只家兔交替点10 g/L阿托品和托品卡胺充分扩瞳,先做正常眼底彩色照相及荧光素眼底血管造影。参照周正申等[4]介绍的激光光凝视网膜中央静脉造模法制造RVO动物模型。10 g/L地卡因双眼角膜表面麻醉后,通过三面镜应用氩兰-绿激光(488,514 nm)直接光凝视网膜静脉上、下主干。初次光凝能量选择280~340 mW,光凝点数依具体情况而定,曝光时间0.1 s,光斑直径100 μm。激光光凝封闭静脉时准确聚焦于静脉,避免损伤邻近的动脉。光凝封闭的静脉段长度约1 DD,直至被封闭的静脉段变细发白,血流停滞,其远端迂曲扩张。光凝时由远端向近端照射,以免光凝处静脉内压力过高而破裂,影响操作。激光光凝封闭视网膜静脉后,即作眼底彩色照相及荧光素眼底血管造影(FFA),观察血管闭塞情况,若闭塞不完全则补充光凝封闭。一般情况下补充光凝1次就足够,过度光凝封闭视网膜静脉上下主干,往往可造成过于强烈的组织反应,从而使视网膜坏死。24 h后再复查FFA,证实视网膜静脉上、下主干完全阻塞。
1.2.2 给药方法 造模后2 d开始给药,健康空白组与模型组以生理盐水5 mL/kg灌胃;散血明目片组以散血明目片混悬液5 mL/kg灌胃。连续灌胃2周,1次/d。
1.2.3 免疫组化的检测 分别于造模后3、7、14 d以空气栓塞法处死动物,即刻摘取眼球,4%多聚甲醛固定,常规石蜡包埋切片(4 μm),作免疫组化ABC染色,以平均光密度值(OD)作为定量分析的指标。
1.3 统计学分析
采用SPSS 13.0统计软件处理实验数据,所有数据均采用“±s”表示,先进行正态性及方差齐性检验,若呈正态分布,方差齐,采用单因素方差分析,各组均数间的两两比较采用最小显著性差异(Least significant diference,LSD)检验法,方差不齐则采用近似检验(Dunnett’s T3)。
2 结果
散血明目片对视网膜组织中HSP70阳性表达的平均光密度值(OD)的影响如表1所示:造模后3 d,散血明目片组及模型组HSP70阳性表达明显增强,两组与空白组比较差异均具有统计学意义(P<0.01),但散血明目片组与模型组之间差异无统计学意义(P>0.05)。造模后7 d,散血明目片组及模型组HSP70阳性表达较第3天时降低,但各组间比较,差异均具有统计学意义(P<0.01)。造模后14 d,散血明目片组及模型组HSP70阳性表达进一步降低,但散血明目片组较空白组仍明显增高,散血明目片组与模型组及空白组间比较差异均具有统计学意义(P<0.01),而模型组与空白组间比较差异无统计学意义(P>0.05)。
表1 各组兔视网膜HSP70阳性表达的平均光密度值 (±s)
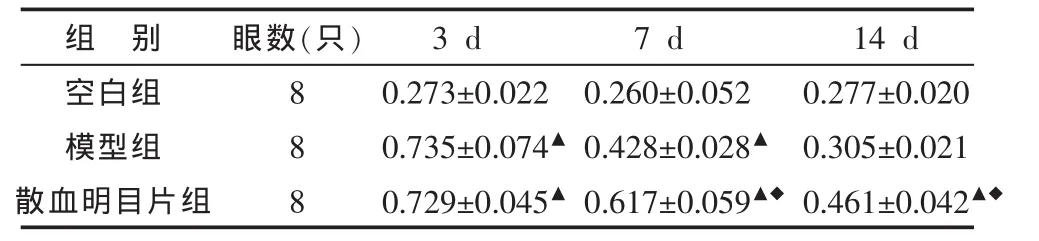
表1 各组兔视网膜HSP70阳性表达的平均光密度值 (±s)
注:与空白组比较▲P<0.01;与模型组比较◆P<0.01。
组 别空白组模型组散血明目片组14 d 0.277±0.020 0.305±0.021 0.461±0.042▲◆眼数(只)888 3 d 0.273±0.022 0.735±0.074▲0.729±0.045▲7 d 0.260±0.052 0.428±0.028▲0.617±0.059▲◆
3 讨论
视网膜静脉阻塞属中医“络损暴盲”范畴,我们认为该病是眼科典型的血瘀证候,本病存在着眼血液动力障碍、血液流变性异常、血小板聚集及全身微循环障碍等血瘀改变。而且本病的临床特征就是视网膜的分支或中央静脉阻塞后,使脉中血液运行受阻,溢于脉外,导致眼底出血。我们总结前人论点结合自己的临床经验对本病提出了活血利水之法,认为在本病的整个治疗过程中不仅要活血通脉,而且要利水散结明目。正如唐容川在《血证论》所述:“血病而不离乎水”;“血积既久,其水乃成”;“水病而累及血,瘀血化水。”我们认为RVO患者在临床上除有出血表现外,由于血管阻塞,脉中津液和出血一起外渗,往往伴有视网膜的水肿、渗出,不少患者还伴有黄斑囊样水肿,眼底荧光血管造影时即可见到黄斑区强荧光。因此,其病变过程中始终存在着水血夹杂的病机,在病变的中后期又表现为水血互结,因而必须水血同治。因水与血在生理上同源,在病理上互累,因而治疗上主张用活血通脉利水明目法以活其血,利其水,散其瘀,组方散血明目片。
现代药理研究表明,散血明目片组方中大部分药物具有抑制血小板聚集和黏附、改善血液流变性、降低血管的通透性、改善血管的脆性、扩血管、加速止血、防止血栓形成的作用。前期的临床表明[5]:活血药与利水药配合使用,可加快出血的吸收,从而促进病变的早日恢复。患者经活血通脉利水明目法后,其血液流变学指标明显改善。同时活血利水之散血明目片能促进玻璃体积血的吸收,改善眼底的状况,改善全身的血液流变性,降低血液黏滞性和聚集性,降低血小板的活化功能,减轻血管内皮细胞的受损等,从而全面改善患者的血瘀状况,加速积血的清除,提高玻璃体积血患者的视功能[6-7];散血明目片能够明显降低兔视网膜静脉阻塞RVO模型ET-1表达,抑制其PAI-1、VEGF、bFGF在视网膜上高表达,诱导tPA的高表达,抑制血栓形成[8-9]。
生物细胞在受热和其他许多损伤因素、应激刺激(如缺氧、缺血、病毒感染、DNA损伤)等作用后,发生热休克反应,抑制一些正常蛋白质的合成,同时启动一类新的蛋白质合成基因——热休克蛋白(heat shock protein,HSP)基因,合成HSP,HSP对细胞损伤具有保护作用。在HSP大家族中,HSP70是一类最保守和最重要的成员,在几乎所有生物的应激细胞中都经常高度地被诱导,广泛参与各种保护机体和细胞的功能[10]。Caprioli等研究发现,HSP70能够对抗由缺血引起的视网膜神经节细胞损伤[11]。Sato等认为,在热休克对神经元细胞产生的保护作用中,HSP70起着至关重要的作用[12]。多项研究表明HSP对视网膜色素上皮具有保护作用,其作用机制可能与增强RPE细胞对氧化应激的耐受性和抑制应激诱导的RPE细胞的凋亡有关。
视网膜静脉阻塞(RVO)是眼科常见的一种缺血性视网膜病变,发病机制至今尚未完全明了。本实验采用免疫组织化学染色法观察散血明目片对实验性视网膜静脉阻塞兔HSP70表达的影响,从另一个方面探讨散血明目片应用于视网膜静脉阻塞的作用机制。结果发现散血明目片组兔视网膜组织中HSP70阳性表达的平均光密度值及其持续时间均较对照组明显增大。说明散血明目片能诱导缺血视网膜组织中HSP70的表达,发挥自身保护作用,从而减小组织损伤。研究表明HSP70对缺血视网膜组织的保护作用可能与其能增强细胞对抗自由基的能力,在应激状态下保护抗氧化酶如SOD等的活性[13],并能维持细胞的正常功能等方面的作用有关。
[1]彭清华.中西医结合眼科学[M].第1版,北京:中国中医药出版社,2010:569.
[2]彭清华,李建超,张 琳,等.散血明目片治疗玻璃体积血的临床及实验研究[J].中国医药学报,2004,19(增刊):61-64.
[3]彭清华,喻京生,曾明葵,等.活血通脉、利水明目法治疗玻璃体积血的临床研究[J]. 湖南中医学院学报,2003,23(1):39-42.
[4]周正申,王 玲,王康孙.视网膜静脉阻塞的动物模型[J].中国实用眼科杂志,2003,21(6):447-451.
[5]彭清华.活血利水法为主治疗视网膜静脉阻塞的临床研究[J].中国中医眼科杂志,1994,4(4):206-209.
[6]张 琳,彭清华,李建超.散血明目片治疗玻璃体积血的实验研究[J].中国中医眼科杂志,2002,12(2):63-66.
[7]李建超,彭清华,赵海滨,等.散血明目片抑制积血所致PVR的实验研究[J].中国中医基础医学杂志,2002,8(11):36-39.
[8]彭清华,彭 俊,张波涛,等.复方中药散血明目片对兔视网膜静脉阻塞 ET-1 表达的影响.国际眼科杂志,2009,9(11):2 075-2 077.
[9]彭清华,彭 俊,曾志成,等.散血明目片对兔视网膜静脉阻塞模型tPA、PAI-1表达的影响 [J].中华中医药杂志,2010,25(8):1 299-1 302.
[10]曲凌云,孙修勤,相建海,等.热休克蛋白研究进展[J].海洋科学进展,2004,22(3):385-386.
[11]Caprioli J,Kitano S,Morgan JE,et a1.Hyperthemia and hypoxia in crease tolerance of retinal ganglion cells to anoxia and excitotoxicit[J].Invest Ophthalmol Vis Sei,1996,37(12):2 376-2 381.
[12]Sato K,Saito H,Matsuki N.HSP70 is essential to the neuroprotective efect of heat shock[J].Brain Res,1996,740(1-2):117-123.
[13]Kita T.The role of heat shock proteins on the disorderd tissues:implication for the pathogenesis and diagnosticsin the forensic-practis[J].Nippon Hoigaka Zasshi,2OOO,54(3):367-371.

