人参总皂苷对免疫低下小鼠免疫功能的影响
周娅红
安徽中医学院第一附属医院(合肥230031)
人参是传统补益中药,具有补气生血、扶正祛邪等功效。人参总皂苷(Saponins of panax ginseng,SPG)是人参主要的有效成分之一,研究证实其具有良好的抗病毒、抗衰老、抗氧化等作用[1-3]。本文通过对复制免疫低下小鼠模型,探讨人参皂苷的免疫调节作用。
1 材料与方法
1.1 材料药物:SPG,安徽省宣城百草植物工贸有限公司;参芪片,吉林制药股份有限公司。动物:昆明种小鼠,体质量(20±2)g,雌雄兼用;ICR小鼠,体质量(18±2)g,雌雄兼用。均由安徽医科大学实验动物中心提供,皖医实动准字02号。试剂:注射用环磷酰胺,江苏恒瑞医药股份有限公司;印度墨汁,北京西中化工厂;二硝基氟苯,上海试剂一厂。仪器:分光光度计722S,上海精密科学仪器有限公司产品;800B低速离心机,上海安亭科学仪器厂。
1.2 人参皂苷对免疫低下小鼠非特异性免疫功能的影响将昆明种小鼠随机分为正常组、模型组、SPG低剂量组(60mg/kg)、SPG中剂量组(120mg/kg)、SPG高剂量组(240mg/kg)及阳性药物组(540mg/kg),每组10只。SPG各组灌胃相应剂量的SPG溶液,阳性药物组灌胃参芪片溶液,每日1次,连续7d。除正常组外,第3日开始各组小鼠腹腔注射环磷酰胺50mg/kg,每日1次,连续2d。第7日所有小鼠尾静脉注入离心后的50%印度墨汁(0.01mL/g),2min和10min后分别摘除眼球取血40μL,并将其加到4mL 0.1%NaHCO3溶液中,在600nm波长测定吸光度值(A),以正常小鼠血加Na2CO3溶液作空白对照。称量小鼠体质量,颈椎脱臼处死小鼠,分离肝脏、脾脏并称湿质量,按下列公式计算:碳廓清指数(K)=(lgA1-lgA2)/(T2-T1);吞噬指数(α)=
1.3 SPG对免疫低下小鼠免疫器官质量的影响记录小鼠体质量,颈椎脱臼处死小鼠,取脾、胸腺并称湿质量,以小鼠脾质量/体质量(mg/10g)和胸腺质量/体质量(mg/10g)作为脾脏和胸腺指数。
1.4 SPG对免疫低下小鼠体液免疫功能的影响
1.4.1 血清IgM溶血素的测定 取昆明种小鼠,分组及给药方法同“1.2”项。第3日所有小鼠腹腔注射10%SRBC 0.2mL致敏。除正常组外,其余各组同时腹腔注射环磷酰胺50mg/kg,连续2d,制备免疫低下模型。致敏后第5日,摘除眼球取血,收集血清并进行800倍稀释,吸取0.5mL稀释血清放入另一试管中,依次加入10%SRBC、补体、生理盐水各0.5mL,空白管用生理盐水代替血清。上述试管置37℃温箱温育1h,离心5min,取上清液,在540nm波长处测定吸光度值。
1.4.2 血清IgG溶血素的测定 分组、给药及致敏方法“1.4.1”项,第1次致敏后5d,用同剂量二硝基氟苯再次致敏小鼠,再次免疫后8d摘除眼球取血。血清加等量2-巯基乙醇,于37℃水浴保温0.5h,随后将血清800倍稀释。取2-巯基乙醇处理后的血清0.5mL和5%SRBC 0.5mL,充分混匀,再加羊抗小鼠IgG和补体各0.5mL,空白管以0.5mL生理盐代替血清。上述试管置37℃温箱温育1h,离心,取上清液,在540nm波长处测定吸光度值。
1.5 迟发型超敏反应(DTH)取ICR小鼠,分组方法同“1.2”项。各组灌胃给予相应药物,连续9d。第3日除抗原攻击的正常组外,每只小鼠腹部涂1%二硝基氟苯丙酮麻油溶液50μL致敏(范围3cm×3cm)。次日同剂量强化1次,除正常组外,各组同时腹腔注射环磷酰胺50mg/kg,每日1次,连续2d,制备免疫低下模型。致敏5d后,将1%二硝基氟苯溶液均匀涂抹于小鼠右耳(两面)进行攻击,对照组同样涂耳但未致敏。攻击24h,颈椎脱臼处死小鼠,剪下左右耳壳,用直径9mm的打孔器打下圆耳片,称质量。以左右耳片之差为肿胀度。
1.6 统计学处理采用SPSS13.0统计软件,计量资料以(x±s)表示,各组均数之间比较进行one-way ANOVA检验。
2 结果
2.1 人参皂苷对免疫低下小鼠非特异性免疫功能的影响见表1。与正常组相比,模型组小鼠碳廓清指数(K)和吞噬指数(α)明显降低(P<0.01);与模型组相比,SPG中、高剂量组及阳性药物组可显著提高小鼠碳廓清指数(K)和吞噬指数(α)(P<0.05或0.01),SPG低、中、高剂量组与阳性药组比较,差异无统计学意义(P>0.05);SPG低、中、高剂量组之间比较,差异无统计学意义(P>0.05),其中以SPG高剂量组的作用最为明显。
表1 各组非特异性免疫功能比较 (±s)
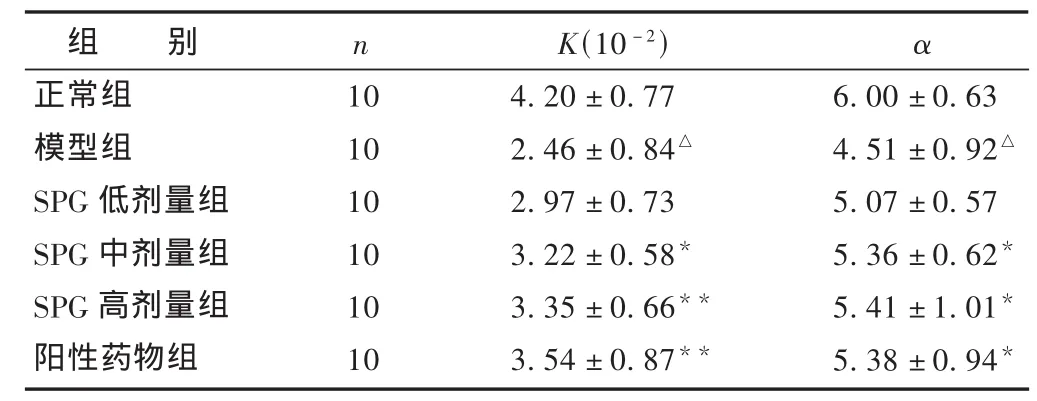
表1 各组非特异性免疫功能比较 (±s)
与模型组比较,*P<0.05,**P<0.01;与正常组比较,△P<0.05;与阳性药物组比较,#P<0.05。下同
组 别n K(10-2)α正常组104.20±0.776.00±0.63模型组102.46±0.84△4.51±0.92△SPG低剂量组102.97±0.735.07±0.57 SPG中剂量组103.22±0.58*5.36±0.62*SPG高剂量组103.35±0.66**5.41±1.01*阳性药物组103.54±0.87**5.38±0.94*
2.2 SPG对免疫低下小鼠免疫器官质量的影响见表2。与正常组相比,模型组小鼠脾脏器指数和胸腺脏器指数显著降低(P<0.01);与模型组相比,SPG中、高剂量组及阳性药物组可显著提高脾脏指数和胸腺指数(P<0.05或0.01),SPG低、中、高剂量组之间比较,差异无统计学意义 (P>0.05),其中以SPG高剂量组的作用最为明显。
表2 各组免疫器官指数比较 (mg/g,±s)
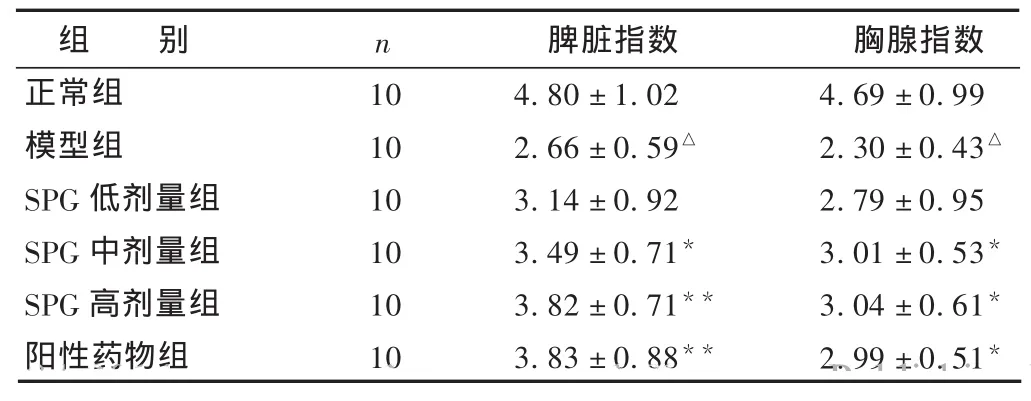
表2 各组免疫器官指数比较 (mg/g,±s)
组 别n脾脏指数 胸腺指数正常组104.80±1.024.69±0.99模型组102.66±0.59△2.30±0.43△SPG低剂量组103.14±0.922.79±0.95 SPG中剂量组103.49±0.71*3.01±0.53*SPG高剂量组103.82±0.71**3.04±0.61*阳性药物组103.83±0.88**2.99±0.51*??
2.3 SPG对免疫低下小鼠体液免疫功能的影响见表3。与正常组相比,模型组小鼠HCIgM、HCIgG水平显著降低(P<0.01);与模型组相比,SPG低、中、高剂量组及阳性药组可显著提高环磷酰胺诱导的免疫低下小鼠HCIgM、HCIgG水平 (P<0.05或0.01),SPG低、中、高剂量组与阳性药物组比较,差异无统计学意义(P>0.05);人参皂苷低、中、高剂量组之间比较,差异无统计学意义(P>0.05),其中以人参皂苷高剂量组的作用最为明显。
表3 各组体液免疫功能及耳肿胀度比较 (±s)
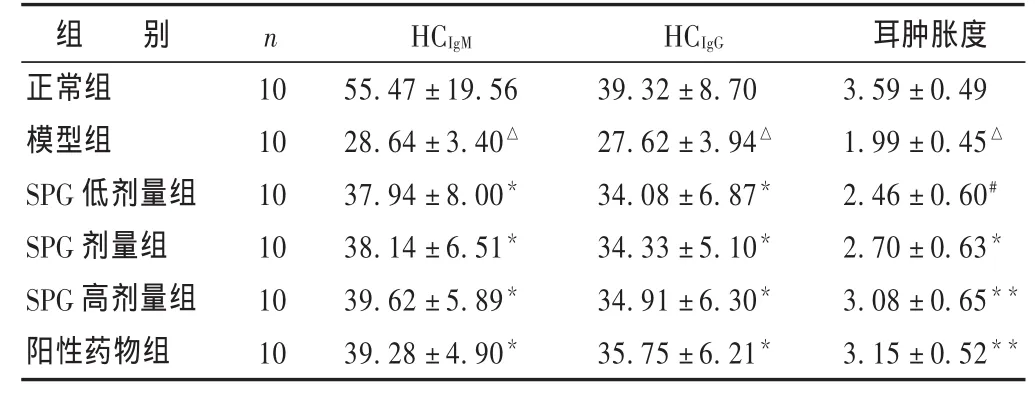
表3 各组体液免疫功能及耳肿胀度比较 (±s)
组 别正常组模型组SPG低剂量组SPG剂量组SPG高剂量组阳性药物组n 10 10 10 10 10 10 HCIgM 55.47±19.56 28.64±3.40△37.94±8.00*38.14±6.51*39.62±5.89*39.28±4.90*HCIgG 39.32±8.70 27.62±3.94△34.08±6.87*34.33±5.10*34.91±6.30*35.75±6.21*耳肿胀度3.59±0.49 1.99±0.45△2.46±0.60#2.70±0.63*3.08±0.65**3.15±0.52**
2.4 SPG对小鼠DTH反应的影响见表3。与正常组相比,模型组小鼠耳肿胀程度明显降低(P<0.01);与模型组相比,SPG中、高剂量组及阳性药物组可使小鼠耳片肿胀度显著增加(P<0.05或0.01),SPG低、中、高剂量组与阳性药物组比较,SPG中、高剂量组无差异无统计学意义(P>0.05),SPG低剂量组作用效果明显低于阳性药物组(P<0.05);SPG低、高剂量组之间差异有统计学意义(P<0.05),提示SPG高剂量组作用效果最为明显。
3 讨论
环磷酰胺是一种烷化类的免疫抑制剂,可杀伤淋巴细胞,抑制免疫反应。环磷酰胺所致免疫低下小鼠是研究药物免疫调节作用的经典动物模型[4]。机体免疫系统由非特异性免疫、体液免疫和细胞免疫共同构成的防御系统。脾脏及胸腺是机体的两个主要免疫器官,是机体防御机能发挥的重要环节,其脏器指数是衡量机体免疫功能的初步指标[5]。本实验结果表明,SPG低、中、高剂量组之间,各剂量组与阳性药物之间作用强度差异虽无统计学意义,但SPG中、高剂量组可提高免疫低下小鼠脾指数和胸腺指数,提示中、高剂量的SPG能够对机体细胞免疫和体液免疫功能起到很好的保护。
小鼠碳廓清实验中所测得的廓清指数(K)可反映网状内皮系统的吞噬功能,吞噬指数(α)则反映单核-巨噬细胞的吞噬能力。而单核巨噬细胞的吞噬功能是衡量机体非特异性免疫功能的指标之一[6]。本实验结果表明,SPG各剂量组与阳性药物之间作用强度差异无统计学意义,但SPG中、高剂量组可显著提高环磷酰胺诱导的免疫低下小鼠碳廓清指数(K)值和吞噬指数(α值),对免疫低下小鼠的非特异性免疫功能有促进作用。
血清溶血素HCIgM、HCIgG可以代表抗体量,因此HCIgM、HCIgG的水平可以反映体液免疫功能[7]。本实验结果表明,SPG低、中、高剂量组可提高明显提高其低下的HCIgM、HCIgG水平,提示SPG对体液免疫有保护作用,且各剂量组之间、各剂量组与阳性药物组之间作用强度差异无统计学意义。
DTH是依赖细胞免疫的反应,其实质是变应原引起的T细胞介导为主的炎症反应。变应原使TH细胞活化,促使形成致敏的TD和TC细胞,当机体再次接触相同变应原时,TD细胞释放出多种淋巴因子,导致反应局部组织发生以单核细胞浸润为主的炎症反应,与机体细胞免疫能力相一致[8]。本实验结果表明,SPG中、高剂量组可使小鼠耳片肿胀度显著增加,且SPG低剂量组作用强度与人参皂苷中、高剂量组、阳性药物组相比具有显著差异,提示SPG中、高剂量组可以改善免疫低下小鼠DTH反应,对小鼠特异性细胞免疫功能有促进作用。
综上所述,SPG对免疫低下小鼠非特异性免疫、体液免疫、细胞免疫功能具有一定的促进作用,以SPG高剂量作用最为显著,其具体作用机制有待进一步探讨。
[1]赵莲芳,郑玉淑,朴惠顺,等.黄芪多糖及人参总皂苷对衰老小鼠的抗衰老作用 [J].延边大学医学学报,2006,29(4):249-251.
[2]王毅,郝钰,邱全瑛.人参皂苷Rg1及Rh1对树突状细胞刺激T细胞增殖及LPAK抗肿瘤活性的影响 [J].中国免疫学杂志,2003,19(4):248.
[3]许立,刘晓军,张莉.人参总皂苷对小鼠睾丸NO、NOS及总抗氧化能力的影响[J].武警医学院学报,2006,15(5):507-508.
[4]胡成穆,陈琳,李荣,等.豹皮樟总黄酮对免疫低下小鼠免疫功能的影响[J]. 中国药理学通报,2007,23(6):804-808.
[5]卢金福,邵家德,杜萍,等.灵仙通络丸对大鼠佐剂关节炎及小鼠DTH反应的影响 [J].南京中医药大学学报,2004,20(4):223-225.
[6]王玉凤,凤良元,鄢顺琴,等.楮实子对环磷酰胺致免疫功能低下小鼠免疫功能的影响 [J].中华中医药学刊,2008,26(5):1023-1025.
[7]李荣,李俊,胡成穆,等.橙皮苷对免疫功能低下小鼠免疫调节作用的实验研究[J].中国药理学通报,2007,23(2):169-172.
[8]戈士文,高元法,朱建立,等.痹痛清胶囊对小鼠免疫功能影响的实验研究[J]. 中成药, 2003, 25(10):850-851.

