ATP对髓袢升支粗段管周膜50pS钾通道的调节
张成标,杨 雷,谷瑞民
(1.徐州医学院麻醉学重点实验室,江苏徐州 221002;2.哈尔滨医科大学药理学教研室,黑龙江哈尔滨 150086)
肾脏髓袢升支粗段(thick ascending limb of henle’s loop)对NaCl的主动重吸收,启动了髓质渗透梯度建立,在尿液的浓缩和稀释中发挥重要作用。髓袢升支粗段对NaCl主动转运的动力来自上皮细胞管周膜上的钠-钾泵,而管周膜上的钾通道也参与了NaCl的主动转运过程。由于钾通道的活性受多种内源性活性物质或药物的影响[1-2],而钠-钾泵活动必然引起细胞内ATP浓度发生变化,因此,ATP对管周膜钾通道是否有调节作用值得探讨。髓袢升支粗段管周膜存在多种不同电导的钾通道,其中50 pS钾通道数量最多,提示其可能在NaCl的主动转运中起重要作用。本实验利用单通道膜片钳技术,观察ATP对髓袢升支粗段管周膜50 pS钾通道活动的影响,进一步阐明髓袢升支粗段对NaCl的重吸收机制,为开发新的高效、安全利尿药提供理论依据。
1 材料与方法
1.1 肾小管的分离 健康SD(Sprague-Dawley)大鼠,体质量70~100 g,♀♂不限。由哈尔滨医科大学第二临床学院实验动物中心提供。大鼠在颈关节脱位后,立即打开腹腔取出肾脏,去除包膜,从肾脏的中间部分用刀片切出厚0.5~1 mm的冠状切片,浸入浓度为1 g·L-1胶原酶溶液,放进37℃恒温水浴箱中消化45~60 min。在体视显微镜下分离出肾小管髓袢升支粗段,放在涂有多聚赖氨酸的载玻片(5 mm×5 mm)上固定并移送至膜片钳系统的细胞记录槽中。
1.2 膜片钳单通道记录 用PP-830型微电极拉制仪(Narishige,日本)两步拉制玻璃微电极,微电极尖端的直径约为0.5~1.0 μm,拉制完成后再适度抛光。在内充电极内液时,电极的入液电阻为20~50 MΩ。
选取清洁、光滑、完整、结构清晰的肾小管进行膜片钳实验。本实验主要采用细胞贴附式(cell-attached)和内面向外式(inside-out)两种单通道电流记录方法。对经胶原酶消化过的髓袢升支粗段肾小管的管周膜进行封接,形成高阻封接后即形成细胞贴附式记录模式。在细胞贴附式记录模式下,向上提起玻璃微电极出液面后再入液即形成内面向外式记录模式。
实验使用的膜片钳系统Axopatch200B膜片钳放大器、Digidata 1322模-数转换器、记录和分析软件为pCLAMP 9.2(Axon公司,美国)。采样频率为10 kHz,滤波频率为0.2 kHz。用通道总开放概率NP0作为衡量通道活性大小的指标,它是单个通道开放概率(open probability,P0)与通道开放数(N)的乘积,其数值可用公式NP0=Σ(1×t1+2×t2+…+i×ti)计算。公式中的i表示通道开放的电流水平,在该水平有i个通道同时开放;ti表示通道在该水平开放的持续时间占总时间的分数。
1.3 实验溶液及药品 电极内液(mmol·L-1):KCl 140,MgCl21.8,HEPES 10(pH=7.4)。浴液(mmol·L-1):NaCl 140,KCl 5,CaCl21.8,MgCl21.8,HEPES 10(pH=7.4)。胶原酶(Collagenase type IA,购于Sigma公司)溶液在每次实验时临时配制,每次称取1~2 mg,用浴液稀释成浓度为1g·L-1的酶溶液。ATP(购于Sigma公司)先用浴液配制成一定浓度的母液冻存或置于0~4℃备用,实验时用微量加样器抽取一定量的药液加入细胞记录槽,使浴槽中的药物浓度达到实验要求。
1.4 剂量-效应关系 在形成内面向外式记录模式后,每隔5 min依次向浴槽内加入一定量的ATP母液,使浴液中的ATP浓度分别达到0、0.2、0.4、0.6、0.8、1.0 mmol·L-1,观察不同浓度的 ATP 对50 pS钾通道活动的影响,并绘制剂量反应曲线。
2 结果
2.1 记录通道类型及电导大小的确定 实验中记录到的单通道电流能被钾通道阻断剂Ba2+阻断(Fig 1),证明其是钾通道。该通道的单通道电流大小随着钳制电压的变化而变化,以电压为横坐标、电流为纵坐标可作出电流-电压(I-U)曲线(Fig 2),根据曲线斜率计算出通道电导约为50 pS。在髓袢升支粗段管周膜记录到的单通道电流中,50 pS钾通道电流出现的频率最大,约占钾通道电流总数的75%。

Fig 1 The effect of 1mmol·L-1Ba2+(BaCl2was added to the bath solution)on channel activity in an inside-out patch Holding potential was 0 mV;C:channel-closed level
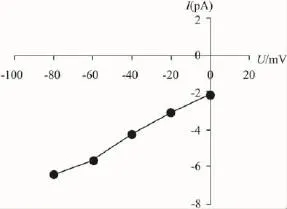
Fig 2 Current(I)-voltage(U)curve of 50 pS K+channel obtained from a cell-attached patch
2.2 ATP对髓袢升支粗段50 pS钾通道活性的影响
2.2.1 在细胞贴附式(cell-attached)膜片钳记录模式下,ATP对50 pS钾通道活性的影响 在钳制电压为0 mV时,形成细胞贴附式封接并记录50 pS钾通道电流,记录3~5 min后向浴槽内加入一定量的ATP母液,使浴液中的ATP浓度达到1.0 mmol·L-1。加药前后50 pS钾通道的开放概率分别为0.42±0.21和0.38±0.20,两者差异无显著性(n=8,P>0.05)。Fig 3是一例典型的膜片钳记录,显示在细胞贴附式膜片钳模式下,1.0 mmol·L-1ATP对50 pS钾通道活性无影响。
2.2.2 在内面向外式(inside-out)记录模式下,ATP对50 pS钾通道活性的影响 在细胞贴附式记录模式下,提起玻璃微电极出液面后再入液,即可形成内面向外式单通道电流记录模式。先记录3~5 min,然后向浴槽内加入ATP使其浓度达到1.0 mmol·L-1,结果该浓度的ATP抑制了50 pS钾通道的开放,NPo从加药前的0.46±0.28降低到0.02±0.04(n=8,P<0.01),将 ATP洗脱后 NPo恢复到0.41±0.25。Fig 4是一例典型的内面向外式单通道记录,显示1.0 mmol·L-1ATP对50 pS钾通道具有可逆性抑制效应。
剂量反应曲线表明,ATP对50 pS钾通道的抑制作用与其浓度正相关(Fig 5)。

Fig 3 Effect of 1 mmol·L-1ATP on the activity of the basolateral 50 pS K+channel in the TAL of rat kidney in cell-attached patches

Fig 4 Effect of 1 mmol·L-1ATP on the activity of the basolateral 50 pS K+channel in the TAL of rat kidney in inside-out patches
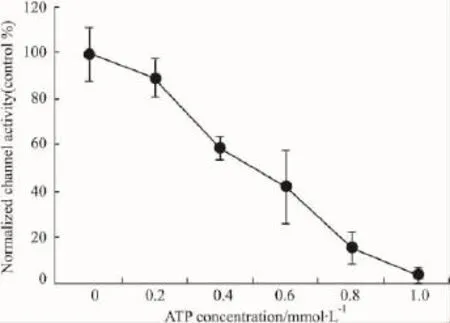
Fig 5 The dose-response curve of the ATP effect on the basolateral 50 pS K+channels in inside-out patches
3 讨论
肾脏髓袢升支粗段对Na+和Cl-的主动重吸收是髓质渗透梯度建立的直接动力,在尿液的浓缩和稀释方面发挥重要作用。这种作用与髓袢升支粗段的特殊结构有关,该段肾小管上皮细胞的管腔膜存在Na+-2Cl--K+同向转运体,而管周膜上有钠-钾泵和氯通道,Na+-2Cl--K+转运体将小管液中的Na+、K+和Cl-转运至细胞内,钠-钾泵和氯通道再将细胞内Na+和Cl-转运至组织间液。髓袢升支粗段上皮细胞的管周膜和管腔膜上均存在钾通道,这些通道在NaCl的主动转运过程中也发挥重要作用,因为钾通道将进入细胞内的K+(通过Na+-2Cl--K+同向转运体和钠-钾泵)即时地转运至细胞外,维持了上述转运过程的正常进行。因此,管周膜上的钠-钾泵与钾通道在功能上是偶联的。细胞内ATP含量的变化可能是将二者联系起来的关键因素,因为钠-钾泵活动会引起细胞内ATP浓度发生变化,而钾通道家族中存在ATP敏感钾通道。除了ATP以外,腺苷也可能是将钠-钾泵与钾通道活动偶联起来的关键物质,因为钠-钾泵活动的增强或减弱不仅引起细胞内ATP消耗增多或减少,也使经ATP分解代谢途径生成的腺苷发生相应的变化,而腺苷对髓袢升支粗段管周膜钾通道有激活作用[5]。但腺苷对管周膜钾通道的激活作用只发生在高浓度(1 μmol以上)的情况下,生理浓度(50~200 nmol·L-1)的腺苷对髓袢升支粗段管周膜钾通道并无激活作用[3-4],提示在生理条件下,腺苷并不参与管周膜钾通道活动的调控,可能在某些病理生理条件下(如缺血、缺氧等),组织细胞释放大量腺苷时才影响钾通道的功能。我们在髓袢升支粗段管周膜膜片钳实验中记录到最多的是50 pS钾通道,这与文献报道[5-6]一致,提示50 pS钾通道具有重要功能。本实验显示,在内面向外式记录模式下,1 mmol·L-1的ATP几乎完全阻断了髓袢升支粗段管周膜50 pS钾通道的开放,而在细胞贴附模式下,同样浓度的ATP对50 pS钾通道的活性无明显影响。剂量反应曲线表明,在内面向外式记录模式下,ATP对髓袢升支粗段管周膜50 pS钾通道的抑制作用具有剂量依赖性。这些结果说明,细胞内ATP含量的变化是调节50 pS钾通道活性的重要因素。ATP敏感性钾通道广泛存在于肌肉、神经、腺垂体等可兴奋性组织以及肾小管上皮、卵泡的卵母细胞等非兴奋性组织[7-8],受细胞内 ATP 浓度的调控,因此,髓袢升支粗段管周膜50 pS钾通道可能是一种ATP敏感性钾通道。在基础条件下,细胞内ATP的浓度约为3~5 mmol·L-1,但在进行某些耗能活动时(如物质跨膜转运),细胞内的 ATP浓度可降至1 mmol·L-1以下[9],在内面向外式记录模式下,1 mmol·L-1的ATP几乎完全抑制50 pS钾通道的开放,表明在基础条件下,髓袢升支粗段管周膜50 pS钾通道可能受到高浓度ATP的抑制而处于关闭状态,但当NaCl的主动重吸收明显增强时,细胞内ATP浓度降低,对50 pS钾通道的抑制作用减弱,钾通道开放概率逐渐增加,从而将因钠-钾泵活动增强而涌入细胞内的K+及时地转移至细胞外(组织间液),维持细胞内外正常的K+浓度梯度和正常的膜电位水平,使髓袢升支粗段对NaCl的主动重吸收能持续地进行。因此,髓袢升支粗段管周膜50 pS钾通道受细胞内ATP调控,这种调控作用的意义可能是把钾通道和钠-钾泵在功能上联系起来。
[1]陈玉萍,潘志远,崔文玉,汪 海.埃他卡林新衍生物激活ATP敏感性钾通道的亚型选择性[J].中国药理学通报,2008,24(11):1427-30.
[1]Chen Y P,Pan Z Y,Cui W Y,Wang H.Selectivity of new iptakalim derivatives on the subtypes of ATP-sensitive potassium channels[J].Chin Pharmacol Bull,2008,24(11):1427 -30.
[2]张国红,耿 仙,张 璇,等.双苯氟嗪对爪蟾卵母细胞上表达的hERG钾通道电流的影响[J].中国药理学通报,2009,25(1):39-44.
[2]Zhang G H,Geng X,Zhang X,et al.Effect of dipfluzine on hERG potassium currents expressed in xenopus oocytes[J].Chin Pharmacol Bull,2009,25(1):39 - 44.
[3]Gu R M,Wang J,Zhang Y H,et al.Adenosine stimulates the basolateral 50 pS K channels in the thick ascending limb of the rat kidney[J].Am J Physiol,2007,293(1):F299 -305.
[4]Vallon V,Mühlbauer B,Osswald H.Adenosine and kidney function[J].Physiol Rev,2006,86(3):901 -40.
[5]Gu R M,Jin Y,Zhai Y Y,et al.PGE2inhibits basolateral 50 pS potassium channels in the thick ascending limb of the rat kidney[J].Kidney Int,2008,74(4):478 -85.
[6]Gu R M,Wang W H.Arachidonic acid inhibits K channels in basolateral membrane of the thick ascending limb[J].Am J Physiol,2002,283(3):F407 -14.
[7]朱庆磊,汪 海,肖文彬.ATP敏感性钾通道分子结构和功能的组织特异性研究进展[J].中国药理学通报,2001,17(2):121-7.
[7]Zhu Q L,Wang H,Xiao W B.Tissue specificity in structure and function of ATP-sensitive potassium channel[J].Chin Pharmacol Bull,2001,17(2):121 -7.
[8]贾春红,张 鸿,李 佳,等.ATP敏感性钾通道开放剂吡那地尔增高Bcl-2表达而抑制PC12细胞缺血性凋亡[J].中国药理学通报,2009,25(7):927 -31.
[8]Jia C H,Zhang H,Li J,et al.Pinacidil,an ATP-sensitive potassium channel opener,inhibits ischemic apoptosis via up-regulating Bcl-2 expression in PC12 cells[J].Chin Pharmacol Bull,2009,25(7):927-31.
[9]Fitz J G.Regulation of cellular ATP release[J].Trans Am Clin Climatol Assoc,2007,118:199 -208.
- 中国药理学通报的其它文章
- 围绝经期睡眠障碍研究进展
- 活性氧对P-糖蛋白调节作用的研究进展

