猪脑心肌炎病毒GXLC株VP1基因的克隆与序列分析*
陈进喜,施开创,屈素洁,郑 敏,李向涛,陈宏备,许瑞胜
(1.钦州市动物疫病预防控制中心,广西钦州 535000;2.广西动物疫病预防控制中心,广西南宁 530001;3.广西大学动物科学技术学院,广西南宁 530005)
猪脑心肌炎病毒GXLC株VP1基因的克隆与序列分析*
陈进喜1,施开创2*,屈素洁2,郑 敏2,李向涛3,陈宏备3,许瑞胜3
(1.钦州市动物疫病预防控制中心,广西钦州 535000;2.广西动物疫病预防控制中心,广西南宁 530001;3.广西大学动物科学技术学院,广西南宁 530005)
应用RT-PCR方法扩增猪脑心肌炎病毒GXLC株的VP1基因,扩增产物克隆入pMD 18-T载体后进行测序,对获得的VP1基因序列进行分析。序列分析表明,GXLC株VP1基因长度为831 bp,编码277 aa,含有2个潜在的N-糖基化基序和9个抗原表位。同源性分析表明,GXLC株与国内外其他26个EMCV分离株VP1基因核苷酸序列的同源性在78.6%~99.6%之间、氨基酸序列的同源性在95.1%~99.3%之间。遗传进化分析表明,基于VP1基因序列绘制的系统进化树可以将所有EMCV分离株分成两个群,即Ⅰ群和Ⅱ群,Ⅰ群可再细分为Ⅰa亚群和Ⅰb亚群,其中猪源、鼠源EMCV在Ⅰ群和Ⅱ群中均有分布,人源EMCV则分布在Ⅱ群;GXLC株与其他中国分离株均属于Ⅰa亚群。
猪;脑心肌炎病毒;VP1基因;分子特征
脑心肌炎病毒(Encephalomyocarditis virus,EMCV)属于微RNA病毒科心病毒属,可以感染多种家畜、野生动物和人类,鼠类是其自然贮存宿主。EMCV主要引起断奶仔猪的脑炎、心肌炎、突然死亡及母猪的繁殖障碍。EMCV在病毒粒子形成过程中,其前体蛋白最终裂解为结构蛋白1A(VP4)、1B(VP2)、1C(VP3)、1D(VP1)和非结构蛋白 2A、2B、2C 、3A 、3B、3C 、3D。其中,结构蛋白 VP1 的抗原性最强,且与病毒粒子表面的拓扑结构、抗原性、受体吸附及脱壳有关[1-2]。VP1蛋白刺激小鼠产生的多克隆抗体具有中和活性,可以中和EMCV在小鼠体内的感染能力,表明VP1蛋白是 EMCV重要的保护性抗原[3-4]。VP1基因核苷酸突变导致所编码氨基酸的变异可造成病毒血凝活性的丧失、病毒受体结合位点的改变,从而导致EMCV在致糖尿病型和非糖尿病型之间的转变[5-6],表明VP1基因对EMCV的致病性发挥重要作用。本研究对EMCV GXLC株VP1基因进行克隆和分子特征分析,为进一步开展EMCV的致病和免疫机制研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 病毒 EMCV GXLC株于2008年5月从广西陆川县某猪场一头表现为急性心肌炎、经 realtime PCR检测为EMCV阳性[7]的断奶仔猪的心、脾组织中分离和鉴定,GenBank登录号为FJ897755[8],由广西动物疫病预防控制中心分离并保存。病毒在BHK-21细胞系上传至第3代用于VP1基因序列测定。
1.1.2 主要试剂TaqDNA聚合酶、M-MLV反转录酶、HindⅢ和EcoRⅠ限制酶、胶回收试剂盒、pMD 18-T载体等购自宝生物工程(大连)有限公司;总RNA提取试剂盒、质粒DNA小量提取试剂盒购自杭州博日科技有限公司;E.coliDH5α感受态细胞购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 引物 参考猪EMCV BJC3株(GenBank登录号:DQ464062)基因序列,设计并合成覆盖完整VP1基因的特异性引物 EMCV-VP1-F:5′-ACTCAAGATGCCTATCTCAC-3′和 EMCV-VP1-R:5′-CCAAAAT TGTCCATGTCTAAAC-3′,扩增预期大小为979 bp的基因片段。
1.2.2 病毒RNA的提取及RT-PCR 取细胞培养后的病毒上清液,按试剂盒操作说明提取总RNA。采用九聚体寡核苷酸引物为反转录引物,以总RNA为模板,用M-MLV反转录酶进行反转录,获得cDNA。以cDNA为模板,应用特异性引物,进行PCR扩增 。25 μ L 反应体系:cDNA 模板 2.0 μ L,10 ×缓冲液 2.5 μ L,dNTP(2.5 mmol/μ L)2.0 μ L,TaqDNA 聚合酶(5 U/μ L)0.5 μ L,上、下游引物(25 pmol/μ L)各 0.5 μ L,ddH2O 17 μ L 。 反应参数:94℃5 min;94℃45 s,56℃45 s,72℃1 min,35个循环;72℃10 min。反应结束后,以15 g/L琼脂糖凝胶电泳验证扩增产物。
1.2.3 PCR扩增产物的克隆与VP1基因序列的测定 PCR扩增产物用琼脂糖凝胶进行电泳后,采用胶回收试剂盒进行纯化。纯化的目的片段与pMD 18-T载体连接,转化E.coliDH5α。经蓝白斑筛选,挑出阳性克隆,增菌培养后,用质粒抽提试剂盒抽提质粒,进行酶切鉴定。测序由宝生物工程(大连)有限公司采用M13和M13RV通用引物进行双向测序。利用DNA Star软件包中的SeqMan程序和测序峰图软件Chromas2.22对测序结果进行拼接,获得VP1基因序列。
1.2.4 VP1蛋白特性分析 运用DNA Star软件包中的Protean程序对EMCV GXLC株VP1蛋白的亲水性(Kyte-Doolittle法预测)、抗原指数(Jameson-Wolf法预测)、表面可能性(Emimi法预测)进行分析。
1.2.5 VP1基因同源性分析 运用DNA Star软件包,对GXLC株及从NCBI GenBank下载的其他26株EMCV参考毒株(见表1)VP1基因的核苷酸序列及其推导的氨基酸序列进行同源性分析。
1.2.6 VP1基因系统进化分析 基于EMCV VP1基因的核苷酸序列,运用MEGA3.1软件包中的Neighbor-joining方法,以Mengo-M分离株作为外类群(outgroup)绘制系统进化树。
2 结果
2.1 EMCV VP1基因的PCR扩增及重组质粒鉴定
应用设计的引物进行PCR,得到与预期目的片段大小一致的扩增产物。产物经纯化、连接到pMD 18-T载体、转化到DH5α感受态细胞,获得阳性克隆菌。经酶切鉴定和PCR鉴定,表明已成功获得EMCV VP1基因的重组质粒(图1)。
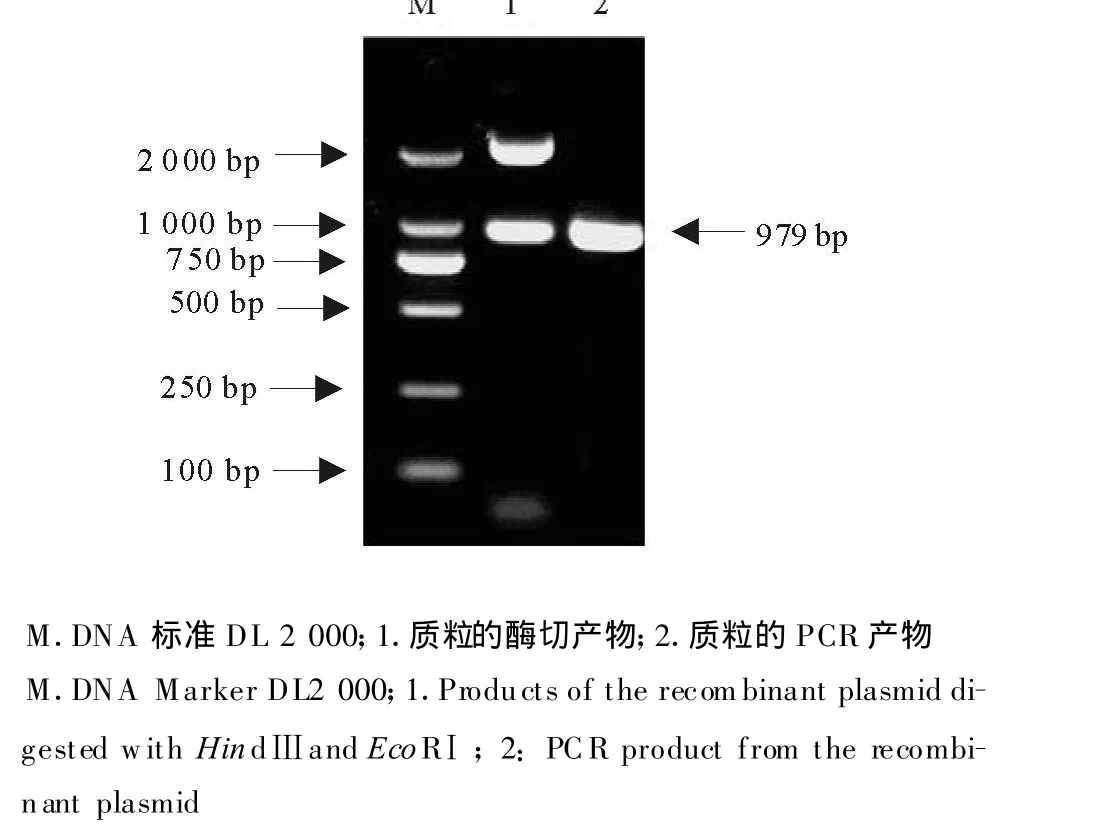
图1 EMCV VP1基因的重组质粒鉴定Fig.1 Identification of the recombinant plasmid with VP1 gene of EMCV
2.2 EMCV VP1基因序列
对重组质粒中插入的VP1基因目的片段进行双向测序和拼接后,获得EMCV GXLC株VP1基因序列,全长为831 bp,编码 277 aa(图2)。

图2 EMCV GXLC株VP1基因的核苷酸序列及其推导的氨基酸序列Fig.2 T he nucleotide sequence and deduced amino acid sequence of VP1 gene of EMCV GXLC strain
2.3 VP1蛋白特性分析及其抗原表位预测
GXLC株的VP1蛋白由277 aa组成,有2个潜在的N-糖基化基序,分别为N29QT和N62QT。按照Kyte-Doolittle法的氨基酸亲水性标准,VP1蛋白亲水性较高的区域主要在0~17、25~36、37~42、75~113、147~ 158、164~ 175、202~ 212、239~ 249和259~268位氨基酸区段;根据 Emimi原则推测,VP1蛋白的 11~ 15、27~32、38~ 41、73~ 90、96~100、106 ~ 111、149~155、166~ 173、203 ~ 210 和239~245位氨基酸区段出现在蛋白质表面的可能性比较大,而且这些区段均位于VP1蛋白的亲水区域;根据Jameson-Wolf法预测结果显示,VP1蛋白大多数区域的抗原性指数都比较高,其中1~18、26~ 33、37~ 44、48~ 58、74~ 90、93~ 102、104~ 112、147~ 156、163 ~172、203~ 214、217~ 225、229~237、247~252和258~272位氨基酸区段的抗原指数最为显著(图3)。根据以上结果,预测 EMCV GXLC株VP1有9个抗原表位,分布在EPVP1-1(P27ENQTK)、EPVP1-2(Y37DRSS)、EPVP1-3(A80YDQLR PQRLT)、EPVP1-4(G96NEETS)、EPVP1-5(K107SKQDY)、EPVP1-6(T150PTKPT T)、EPVP1-7(G168RTPQV)、EPVPVP1-8(G204HKRFD)和EPVP1-9(Y242KNMRV)。
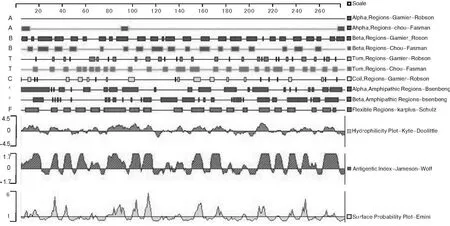
图3 EMCV GXLC株VP1蛋白特性预测Fig.3 Prediction on antigen sites and some characters of VP1 protein of EMCV GXLC strain
2.4 VP1基因同源性分析
将GXLC株VP1基因的核苷酸序列及其推导的氨基酸序列与其它参考毒株进行同源性比较的结果见表1。GXLC株与国内外分离株VP1基因核苷酸序列的同源性在78.6%~99.6%之间、氨基酸序列的同源性在95.1%~99.3%之间。其中,GXLC株与GX0601、GX0602、BJC3、HB1等中国分离株的核苷酸同源性高达99.2%以上、氨基酸序列同源性在98.6%以上。值得注意的是,GXLC株与其他分离株VP1基因的核苷酸序列同源性最低仅为78.6%,而氨基酸序列同源性均在95.1%以上,说明部分核苷酸碱基的突变并未导致所编码氨基酸的改变,属于沉默突变。
2.5 VP1基因系统进化分析
基于EMCV VP1基因核苷酸序列绘制系统发育进化树(图4),EMCV可分为2个群:Ⅰ群和Ⅱ群,而I群又可以进一步细分为Ⅰa亚群和Ⅰb亚群。猪源、鼠源EMCV在Ⅰ群和Ⅱ群中均有分布,人源EMCV则分布在Ⅱ群。值得注意的是,来源于亚洲国家的EMCV分离株均分布在Ⅰa亚群,而Ⅱ群中的猪源分离株均来源于欧洲国家。GXLC株与中国其他分离株均属于Ⅰa亚群。
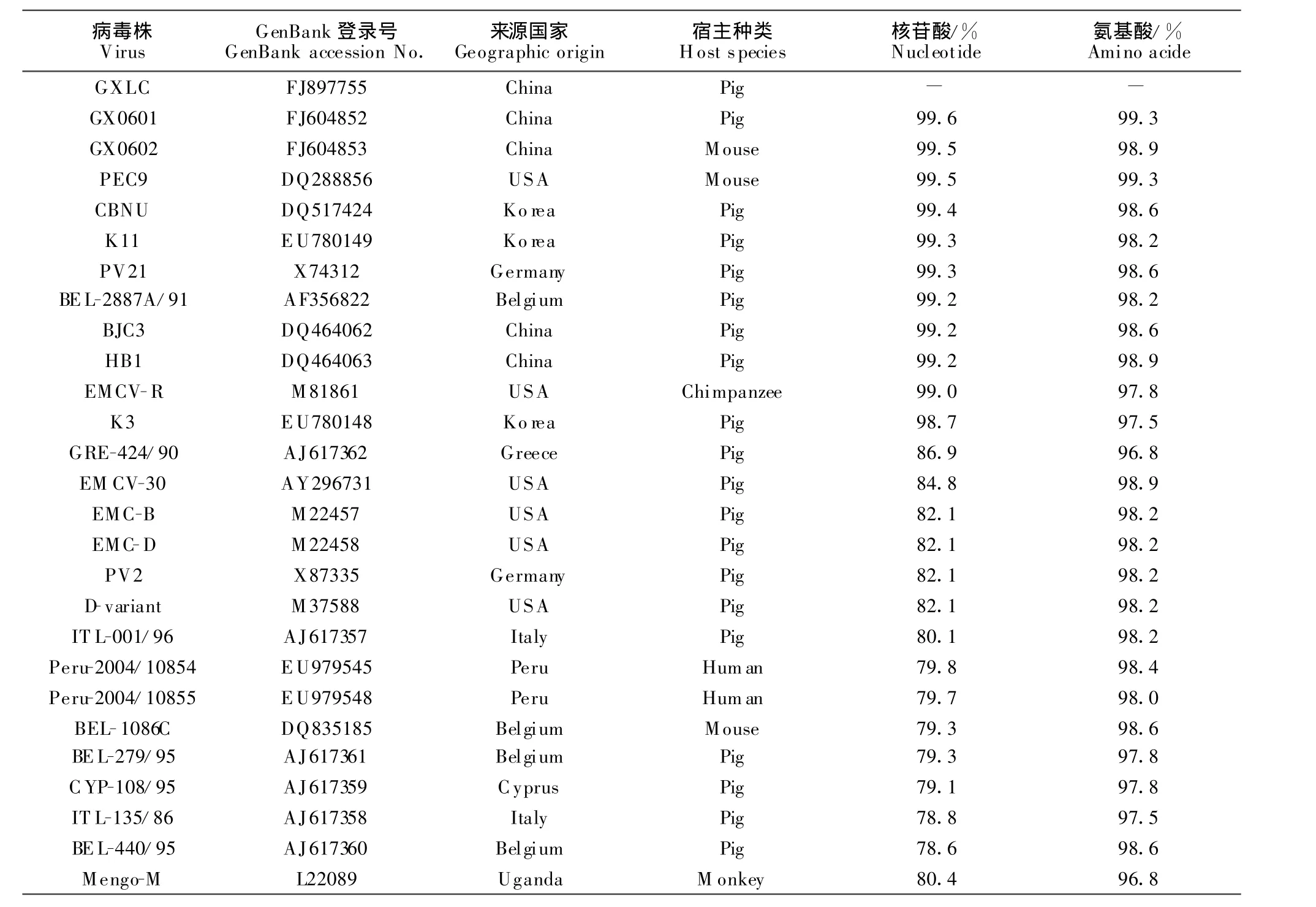
表1 GXLC株与其他EMCV参考株VP1基因核苷酸及推导的氨基酸序列同源性比较Table 1 Homological comparison of the nucleotide and deduced amino acid sequences of VP1 gene of GXLC strain with other EM CV isolates
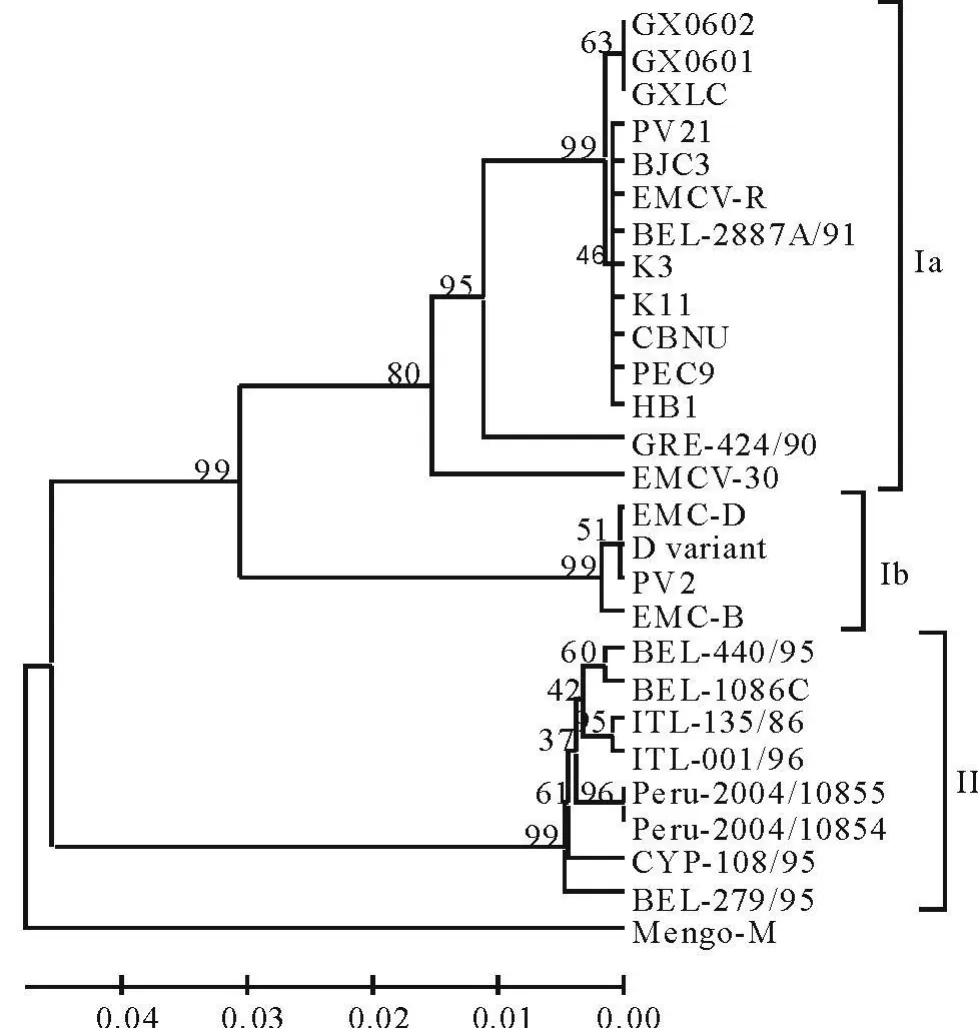
图4 基于EMCV VP1基因核苷酸序列的系统进化树Fig.4 Phylogenetic tree based on EMCV VP1 gene nucleotide sequences
3 讨论
EMCV的中和表位主要存在于VP1、VP2和VP3,其中VP1是EMCV最重要的中和性抗原表位所在的区域[1,9]。原核表达的VP1蛋白经Western blot检测证实具有抗原活性[10],以VP1蛋白免疫小鼠可以产生保护性中和抗体、提供针对EMCV的保护力[2-4],因此可以将VP1制备诊断抗原,同时VP1基因在设计基因工程疫苗时也有重要的应用价值。序列分析表明,EMCV GXLC株VP1基因长度为831 bp,编码277 aa,预测存在9个抗原表位,分布在27~ 32、37~ 41、80~ 90、96~ 101、107~ 112、150~156、168~173、204~209和 242~247位氨基酸区段。对于这些抗原表位的预测,可以利用噬菌体展示技术等方法加以证实。
同源性比较表明,不同来源的EMCV分离株多以结构蛋白VP1变异最大[8],同时VP1是 EMCV最重要的中和性抗原表位所在的区域[1],因此VP1成为EMCV研究的重点。本研究中,GXLC株与其他分离株VP1基因核苷酸序列的同源性在78.6%~99.6%之间,变异较大,提示 EMCV结构蛋白VP1作为病毒主要中和表位所在的区域,受到选择压力的影响,VP1基因不断发生变异以维持EMCV的存活。同时,VP1氨基酸序列的同源性在95.1%~99.3%之间,提示在选择压力下多数核苷酸的变异属于沉默变异,并没有导致相应氨基酸的改变,VP1的结构和功能仍得以保持。由于VP1是EMCV最重要的中和性抗原表位所在区域,也是基因序列变异较大的区域,对VP1的分析能使我们对EMCV的致病性及遗传变异有更好的了解,因此VP1基因成为开展EMCV分子流行病学研究的重点区域[11-12]。
基于VP1基因序列的系统发育进化树,可将所有EMCV分离株区分为Ⅰ群和Ⅱ群,猪源、鼠源EMCV在两个群中均有分布,并且亲缘关系很近,所以鼠类传播EMCV的作用不容忽视。有研究发现,鼠类是猪脑心肌炎暴发流行风险因子中的关键因素[13],发病猪场内及周边的老鼠体内可以检测出EMCV,而老鼠本身不表现任何异常症状,仅是作为EMCV贮存库存在[14-15]。因此,搞好猪场内及周边的灭鼠工作对有效防控猪脑心肌炎至关重要。最近,Oberste M S等[16]报道从秘鲁两名表现恶心、头痛和呼吸困难的病人血清中分离到EMCV,对病毒VP1基因90%的序列进行分析,发现与猪源EMCV分离株的同源性高达91.7%~99.9%。本研究中,2株人源 EMCV分离株(Peru-2004/10854、Peru-2004/10855株)在进化树中属于Ⅱ群,与同群的猪源、鼠源EMCV分离株亲缘关系很近,因此,人、猪、禽在EMCV感染与传播中的相互关系令人瞩目。但是,由于人源EMCV分离株及其基因序列的信息极少,要准确分析脑心肌炎暴发流行中人、猪、禽的作用及相互关系,还有待于EMCV分子流行病学和分子生态学研究的进一步积累。
不同EMCV分离株其致病性有所差异[17]。研究表明,VP1基因与病毒致病性密切相关[11]。Nelsen-Salz B等[5]发现致糖尿病(PV2株)与非致糖尿病(PV7株)EMCV变异株的差异仅仅是VP1第63位氨基酸残基发生突变(Gln→Glu)。Denis P等[18]报道,引起仔猪心肌炎的一株病毒(BEL-279/95株)在BHK-21细胞系中传210代后,对仔猪的致病性减弱,其VP1第62位氨基酸残基发生突变(Asn→Asp)。Guy M 等[19]将EMCV 1086C株在大鼠BRL细胞传代29代后,病毒适应了细胞,产生高滴度的病毒和明显的细胞病变,进一步研究发现是VP1第49位氨基酸残基发生了突变(Lys→Glu),使病毒获得与细胞表面受体唾液酸残基结合的能力。而上述VP1第49、62、63位氨基酸残基均位于 EMCV第4个中和表位,并且处在连接VP1 βB和βC链的连接环的表面从而易于与细胞受体结合,提示EMCV对应于第4个中和表位的区域与细胞表面受体、病毒致病性有关[19]。可见,VP1与受体结合、病毒中和及病毒毒力之间具有密切联系。因此,研究EMCV毒株VP1基因的分子特征,有助于分析分离株的毒力与致病作用。GXLC株与国内外其他EMCV分离株VP1氨基酸序列的同源性在95.1%~99.3%之间,与 PV2株、BEL-279/95株、1086C 株分别有5、4、4个氨基酸的差异。目前,GXLC株对猪、鼠的致病性研究正在进行之中。
[1]Racaniello V R.Picornaviridae:The viruses and their replication,in Knipe D M,Howley P M,Griffin D E,et al.Fields Virology[M].4th Edition.Lippincott Williams&Wilkins Publishers,2001:685-715.
[2]M orishima T,Mcclintock P R,Aulakh G S,et al.Genomic and receptor attachment differences between Meng ovirus and encephalomyocarditis virus[J].Virology,1982,122(2):461-465.
[3]Sin J I,Sung J H,Suh Y S,et al.Protective immunity against heterologous challenge with encephalomyocarditis virus by VP1 DNA vaccination:effect of coinjection with a granulocy te-macrophage colony stimulating factor gene[J].Vaccine,1997,15(17-18):1827-1833.
[4]Suh Y S,Ha S J,Lee C H,et al.Enhancement of VP1-specific immune response and protection against EM CV-K challenge by co-delivery of IL-12 DNA with VP1 DNA vaccine[J].Vaccine,2001,19(15-16):1891-1898.
[5]Nelsen-Salz B,Zimmermann A,Wickert S,et al.Analysis of sequence and pathogenic properties of two variants of encepha-lomy ocarditis virus differing in a single amino acid in VP1[J].Virus Res,1996,41(2):109-122.
[6]Bae Y S,Eun H M,Yoon J W.Genomic differences between the diabetogenic and non-diabetogenic variants of encephalomyocarditis virus[J].Virology,1989,170(1):282-287.
[7]施开创,陈进喜,屈素洁,等.猪脑心肌炎病毒SYBR Green I real-time PCR检测方法的建立[J].中国兽医科学,2009,39(2):135-139.
[8]施开创,屈素洁,陈进喜,等.猪源脑心肌炎病毒GXLC株全基因组序列测定与分析[J].病毒学报,2010,26(2):134-142.
[9]Koenen F,Vanderhallen H,Papadopoulos O,et al.Comparison of the pathogenic,antigenic and molecular characteristics of two encephalomyocarditis virus(EMCV)isolates from Belgium and Greece[J].Res Vet Sci,1997,62(3):239-244.
[10]盖新娜,杨汉春,郭 鑫,等.猪脑心肌炎病毒结构蛋白VP1基因的克隆与原核表达[J].中国兽医杂志,2006,42(11):9-11.
[11]Koenen F,Vanderhallen H,Castryck F,et al.Epidemiologic,pathogenic and molecular analysis of recent encephalomyocarditis outbreaks in Belgium[J].Zentralbl Vet Med B,1999,46(4):217-231.
[12]An D J,Jeong W,Jeoung H Y,et al.Encephalomy ocarditis in Korea:serological survey in pigs and phylogenetic analysis of two historical isolates[J].Vet Microbiol,2009,137(1-2):37-44.
[13]M aurice H,Nielen M,Vyt P,et al.Factors related to the incidence of clinical encephalomyocarditis virus(EMCV)infection on Belgian pig farms[J].Pre Vet Med,2007,78(1):24-34.
[14]Kluivers M,Maurice H,Vyt P,et al.T ransmission of encephalomyocarditis virus in pigs estimated from field data in Belgium by means of R0[J].Vet Res,2006,37(6):757-766.
[15]Billinis C.Encephalomyocarditis virus infection in wildlife species in Greece[J].J Wildl Dis,2009,45(2):522-526.
[16]Oberste M S,Gotuzzo E,Blair P,et al.Human febrile illness caused by encephalomy ocarditis virus infection,Peru[J].Emerg Infect Dis,2009,15(4):640-646.
[17]Kim H S,Christianson W T,Joo H S.Pathogenic properties of encephalomyocarditis virus isolates in swine fetuses[J].A rch Virol,1989,109(1-2):51-57
[18]Denis P,Koenen F.M olecular analy sis of the capsid coding region of a virulent encephalomyocarditis virus isolate after serial cell passages and assessment of its virulence[J].Arch Virol,2003,148(5):903-912.
[19]Guy M,Chilmonczyk S,Crucire C,et al.Efficient infection of buffalo rat liver-resistant cells by encephalomyocarditis virus requires binding to cell surface sialic acids[J].J Gen Virol,2009,90(1):187-196.
Cloning and Sequence Analysis of VP1 Gene of Encephalomyocarditis Virus GXLC Strain Isolated from Swine
CHEN Jin-xi1,SHI Kai-chuang2,QU Su-jie2,ZHENG Min2,LI Xiang-tao3,CHEN Hong-bei3,XU Rui-sheng3
(1.Qinzhou Center for Animal Disease Control and Prevention,Qinzhou,Guangxi,535000,China;2.Guangxi Center for Animal Disease Control and Prevention,Nanning,Guangxi,530001,China;3.College of Animal Science and Technology,Guangxi University,Nanning,Guangxi,530005,China)
T he structural protein VP1 gene of encephalomyocarditis virus(EMCV)GXLC strain was amplified by RT-PCR,cloned into a pMD 18-T vector,sequenced and analyzed.The sequence analysis showed that the VP1 gene of GXLC strain consisted of 831 nucleotides encoding 277 amino acides and contained 2 potential N-glycosylation motifs and 9 epitopes.The homology analysis indicated the homology of GXLC strain and other EMCV strains available in GenBank were from 78.6%-99.6%and from 95.1%-99.3%based on the nucleotide and deduced amino acide sequences,respectively.The phylogenetic tree based on the VP1 gene sequences revealed that all the EMCV strains could be divided into two groups:groupⅠand groupⅡ,and groupⅠcould be subdivided into subgroupⅠa and subgroupⅠb.The strains from pig and mouse distributed in groupⅠand groupⅡ,while the strains from human distributed in groupⅡ.GXLC strain,together with other EMCV isolates from China,belonged to subgroupⅠa.
swine;Encephalomyocarditis virus;VP1 gene;molecular characteristic
S852.659.6;Q786
A
1007-5038(2010)08-0045-06
2010-05-25
广西科学基金项目(桂科青0728047);广西科技创新能力与条件建设基金项目(08-05-01D)
陈进喜(1983-),男,福建云霄人,助理兽医师,硕士,主要从事动物疫病诊断与防控技术研究。*通讯作者