孕牛血清早孕因子的生物活性检测及妊娠率分析*
张宏刚,陈树林,王晓珊,张文华,孟 霞,唐彩琰
(西北农林科技大学动物医学院,陕西杨陵 712100)
孕牛血清早孕因子的生物活性检测及妊娠率分析*
张宏刚,陈树林*,王晓珊,张文华,孟 霞,唐彩琰
(西北农林科技大学动物医学院,陕西杨陵 712100)
采用玫瑰花环抑制试验(RIT)对17头人工授精孕牛血清中早孕因子生物活性进行检测,并进行了妊娠结果回访。结果显示,孕牛在排卵后2 d~7 d内,13头孕牛血清经RIT检测出早孕因子活性,4头孕牛血清中经RIT未检测出早孕因子活性。回访发现8头孕牛娩出胎儿,2头孕牛流产,4头未妊娠,人工受精率为76.47%,妊娠率为58.82%,妊娠至分娩的成功率为47.06%,妊娠早期流产率为11.76%,测出早孕因子活性随访未妊娠的植入期胚泡丢失率为23.08%。用RIT对孕牛血清中早孕因子生物活性的研究,对建立早期妊娠诊断方法和检测早期胚胎发育情况及确定早期胚胎死亡的方法具有重要参考价值。
玫瑰花环抑制试验;早孕因子;生物活性;检测;妊娠
Morton H等于1974年首次在大鼠的体内发现了一种具有免疫调节作用的活性多肽物质——早孕因子(early pregnancy factor,EPF)[1-3],并认为它是与妊娠相关的免疫抑制蛋白,可以从妊娠早期母体的孕血清中分离提纯[4-5]。通过玫瑰花环抑制试验检测,早孕因子是母体在受精4 h后,由母体血液释放出来[6-7]。本试验用玫瑰花环抑制试验检测人工授精孕牛血清中EPF生物活性,观察孕牛的妊娠情况。人工授精是指用非性交的方法将雄性动物的精液注入到雌性动物生殖道,使卵子与精子自然结合,以达到妊娠目的一种生殖技术。
人工授精法在很多动物中有很多成功的报道。但是,采用玫瑰花环抑制试验对人工授精母牛血清EPF生物活性的检测,在国内未见报道。因此,通过人工授精后孕牛血清中EPF活性进行分析研究,对进一步研究胚胎的形成及生长状态具有重要的意义,同时检测血清中EPF为监测胚胎发育提供了一种新方法。
1 材料与方法
1.1 材料
1.1.1 阳性对照血清 取自13例,确诊为妊娠的早孕母牛(妊娠4个~5个月)血清。每份血清分别做玫瑰花环抑制试验,测定花环抑制试验后,混合分装,置-30 ℃保存,待用 。
1.1.2 阴性对照血清 采集16例无妊娠指征的健康牛血清。血清混合分装,置-30℃保存,待用。整个试验皆用同一批阳性及阴性血清作为对照,用前56℃,30 min灭活。以上孕牛排卵后2 d~7 d内采血,分离血清,分装,置-30℃保存,56℃,30 min灭活。
1.1.3 仪器设备与试剂 TDL-4Z电动离心机,常州诺基仪器有限公司产品;恒温加热磁力搅拌器,郑州南北仪器设备有限公司产品;电热恒温水箱,上海比朗仪器有限公司产品;JD-3B系列多功能电子天平,西安万科重仪器公司产品。生理盐水,肝素钠抗凝剂,台盼兰,D-Hanks平衡盐溶液等。
1.2 方法
1.2.1 采集人工授精孕牛排卵后2 d~7 d内的待测血清 对17头牛进行人工授精,其中有12头为排卵期正常的妊娠孕牛,5头为不孕症治疗过程中调整卵巢功能后有排卵发生的的妊娠孕牛。将以上两种情况分为A和B两组。
1.2.2 绵羊红细胞悬液(SRBC)的制备 常规方法对绵羊颈静脉采血,10 g/L肝素钠抗凝,分离红细胞,用D-Hanks液洗3次。配成终浓度为1×108个/mL的红细胞悬液备用。
1.2.3 人外周血淋巴细胞悬液的制备 静脉采集人血液,10 g/L肝素钠抗凝,加入等体积D-Hanks平衡盐溶液,混匀,按每管2 mL~3 mL轻轻叠加于盛有等量人淋巴细胞分离液的10 mL离心管中。3 000 r/min离心30 min。离心结束后,吸取分离液与血浆交界部位的灰白层,用5倍体积的D-Hanks液以2 000 r/min离心10 min~15 min,洗涤3次,取l滴细胞悬液。用台盼兰拒染法镜检计数细胞,计算细胞活率。活率在95%以上则用含200 mL/L犊牛血清的D-Hanks液将细胞调整到4×108个/mL,备用。
1.2.4 抗淋巴细胞血清(ALS)制备 用Ficoll梯度分离牛淋巴细胞,以PBS清洗并稀释后给兔进行为期7周的耳静脉免疫注射,于最后一次注射后第10天放血,分离血清,灭活、分装后置于-30℃保存。
1.2.5 补体(GPC)准备 选取2只雄性豚鼠,心脏穿刺采血并收集血清,将血清与牛和绵羊红细胞等量混合,4℃下吸收2 h后离心去掉红细胞,分装血清,-100℃保存。
1.2.6 用玫瑰花环抑制试验(RIT)检测孕牛血清中EPF活性 孕牛血清中EPF活性的检测,采用Morton的玫瑰花环抑制试验,并加以改进。将来自外周血液、经洗涤和稀释的牛淋巴细胞在样品血清中于 37℃孵育 30 min,再洗涤、稀释后,放入含GPC的ALS中孵育90 min,然后加入SRBC,经离心、固定、染色后观察玫瑰花环形成情况。计数1 000个淋巴细胞的玫瑰花环数量,按ALS的最高稀释倍数计算RIT,将结果与2个不加ALS的对照管的平均数进行比较。ALS的稀释倍数用其log2的倒数来表示。
RIT=Log2(10-3/ALS最高稀释倍数),当RIT≥4时,认为是EPF阳性。
每次试验均设阳性及阴性对照。凡是对照血清与预期的变化不符,结果将不予采用。
1.2.7 统计学分析 数据用SPSS 13.0进行统计分析,P<0.05数据间差异显著。
2 结果
2.1 阳性对照血清RIT值范围
13份妊娠 4个~5个月孕牛血清,RIT值是6.39±0.87,范围为5~7。
2.2 阴性对照血清RIT值范围
16份阴性对照血清,RIT值是3.67±0.43,范围为3~4,构成非妊娠范围。当RIT值大于4,则表明样本内存在EPF活性。
2.3 待测人工授精孕牛血清
17头人工受精的孕牛排卵后2 d~7 d血清中EPF活性测定及随访结果见表1。从表1可知,17头人工授精的孕牛血液中13头经玫瑰花环抑制试验检测出EPF活性,4头孕牛血清中经玫瑰花环抑制试验未检测出EPF活性。随访发现8头孕牛娩出胎儿,2头孕牛流产,4头未妊娠。在A组试验中,第1头~9头牛经RIT检测出EPF活性,但随访未妊娠推测可能是胚泡丢失所致;第10头~12头牛血清中未检测出EPF活性。在B组试验中,第13头~16头牛血清经RIT检测出EPF活性,但随访未妊娠推测是胚泡丢失所致;第17头牛血清中未检测出EPF活性。结果表明,此17头人工授精牛受精率为76.47%(13/17),经统计学分析P>0.05,A和B两组受精率的差别无显著性,见表2。而且妊娠率为58.82%(10/17),其中妊娠至分娩的成功率为 47.06%(8/17),妊娠早期流产率为11.76%(2/17),测出EPF活性随访未妊娠的植入期胚泡丢失率为23.08%(3/13)。EPF阳性和EPF阴性率的分布状况如表3,胎儿产出率和胚胎消失率如表4。同时,发现EPF阴性牛均未妊娠。从表1中看出,对17头人工授精的孕牛排卵后2 d~7 d血清中EPF活性测定发现,13头人工授精的孕牛血清中EPF呈阳性(+),并且 RIT>4,表明13头人工授精的孕牛血清中有EPF活性;4头人工授精的孕牛血清中EPF呈阴性(-),并且 RIT<4,表明4头人工授精的孕牛血清中没有EPF活性;对17头人工授精的孕牛随访结果发现,8头孕牛娩出胎儿,2头孕牛流产,3头孕牛胚泡丢失,4头孕牛未妊娠。
EPF活性由分裂中的胚胎产生,当卵子受精48 h后,可在母体血中检测出。试验表明,卵子受精48 h~7 d内,血清中存在EPF活性(表 1),若胚泡植入障碍或胚胎流产,则曾经出现的EPF活性随之消失。通过EPF活性的检测,可在胚泡植入前确定人工授精者受精发生,及早防治内分泌失调等因素引起的植入前胚泡丢失,进一步确定妊娠早期胚胎状况。
由表2可以看出,对17头人工授精的孕牛排卵后2 d~7 d血清中EPF检测发现,13头牛EPF活性检测为阳性,有活性,表明能够妊娠;4头牛EPF活性检测为阴性,无活性,表明未妊娠。统计学分析表明,且P>0.05,A和B两组受精率的差别无显著性(P>0.05)。
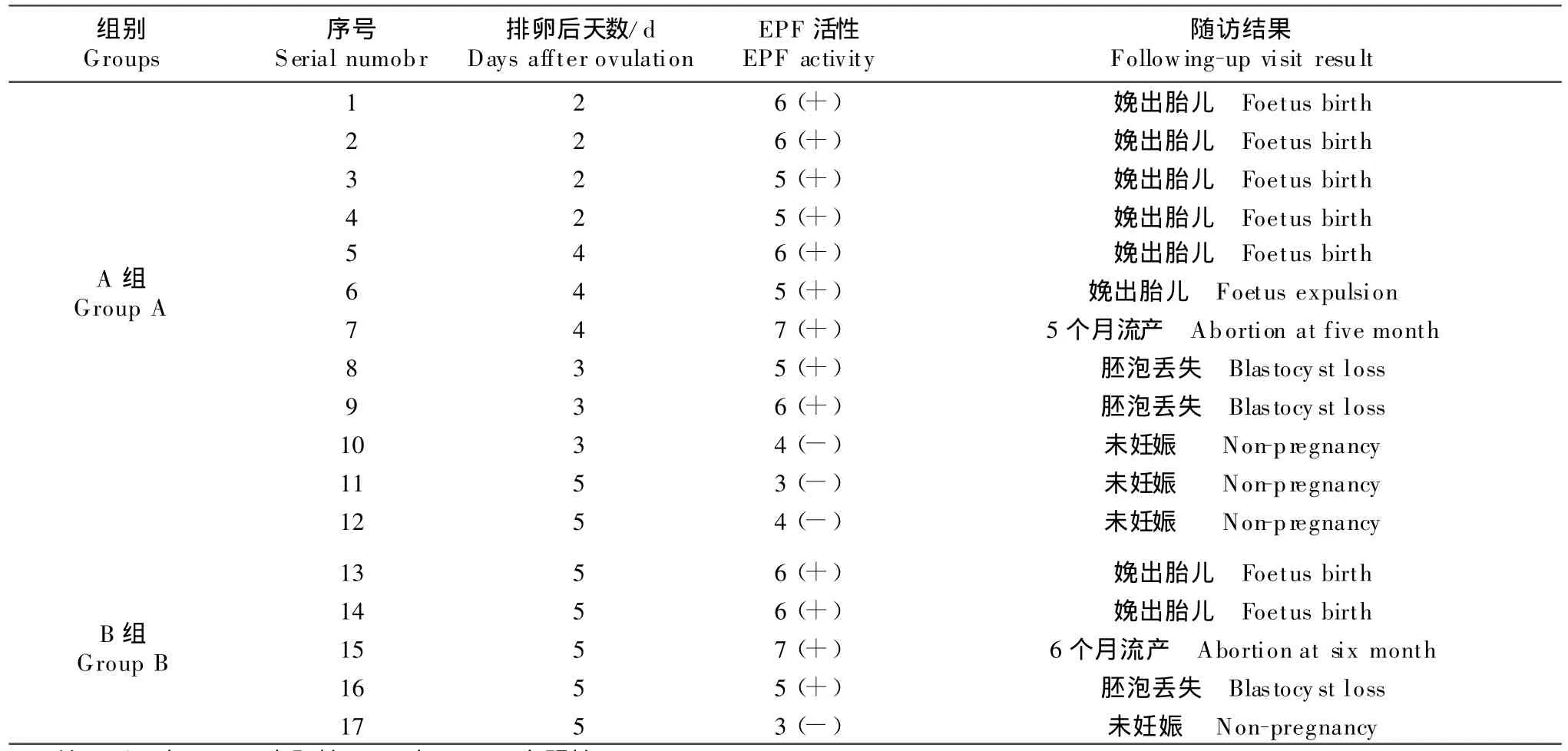
表1 17头孕牛血清中EPF活性测定及随访结果Table 1 T he results of seral EPF bioactivity detection and following-up visity in 17 cows

表2 17头孕牛排卵后2 d~7 d血液中EPF检测结果Table 2 The results of seral EPF detection 2-7 d after ovulation in 17 cows
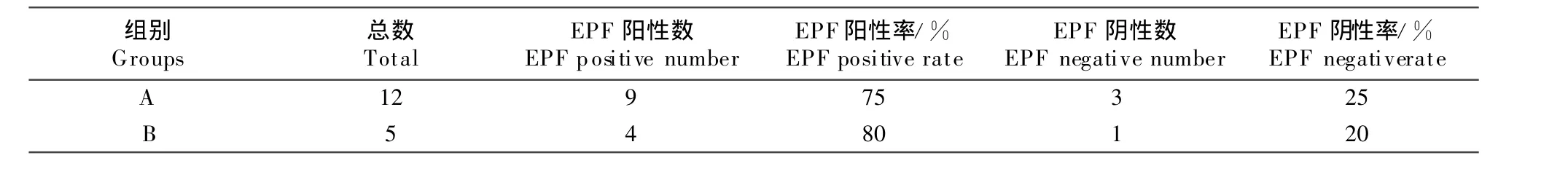
表3 EPF阳性率和EPF阴性率的分布状况Table 3 The distribution of EPF-positive rate and EPF-negative rate
由图3可知,通过RIT结果显示,EPF阳性率远远大于EPF阴性率。

表4 胎儿产出率和胚胎消失率Table 4 Fetal birth rate and embryo loss rate
由表4可知,17头妊娠牛胎儿产出率接近50%,胚胎消失率接近18.5%,胎儿产出率要远远高于胚胎消失率。
3 讨论
目前有关EPF的研究十分活跃,普遍认为EPF与受精卵的出现和胚胎成活密切相关。当精子穿透卵子形成受精卵后,受精卵开始分泌早孕因子释放因子,卵巢在该因子的作用下分泌早孕因子,早孕因子的分泌与胚胎在母体子宫内免受机体免疫系统的排斥有关。早孕因子释放因子的分泌及分泌量代表了胚胎的形成及在子宫内的生长状态,而早孕因子的分泌受早孕因子释放因子正反馈调节,其分泌量与早孕因子释放因子的分泌量呈正相关[8-10]。因此,用玫瑰花环抑制试验对人工授精的孕牛血清EPF生物活性的检测,可以对胚胎的形成及生长状态进行预测[11-13]。本试验采用玫瑰花环抑制试验对17头人工授精的母牛血清EPF生物活性进行检测,并非所有经过人工授精的孕牛,其受精卵都能发育至正常妊娠。有些胚胎在很早期就消失而未引起注意,另外一些死亡较晚归于早期流产[14-15]。通过试验发现8头孕牛娩出胎儿,2头孕牛流产,4头未妊娠,3头胚泡丢失;13头有EPF活性,4头无EPF活性。EPF的活性由分裂中的胚胎产生,当卵子受精48 h后,可在母体血液中检测出。我们的研究也证实,卵子受精48 h~7 d内,血液中存在EPF活性,若胚泡植入障碍,则曾经出现的 EPF活性随之消失。经人工授精后,A组的第8、9号牛和B组的第16号牛,在排卵后2 d~7 d内,其血液中出现EPF活性,而受精7 d以后因胚泡植入障碍,排卵受精7 d前血液中曾出现的EPF活性随之消失。从另一个角度说明了,受精7 d以后胚泡未植入子宫内膜。本试验研究显示,胚泡丢失率17.65%,胚泡丢失的原因可能与受精卵发育异常,子宫内膜病变,内分泌失调及免疫因子有关。本试验结果为牛的早期妊娠诊断及今后进一步研究奶牛妊娠调控提供了依据。
总之,EPF活性检测,可在胚泡植入前确定人工授精后胚泡发育状况,及早防治内分泌失调等因素引起的植入前胚泡丢失,有利于建立对胚胎的形成及生长状态进行预测,同时检测血清中EPF为监测胚胎发育提供了一种新方法。因此,用玫瑰花环抑制试验对人工授精的孕牛血液EPF生物活性的研究,对建立早期妊娠诊断方法和检测早期胚胎发育情况以及确定早期胚胎死亡的方法具有重要意义。
[1]M orton H,Hegh V,Clunie G J A.Immunosuppression detected in pregnant mice by rosette inhibition test[J].Nature,1974,249:456-459.
[2]M orton H,Rolfe B E,Cavanagh A C.Ovum factor and early pregnancy factor[J].Current Topics in Develop Biol,1987,23:73-92.
[3]Fan X G,Zheng Z Q.A study of early preg nancy facto r activity in preimplantation[J].Am J Repro Immunol,1997,37(5):359-364.
[4]Mehta A R,Eessalu T E,Aggarwal B B.Purification and characterization of early pregnancy factor from human pregnancy sera[J].J Biol Chem,1989,264(4):2266-2671.
[5]Ohnuma K,Ito K,T akahashi J.Partial purification of mare early pregnancy factor[J].Am J Repro Immunol,2004,51(2):95-101.
[6]Ghaffari Laleh V,Ghaffari Laleh R,Pirany N.Measurement of EPF for detection of cow pregnancy using rosette inhibition test[J].Theriogenology,2008,70(1):105-107.
[7]权 凯,张改平.应用Ea玫瑰花环抑制试验检测奶牛血清EPF活性[J].中国奶牛,2008,6:29-31.
[8]王晓申,魏丽军,叶绍辉.早孕因子研究进展[J].生物技术通讯,2008,19(2):313-316.
[9]贾 斌,李仁燕,郭玉强,等.家畜早孕因子的研究现状及其应用[J].石河子大学学报,2007,25(6):711-715.
[10]权 凯,张改平.早孕因子的生物学特性及其在动物繁殖领域中的应用[J].中国畜牧兽医,2009,36(4):122-124.
[11]钟苑仪,邓莉莉,钟菀杞,等.早孕因子在妇产科领域的研究进展[J].临床和实验医学杂志,2010,9(2):150-152.
[12]Athanasas-Platsis S,Cavanagh A C,M orton H,et al.Early pregnancy factoris required at two important stages of embryonic development in the mouse[J].Am J Repro Immunol,2008,43(4):223-233.
[13]Athanasis-Plastis S,Morton H,Dunglison G F,et al.Antibodies to early pregnancy factor retard embryonic development in vitro[J].J Repro Fertil,1991,92:443-451.
[14]Cheng S J,Ma A Y,Qiao C X,et al.Early pregnancy factor activity in serum of patients with surgical abortion[J].Am J Repro Immunol,2008,44(4):211-213.
[15]Nancarrow C D,Evison B M,Scaramuzzi R J,et al.Detection of induced death of embryos in sheep by rosette inhibition test[J].J Repro Fertil,1979,57(2):385-389.
Detection of Biological Activity of EPF from Sera of Pregnant Cows and Analysis of the Pregnant Rate
ZHANG Hong-gang,CHEN Shu-lin,WANG Xiao-shan,ZHANG Wen-hua,MENG Xia,TANG Cai-yan
(College of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi,712100,China)
T he 17 seral samples of pregnant cows were detected for biological activity of early pregnancy factor by rosette inhibition test,and followed with returning visit investigation.The results showed that 13 samples were positive for EPF activity and 4 samples without EPF activity within 2 d-7 d after ovulation.The returning visit results showed that 18 pregnant cows gave birth to fetus,2 pregnant cows aborted,4 cows were non-pregnant.And artificial insemination rate was 76.47%,pregnanct rate was 58.82%,the success of pregnany to delivery was 47.06%,early pregnant abortion rate was 11.76%,embryo loss rate of 23.08%.The study of biological activity of seral EPF of pregnant cows with rosette inhibition test has significant reference value for early pregnant diagnosis,for early embryo growth detection and early embryonic death determination.
rosette inhibition test;early pregnancy factor;biological activity;detection;pregnancy
Q954.52
A
1007-5038(2010)08-0030-04
2010-06-08
国家自然科学基金(30972151);陕西省“13115”重大科技专项(2008ZDKG-05)
张宏刚(1982-),男,陕西扶风人,硕士研究生,主要从事细胞工程研究。*通讯作者

