云南省禽流感、新城疫与3种免疫抑制性病原共感染的检测
宋建领,石凤海,田建国,叶丛华,张文东,赵焕云,吕 粤,岳 亮,李华春,邱 薇,冯子良,张思东,范泉水,张应国,张富强*
(1.云南省热带亚热带动物病毒病重点实验室,云南昆明650224;2.临沧市动物疫病预防控制中心,云南临沧67000;3.云南农业大学,云南昆明650223;4.云南省动物疫病预防控制中心,云南昆明650051;5.成都军区疾病预防控制中心,云南昆明650032)
云南省禽流感、新城疫与3种免疫抑制性病原共感染的检测
宋建领1,石凤海2,田建国3,叶丛华3,张文东4,赵焕云4,吕 粤4,岳 亮4,李华春1,邱 薇5,冯子良5,张思东4,范泉水5,张应国4,张富强5*
(1.云南省热带亚热带动物病毒病重点实验室,云南昆明650224;2.临沧市动物疫病预防控制中心,云南临沧67000;3.云南农业大学,云南昆明650223;4.云南省动物疫病预防控制中心,云南昆明650051;5.成都军区疾病预防控制中心,云南昆明650032)
为调查云南省禽流感病毒、新城疫病毒与免疫抑制性病毒混合感染的情况,对云南省2007年1月~2009年10月期间145份禽流感阳性及30份新城疫阳性样品进行禽网状内皮增生病病毒(REV)、J亚群禽白血病病毒(ALV-J)及鸡传染性贫血病毒(CIAV)的检测。禽流感阳性样品中ALV-J的感染阳性率为15.9%,REV的感染阳性率为22.8%,CIAV的感染阳性率为26.9%;新城疫阳性样品中ALV-J的感染阳性率为13.3%,REV的感染阳性率为23.3%,CIAV的感染阳性率为26.7%;共有30份样品发生多重感染,多重感染率为17.1%。对不同区域的4份禽白血病病毒阳性样品、10份禽网状内皮增生病病毒阳性样品、10份禽传染性贫血病毒阳性样品进行了序列比对和系统发育分析。结果表明,云南ALV-J毒株gp85基因与国内外毒株核苷酸及氨基酸同源性分别介于80.4%~96.7%、85.2%~94.5%;REV毒株env基因核苷酸及氨基酸之间的同源性为98.8%~99.8%、97.7%~99.5%;CIAV毒株vp2基因核苷酸及氨基酸之间的同源性为92.4%~100.0%、93.7%~100.0%。
禽流感病毒;新城疫病毒;gp85基因;env基因;vp2基因
随着国内畜牧业的不断发展,养禽业的发展也非常迅速,伴随着快速的发展,鸡的传染性疾病也越来越多,而这其中大多数都与免疫抑制性疾病相关。在养禽业中,鸡传染性贫血、马立克病、网状内皮组织增生、禽白血病等免疫抑制病的共同特征是引起鸡群原发感染,侵害机体的免疫器官,使感染鸡的免疫功能受到损害,导致机体抵抗力下降,进而引发其他疾病的并发或继发感染,使病情复杂造成更大的经济损失[1-3]。免疫抑制病感染鸡群后一般不表现临床症状,通常是亚临床感染或混合感染,在一定程度上给疾病的防治带来较大困难,给养禽业造成巨大的间接经济损失[4]。另外,免疫抑制病严重影响禽类的生产性能,尤其对肉鸡的生长影响最大[5]。因此分析免疫抑制病流行病学及其与当前禽类的重大流行病的相关性,将为禽类传染病的预防控制奠定理论基础,减少养禽业因疾病引起的经济损失。
1 材料与方法
1.1 材料
1.1.1 样品 云南省内的禽类喉拭子或泄殖腔拭子,经禽流感和新城疫RT-PCR检测的145份禽流感阳性及30份新城疫阳性样品。
1.1.2 试剂 病毒RNA/DNA提取试剂盒(Viral DNA/RNA Extraction Kit Ver.3.0)、PCR产物胶回收试剂盒及质粒(小量)抽提试剂盒购自上海华舜生物工程有限公司;PCR扩增试剂盒购自宝生物工程(大连)有限公司;PCR Amplification kit、RNA 酶抑制剂购自TaKaRa公司;pMD18-T载体均购自宝生物工程(大连)有限公司;DH5α大肠埃希氏菌及其感受态细胞由云南省热带亚热带动物病毒病重点实验室制备、保存。
1.2 方法
1.2.1 引物 根据国内外已发表的禽白血病病毒gp85基因序列、禽网状内皮增生病病毒env基因序列、禽传染性贫血病病毒vp2基因序列及相关文献[6-7],分别设计检测引物 ALVH5F/ALVH7R、EV1/EV2、RENV-1/RENV-2、RENVF/RENVR、CIAVF/CIAVR详细情况见表1。

表1 PCR和RT-PCR引物Table 1 Primers used for PCR and RT-PCR
1.2.2 病毒基因组RNA/DNA的抽提 按试剂盒提供操作步骤进行。PCR反应体系的配置,按试剂盒说明书操作。
1.2.3 特异性分析及克隆 将PCR检测的阳性样品,产物经电泳分离,凝胶切割纯化,定量,确定目的基因浓度后,克隆T载体。
1.2.4 重组质粒构建和鉴定 取10 μ L克隆反应物转化DH5α感受态细胞后,涂布Ampcilin抗性平板过夜,挑取孤立的白色菌落,采用PCR鉴定阳性菌落。阳性菌落增殖培养后,提取质粒,再经PCR进行重组质粒鉴定,置-20℃保存。
1.2.5 序列分析 阳性重组质粒送上海生工生物工程技术有限公司进行测序。采用DNA Man Version 5.2.2软件进行序列比对和系统发育分析。

图1 禽白血病病毒RT-PCR扩增结果Fig.1 RT-PCR results of env gene of A LV-J
2 结果
2.1 PCR检测结果
经试验筛选优化具体反应条件分别为:鸡传染性贫血:95℃1 min;94℃50 s,52℃50 s,72℃1 min,35个循环;72℃延伸 10 min。禽白血病:42℃45 min,95℃5 min;94℃30 s,52℃30 s,72℃1 min,35个循环;72℃延伸10 min。网状内皮增生病:42℃45 min;95℃5 min;94℃30 s,56℃30 s,68℃1 min 30 s,35个循环;68℃延伸10 min。用禽白血病病毒特异性引物检测禽白血病样品,获得与预期结果一致的545 bp PCR产物(图1)。用鸡传染性贫血特异性引物检测鸡传染性贫血样品,获得与预期结果一致的582 bp PCR产物(图2)。网状内皮增生,获得与预期结果一致的642 bp PCR产物(图3)。
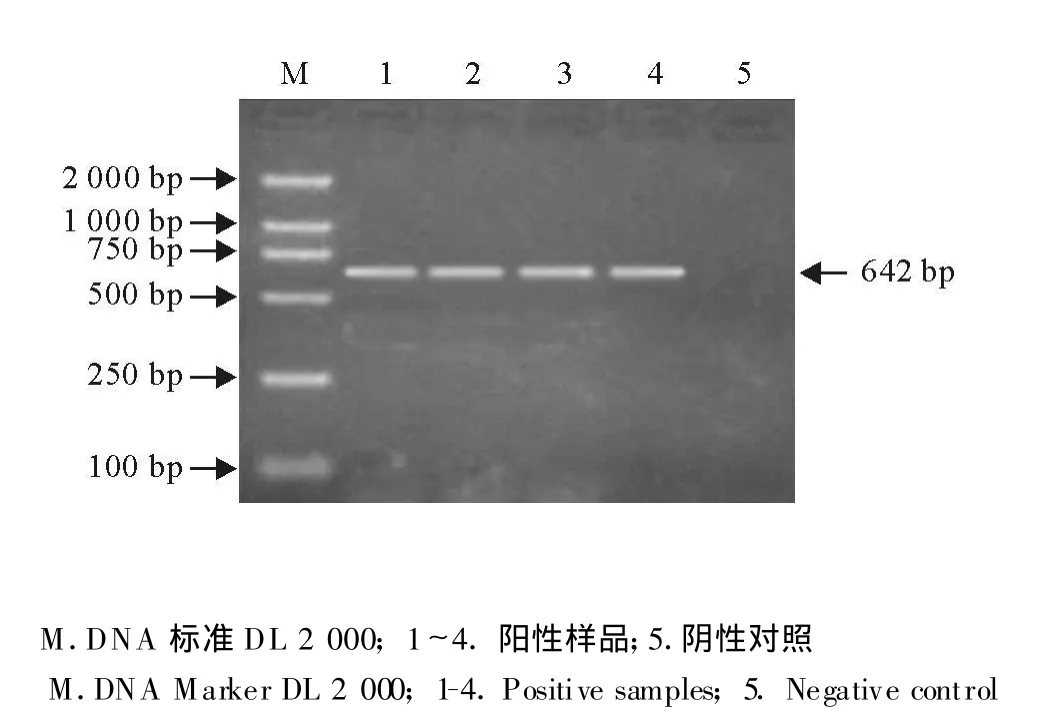
图2 禽网状内皮增生病毒RT-PCR扩增结果 Fig.2 RT-PCR results of REV

图3 禽传染性贫血病毒PCR扩增结果Fig.3 PCR results of CIA V
2.2 混合感染结果
145份禽流感阳性样品中ALV-J阳性的23份,阳性率为 15.9%;REV阳性的 33份,阳性率为22.8%;CIAV阳性的39份,阳性率为26.9%;30份新城疫阳性样品中ALV-J阳性的4份,阳性率为13.3%;REV阳性的7份,阳性率为23.3%;CIAV阳性的8份,阳性率为26.7%;共有30份样品(禽流感24份,新城疫6份)发生多重感染,多重感染率为17.1%。其中9份样品(禽流感8份,新城疫1份)出现ALV-J和CIAV二重感染,7份样品出现REV和CIAV二重感染(禽流感3份,新城疫4份),9份样品(禽流感9份,新城疫0份)出现ALV-J和REV二重感染,5份样品(禽流感4份,新城疫1份)出现ALV-J、REV及CIAV三重感染。
2.3 阳性样品序列分析
2.3.1 禽白血病病毒gp85基因序列分析 选择不同区域的4份禽白血病病毒阳性样品进行了序列比对和系统发育分析,结果表明,云南 ALV-J毒株gp85基因与国内外毒株核苷酸及氨基酸同源性分别为80.4%~96.7%和85.2%~94.5%。系统进化树见图4。

图4 白血病病毒gp85基因系统进化树Fig.4 Phylogenetic tree for the gp85 genes of ALV
云南禽白血病病毒株的氨基酸序列与美国源型株ADOL-hc-1和英国源型株HPRS-103相比较,云南毒株在 61 、65、112、113、114、184、188、189 aa 出现变异,在63、115、185 aa~187 aa缺失导致云南毒株在62 aa~64 aa的糖基化位点丢失(表2)。

表2 ALV-J gp85基因氨基酸的缺失及潜在糖基化位点的变异Table 2 Deletion of amino acid and variation of potential glycosylation sites of gp85 gene in ALV-J
2.3.2 禽网状内皮增生病病毒env基因序列分析
选择不同区域的10份禽网状内皮增生病病毒阳性样品进行了序列比对和系统发育分析。结果表明,云南REV毒株env基因核苷酸及氨基酸之间的同源性为98.8%~99.8%和97.7%~99.5%。与国内外毒株核苷酸和氨基酸之间的同源性都在95%以上。系统进化树见图5。
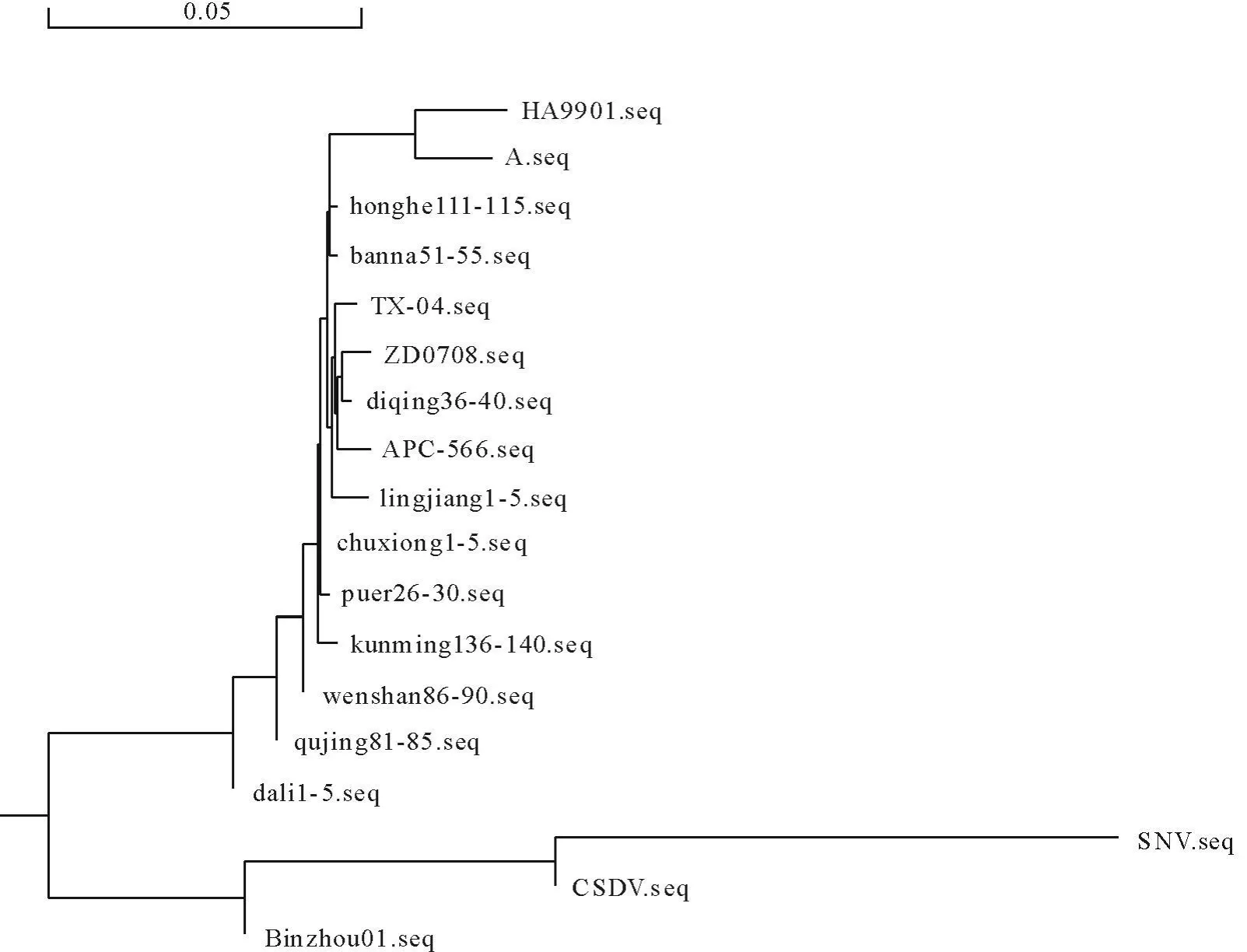
图5 禽网状内皮增生病毒env基因系统进化树Fig.5 Phylogenetic tree for the env genes of REV
2.3.3 禽传染性贫血病毒vp2基因序列分析 选择不同区域的10份禽传染性贫血病毒阳性样品进行了序列比对和系统发育分析。结果表明,云南CIAV毒株vp2基因核苷酸及氨基酸之间的同源性在92.4%~100.0%、93.7%~100.0%。与国内外一些毒株核苷酸及氨基酸之间的同源性在92.1%~100.0%、95.0%~100%(图6)。
3 讨论
本次检测样品中 ALV-J阳性率为 13.3%~15.9%,REV阳性率22.8%~23.3%;CIAV阳性率为26.7%~26.9%,多重感染率为17.1%,比国内外报道感染阳性率偏低[5]。这可能与病料的采集有一定的关系,本次检测主要以检测禽流感的感染情况为主,只采集了喉拭子和泄殖腔拭子,未采集内脏器官样品。而免疫抑制病主要侵害免疫系统。
我国部分商业化鸡群中免疫抑制病的感染已经相当普遍,在广西、安徽、山东、河南、北京、内蒙古等地均有报道[8-10],其中鸡传染性贫血病的阳性检出率高达65.6%,其中存在二重、三重甚至四重感染的报道[5,11-12]。在云南省内感染禽流感的鸡场中鸡传染性贫血病、禽白血病和禽网状内皮增生病均存在不同程度的感染,甚至出现两种或三种混合存在的多重感染。因此免疫抑制病可能是引发我国部分地区鸡群出现免疫失败或多种疾病混合感染的原因之一,在疾病的防治方面应当充分考虑免疫抑制病存在的因素。

图6 禽传染性贫血vp2基因系统进化树Fig.6 Phylogenetic tree for the vp2 genes of CIAV
ALV-J可通过垂直传播和水平传播引起成年肉鸡的骨髓细胞瘤,导致很高的死亡率、肿瘤发生、生产性能降低、淘汰费用增加等,对肉鸡的饲养业造成巨大经济损失。关于本病的诊断方法很多,如病毒分离、免疫组化、原位杂交以及PCR技术等[13-14]。ALV-J囊膜糖蛋白的 env gp85基因与其他亚群ALV相比,缺少93-126碱基对,与其他 A-E亚群ALV的env gp85基因只有40%同源性,而A-E亚群间的同源性为80%~85%。因此,gp85囊膜糖蛋白是ALV-J的亚群表型决定因素。通过检测gp85囊膜糖蛋白或 env gp85编码基因,可以确诊该病[15]。本研究根据ALV-J囊膜糖蛋白的env gp85基因设计引物,建立的PCR诊断方法为该病的诊断奠定了基础。系统发育分析表明,云南ALV毒株与国外毒株和国内最早发现毒株都有很大的差异,而云南毒株zhaotong51-55与北京毒株BJ0302亲缘关系更近。
REV感染自然宿主后,大多情况不会对机体细胞造成损害,但某些情况下会导致细胞转化(瘤细胞化)或引起细胞病变,这在被感染宿主的免疫器官表现尤为明显。REV与其他免疫抑制病混合感染,引起的免疫抑制效果更大[16]。云南毒株与国内外代表毒株没有太大的差异,说明REV毒株的env基因在核苷酸水平上比较保守,几乎没有任何变异。
鸡传染性贫血病以贫血、胸腺萎缩、骨髓黄化、造血机能障碍和免疫机能受损为主要特征。自1979年Yuasa N等[17]在日本首次分离到鸡传染性贫血病病毒以来,世界上许多国家包括我国在内相继证明了该病毒的存在。目前,CIA对养鸡业的危害不断上升,已引起世界各养禽国家的广泛关注。云南禽传染性贫血病病毒毒株与国外一些毒株核苷酸之间的同源性为92.1%~100.0%,与天津毒株的核苷酸同源性在99.1%以上,表明云南毒株vp2基因变异不大。
[1]崔治中,杜 岩,赵文明,等.禽网状内皮组织增生病病毒感染和鸡群的免疫抑制[J].中国兽药杂志,2000(1):3-5.
[2]刘公平,赵振芬,刘福安,等.禽白血病病毒研究进展[J].中国兽医学报,2000,20(6):621-623.
[3]杨克礼,俆涤平,梁望旺,等.鸡传染性贫血病研究进展[J].家禽科学,2007(4):41-45.
[4]姜世金,孟珊珊,崔治中,等.我国自然发病鸡群中MDV、REV和CAV共感染的检测[J].中国病毒学,2005,20(2):164-167.
[5]崔治中,孟珊珊,姜世金,等.我国白羽肉用型鸡群中CAV、REV和REOV感染状况的血清学调查[J].畜牧兽医学报,2006,37(2):152-157.
[6]Pham T D,Spencer J L,Johnson E S.Detection of avian leucosis virus in albumen of chicken eggs using reverse transcription poly merase chain reaction[J].J Virol M athods,1999,78:1-11.
[7]Kim Y,Gharaibeh S M,Stedman N L,et al.Comparison and verification of quantitative competitive reverse transcription poly merase chain reaction(QC-RT-PCR)and real time RT-PCR for avian leucosis virus subg roup J[J].J Virol M athods,2002,102:1-8.
[8]何勇群,张中直,杨汉春.北京地区鸡群网状内皮组织增殖病感染的血清学调查研究[J].畜牧兽医学报,1998,29(1):71-78.
[9]刘岳龙,崔治中,段玉友.PCR和斑点杂交检测鸡传染性贫血病毒[J].中国兽医学报,1996(1),16:38-41.
[10]徐镔蕊,董卫星,余春明,等.蛋鸡J亚群禽白血病的分子生物学诊断[J].病毒学报,2005,21(4):289-292.
[11]张 志,崔治中,姜世金.从 J亚群禽白血病肿瘤中检测出禽网状内皮组织增生症病毒[J].中国兽医学报,2004,24(1):10-13.
[12]崔治中.免疫抑制性病毒多重感染在鸡群疫病发生和流行中的作用[J].畜牧兽医学报,2003,34(5):417-421.
[13]Spencer J L.Progress towards eradication of lymphoid leukosis viruses-a review[J].Avian Pathol,1984,13(5):599-619.
[14]Pham T D,Spencer J L,Vicki L,et al.Detection of exogenous and endogenous avian leukosis virus in commercial chicken eggs using reverse transcription and poly merase chain reaction assay[J].Avian Pathol,1999,28(3):385-392.
[15]Bai J L,Payne N,Skinner M A.HPRS-103(exogenous avianleukosis virus,subgroup J)has an env gene related to those of endogenous elements EAV-0 and E51 and an E element found previously only in sarcoma viruses[J].J Virol,1995,69(6):779-784.
[16]李广兴,刘忠贵,郎跃深.SPF雏鸡感染网状内皮组织增殖病病毒后白细胞介素2和干扰素诱生活性的变化[J].中国兽医科技,2000,30(4):3-5.
[17]Yuasa N,Taniguehi T,Yoshida I.Isolation and Some characteristics of an agent inducing anemia in chickens[J].Avian Dis,1979,23(4):366-385.
Detection of Mixed Infections of AIV,NDV and Three Kinds of Immunosuppressive Viruses in Yunnan Province
SONG Jian-ling1,SHI Feng-hai2,TIAN Jian-guo3,YE Cong-hua3,ZHANG Wen-dong4,ZHAO Huan-yun4,L¨U Yue4,YUE Liang4,LI Hua-chun1,QIU Wei5,FENG Zi-iang5,ZHANG Si-dong4,FAN Quan-shui5,ZHANG Ying-guo4,ZHANG Fu-qiang5
(1.Y unnan Tropical and Subtropical Animal Virus Diseases Laboratory,K unming,Y unnan,650224,China;2.Centre for Animal Disease Control and Prevention of Lincang,Lincang,Y unnan,677000,China;3.Yunnan Agriculture University,K unming,Yunnan,650223,China;4.Centre f or Animal Disease Prevention and Control,Y unnan province,K unming,Y unnan,65001,China;5.Centre for Disease Prevention and Control,Cheng Du Military Region,K unming,Y unnan,650032,China)
In order to investigate the mixed infections of AIV,NDV and immunosuppressive viruses in Yunnan province,145 positive samples for AIV and 30 positive samples for NDV were detected by RT-PCR for poultry Reticuloendothelial virus(REV),J subgroup avian leukosis virus(ALV-J)and chicken infectious anemia virus(CIAV)from January 2007 to October 2009 in Yunnan Province.In positive for AIV samples,ALV-J infection rate was 15.9%,REV was 22.8%and CIAV was 26.9%;in positive for NDV samples,ALV-J infection rate was 13.3%,REV was 23.3%and CIAV was 26.7%;a total of 30 samples appeared multiple infections,the infection rate was 17.1%.4 positive ALV-J,10 poultry REV and 10 samples were used for sequence and phylogenetic analysis in different regions of Yunnan province.The results showed that:the nucleotide and amino acid homologies of ALV-J gp85 gene of Yunnan strain with domestic and overseas strains were ranged from 80.4%-96.7%,85.2%-94.5%;the nucleotide and amino acid homologies of env gene of REV strain were 98.8%-99.8%,97.7%-99.5%;the vp2 gene of CIAV strain were 92.4%-100.0%,93.7%-100.0%.
Avian influenza virus;Newcastle disease virus;gp85 gene;env gene;vp2 gene
S858.3
A
1007-5038(2010)08-0024-06
2010-03-01
资金项目:云南省科技攻关项目(2006NG-24);云南省后备人才基金项目(2009CI061);云南省高层次科技人才培引工
程(20080C002);农业部农业公益性行业科研专项(200803026)
宋建领(1974-),男,山东单县人,副研究员,主要从事动物疾病诊断方法的建立和病原表位分析研究。*

